导管体外端保护装置在大鼠长期腰蛛网膜下腔置管模型中的应用
2011-10-19杜世伟包新杰魏俊吉王任直
杜世伟,包新杰,冯 铭,魏俊吉,郭 旭,王任直
(中国医学科学院北京协和医学院北京协和医院神经外科,北京 100730)
导管体外端保护装置在大鼠长期腰蛛网膜下腔置管模型中的应用
杜世伟,包新杰,冯 铭,魏俊吉,郭 旭,王任直
(中国医学科学院北京协和医学院北京协和医院神经外科,北京 100730)
目的 设计一种大鼠长期腰蛛网膜下腔置管模型中微导管体外端的保护装置,并证明其有效性。方法24只清洁级SD大鼠分为对照组(n=12)和应用装置组(n=12),术前1 d和术后第1、3、7天行转棒和热水甩尾试验,检查置入装置对大鼠运动及感觉神经功能影响情况。计数术后大鼠导管保留情况,利多卡因试验证实导管性能。结果 本次试验两组大鼠术后均无死亡及明显瘫痪情况;术前及术后1,3,7 d转棒实验及热水甩尾实验均未见两组明显差异(P>0.05,独立样本T检验,);对照组体外导管末端在术后几天内被损毁或拔出无法进行进一步实验,术后第7天应用装置组所有导管末端仍保持完整,利多卡因实验显示导管功能良好(P>0.05,χ2检验)。结论 该装置可有效保护置入大鼠腰蛛网膜下腔导管的体外端,非常适用于需要长期反复腰蛛网膜下腔注射的研究。
保护装置;蛛网膜下腔置管;大鼠
大鼠蛛网膜下腔长期置管模型是由Yaksh和Rudy在1976年发明,随后被广泛应用于麻醉、镇痛以及神经科学等研究领域[1]。但随着这一经典模型的流行,它的一些缺点也逐渐显露出来,置管后体外段的保留问题就是其中之一。报道发现在置管后几天内,50%的置管体外段都会被大鼠毁坏而造成模型无法使用,而且每次注药都需要切断导管末端,注药后需要重新加热封闭导管末端,不但增加了操作的复杂性,也增加感染可能[1~3]。为了解决这一问题,我们设计并制作了置入大鼠皮下的导管末端保护装置,解决了大鼠腰蛛网膜下腔置管后导管末端保留问题并且简化了反复注药操作,介绍如下。
1 材料和方法
1.1 实验动物及材料
清洁级SD大鼠,雄性,250~300g,由中国人民解放军军事科学院提供[SCXK(0014281)];蛛网膜下腔引流管(外径 1.0 mm,内径 0.5 mm,BD Perisafe,苏州,中国);聚乙烯输注管(外径 2.0 mm,内径1.0 mm,BAYER,Fresenius Kabi,德国);1mL 注射器(BD,Becton Dickinson,新加坡);2%利多卡因注射液(国产);DXP-2大小鼠转棒仪(中国医学科学院药物研究所);体式显微镜及显微手术器材(国产)。
1.2 大鼠腰蛛网膜下腔导管及末端保护装置的制作
本实验采用改造的人腰蛛网膜下腔引流管作为大鼠腰蛛网膜下腔导管。切取一段引流管,将其一端置入沸水中拉长,使其外径降至0.35 mm左右,作为蛛网膜下腔置入端。纤细的置入段可以降低置管过程中导管对脊髓的损伤[2,4]。修整导管长度,带有末端保护装置的导管保留总长度为5.5 cm,其中拉长段约3 cm。而没有末端保护装置的导管总长度需要15 cm左右,同样保留拉长段约3 cm。末端保护装置分为两部分,穿刺囊和连接管,穿刺囊是取自1 mL注射器的橡胶塞,筒状,内径2.0 mm,长度5.0 mm,经试验其底面可以反复穿刺而不出现液体渗漏。连接管长1 cm,切取自聚乙烯输注管,其内径与外径恰好与导管和穿刺囊匹配。将连接管一端插入穿刺囊底部,另一端与导管未拉伸端连接。连接管可以紧密的将导管和穿刺囊连接起来,形成一整体,必要时可使用树脂胶进行加固,结构如图1。所有置入装置置入前均进行灭菌消毒。
1.3 手术过程
健康雄性清洁级SD大鼠24只,随机分为对照组(n=12)和应用装置组(n=12)。所有大鼠采用腹腔注射10%水合氯醛(0.3~0.4 mL/100 g)麻醉。麻醉显效后,大鼠俯卧位,腹下垫20 mL注射器针筒以扩大棘突间隙,L5-6处去毛消毒后采用正中直切口切开皮肤,显微镜下分离椎旁肌肉至椎板,清除L5-6椎间隙间韧带直至硬膜外,24G针头挑开硬脊膜,可见脑脊液渗出。改进的置入装置内充满无菌生理盐水,将拉长段小心的向头端方向置入蛛网膜下腔约3 cm,3-0无菌带针丝线将导管固定于L5棘突或椎旁肌肉、筋膜上,缝合椎旁肌肉及背部筋膜。穿刺囊置于皮下椎旁,穿刺底面朝向尾端,固定于背部筋膜之上,缝合背部皮肤(图2)。对照组采用目前较多采用的导管末端保留方法,置入导管及固定后,导管末端在皮下潜行至大鼠枕部两耳之间穿出皮肤固定,体外保留2~3 cm长度,10 μL无菌生理盐水冲洗导管后,加热封闭末端。所有大鼠术后返回鼠笼,自然苏醒。

图1 置入导管及保护装置组装后实物Fig.1 Schematic illustration of construction of the device
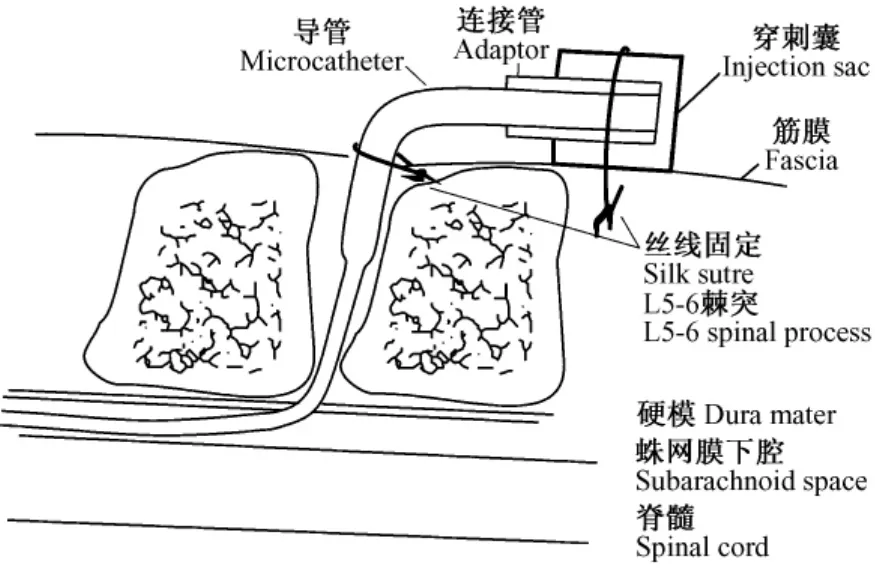
图2 导管及保护装置最终置入示意图Fig.2 Graphic illustration of the final procedure for implantation of the device.
1.4 神经功能评价
术前1 d及术后第1、3、7天检测两组大鼠运动及感觉神经功能情况。运动功能检测采用转棒实验,术前所有大鼠均接受3 d常规转棒训练,每天测试3次,每次间隔2 h。转棒仪起始设定为4 roll/min,待大鼠行走平稳后将转速在5 min内逐步增至40 roll/min,并保持转速不变,记录转棒开始加速至大鼠落下时间,最长时限设为300 s。热水甩尾实验检测感觉功能。将大鼠尾尖5 cm浸入55℃的恒温热水中,记录鼠尾甩出水面时间,最长时间为15 s,结果取三次测量的平均值,测量间隔时间3 min。
1.5 导管性能检测
导管置入腰蛛网膜下腔以后,在术后第1,3,7天分别进行利多卡因实验,检测导管性能。对照组需消毒导管体外保留端,剪除密封末端,10 μL 2%利多卡因经导管注射入蛛网膜下腔,随后再使用10 μL无菌生理盐水冲洗导管,加热密封导管末端。应用装置组则需在体外触摸注射囊位置,1 cc注射器经皮穿刺穿刺囊底,感到明显落空感后注射10 μL 2%利多卡因,随后10 μL无菌生理盐水冲洗导管。注射利多卡因后,如大鼠在30 s内出现双下肢麻痹,并持续20~30 min则证明导管性能正常。
1.6 统计学方法
所有计数资料采用均数±标准差表示(mean±SD),独立样本T检验和χ2检验用于数据分析,P<0.05认为统计学差异显著。
2 结果
本次试验两组大鼠术后均无死亡及明显瘫痪情况;术前1d及术后第1,3,7天大鼠转棒实验及热水甩尾实验均未见两组明显差异(P>0.05,独立样本T检验),见表1;对照组大鼠体外导管末端在术后几天内被损毁或拔出,无法进行进一步实验,应用装置组术后7 d所有末端均保持完整,术后利多卡因实验显示导管功能良好(P>0.05,χ2检验),见表2。
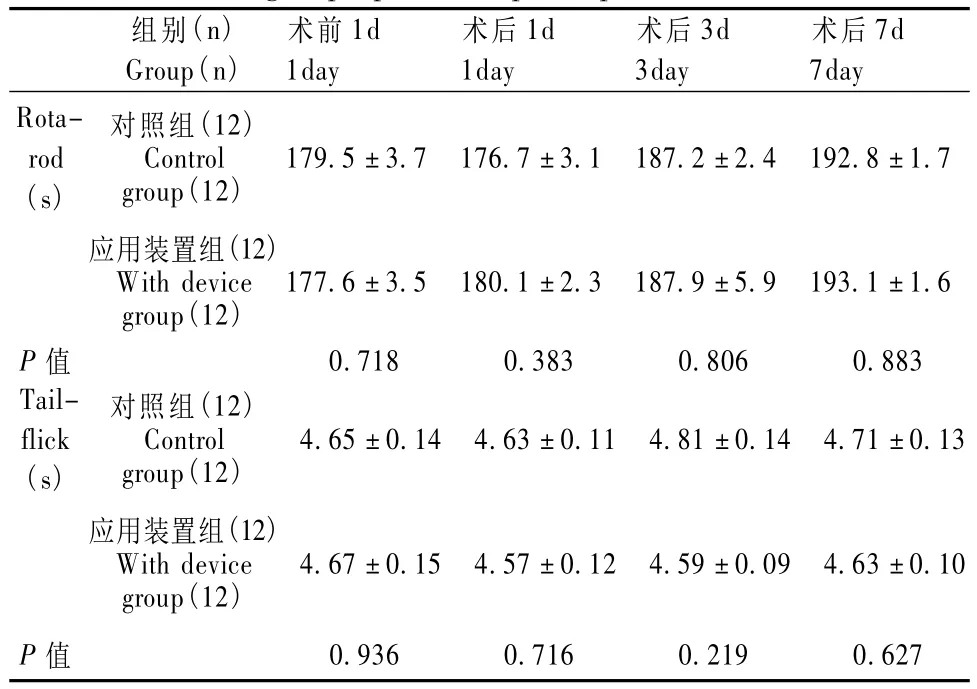
表1 两组大鼠转棒实验和热水甩尾实验在术前和术后不同时间点的检测结果Tab.1 The results of motor and sensory function of two groups pre-and post-operation
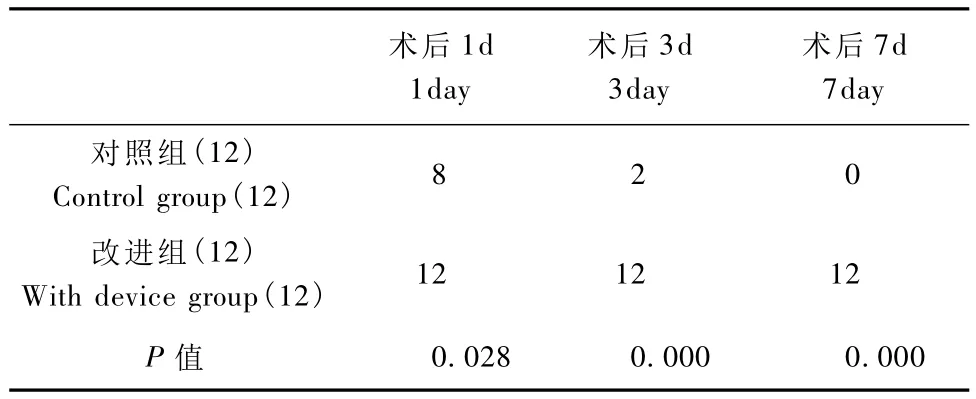
表2 两组造模后导管体外段保留情况Tab.2 The availability of external portion of the catheters postoperation in two groups
3 讨论
自1976年Yaksh和Rudy介绍大鼠长期腰蛛网膜下腔置管技术并广泛使用以来,不同的学者一直在努力完善和改进此模型,使其更加简单,可靠,方便实验操作以及减低因实验操作引起的死亡率和致残率[2,5,6]。而其中一个重要的需要改进方面就是置管后大鼠体外端的保留以及注药操作问题。目前大多学者选择将导管体外段直接从伤口引出或在皮下潜行至大鼠枕后双耳之间穿出皮肤固定,实践证明在造模后的几天内,大鼠就会将所有导管损毁或拔出而无法进行长期实验,有时不得不采取单笼饲养的方法来避免其它大鼠破坏导管[2,5,6]。一些学者发明了固定于大鼠体外的导管保护装置,藉此来保护导管的体外段,其基本原理就是将一个抗大鼠撕咬的管状装置(金属、塑料或其它材料)缝合固定于大鼠背部,并将导管末端置于保护装置之内[3,7]。体外保护装置提高了导管的保存率,但并没有完全解决此问题,体外装置仍可能脱落或损毁,并且保护装置缝于大鼠背部皮肤上,引起动物不适。本实验我们设计了完全将导管末端保护装置置于皮下的方式,完全解决了因动物原因损坏导管的问题,并且实验表明,置入物和动物之间有很好的相容性,大鼠转棒和热水甩尾实验也表明与对照组比较,装置的置入没有对模型的运动和感觉功能产生任何影响而干扰试验结果。
与体外保留导管,采用加热导管密封,每次注射都需要剪除末端,注射后再加热密封的这种方法相比,采用经皮穿刺穿刺囊注射的方式简化了操作的过程,减少液体反流至导管内的机会,以及感染的可能。可能盲穿穿刺囊底部会带来一点麻烦,但是几次练习之后就会熟练掌握这种穿刺技术。为了和穿刺囊进行紧密结合,我们采用了人腰蛛网膜下腔引流管来制作置入导管,通过在沸水中拉伸,可以得到理想的导管直径,而既往也有学者报道置入蛛网膜下腔的导管直径大小与造模后动物出现的神经功能损伤的发生率相关[2,5]。本组实验大鼠造模后未出现死亡和严重致残的情况。
总之,我们设计制作了一种大鼠长期腰蛛网膜下腔置管末端的穿刺囊结构,采用皮下保留,经皮穿刺注射的方式,解决了大鼠置管后导管末端的保留问题,简化注射操作过程,提高了传统模型的可靠性和实用性,为一些需要长期反复注射研究提供了更为理想的模型制作方法。
[1] Yaksh TL,Rudy TA. Chronic catheterization of the spinal subarachnoid space[J].Physiol Behav,1976,17:1013-1016.
[2] Storkson R,Kjorsvik A,Tjolsen A,et al.Lumbar catheterization of the spinal subarachnoid space in the rat[J].J Neurosci Methods,1996,65:167-172.
[3] Milligan ED,Hinde JL,Mehmert KK,et al.A method for increasing the viability of the external portion of lumbar catheters placed in the spinal subarachnoid space of rats[J].J Neurosci Methods,1999,90:81-86.
[4] Yaksh TL,Grafe MR,Melkmus S,et al.Studies on the safety of chronically administered intrathecal neostigmine methylsulfate in rats and dogs[J].Anesthesiology,1995,82:412-427.
[5] 邹望远,郭曲练,蔡进,等.Microspinal导管在大数蛛网膜下腔置管中的应用[J].中国比较医学杂志,2006,16:411-414.
[6] Poon YY,Chang AY,Ko SF,et al.An Improved Procedure for Catheterization of the Thoracic Spinal Subarachnoid Space in the Rat[J].Anesth Analg,2005,101:155-160.
[7] Xu F,Li T,Zhang B.An improved method for protecting and fixing the lumbar catheters placed in the spinal subarachnoid space of rats[J].J Neurosci Methods,2009,183:114-118.
A Device of Micro-catheter Protection for Chronic Lumbar Catheterization of the Spinal Subarachnoid Space in Rats
DU Shi-wei,BAO Xin-jie,FENG Ming,WEI Jun-ji,GUO Xu,WANG Ren-zhi
(Department of neurosurgery,Peking Union Medical college Hospital,Beijing 100730,China)
Objective To develop a novel device for chronic lumbar catheterization of the spinal subarachnoid space in rat with a perfect protection of the external portion of catheter,and more convenient for repeat injection.Methods Pathogen-free adult male Sprague-Dawley rats were used in this study.Rats were divided into two groups(n=12 each)randomly.Rota-rod test and Tail-flick test were introduced to assess motor and sensory function respectively at one day preoperative and 1st,3rd,7th day postoperative.To evaluate functionality of the catheter,10 μL 2%lidocaine was injected in the catheter at 1st,3rd and 7th day post-catheterization.Results There were no mortality and overt paralysis in 2 groups.There is no significant difference in motor and sensory function between the two groups(P>0.05,T test).Most external portions were destroyed a few days post operation in control group,however in group with device,all the catheters worked well(P < 0.05,χ2test)and lidocaine test showed that functionality of the micro-catheters were normal 7 days after catheterization.Conclusion The novel device was reliable and convenient for repeat injection with a perfect protection function of the external portion of catheter,meanwhile it provided a more ideal model for chronic study in anesthesia,analgesia,neuroscience and relevant research.
Protection device;Lumbar catheterization of the spinal subarachnoid space;Rat
R331 R332
A
1671-7856(2011)03-0052-04
2010-08-25
10.3969/j.issn.1671.7856.2011.03.013
国家高技术研究发展计划(2006AA02A115)。
王任直(1957-),主任医师,研究方向:颅脑肿瘤及脑血管病。E-mail:wangrz@126.com。
