急性肺损伤大鼠肺组织基质金属蛋白酶2及其抑制因子蛋白和mRNA的表达
2011-10-19苏中昊杨爱东李文雯汪东颖吴中华庞慧芳
阮 琼,苏中昊,杨爱东,李文雯,汪东颖,吴中华,庞慧芳
(1.上海市第八人民医院急诊内科,上海 200233;2.上海中医药大学基础医学院,上海 201203)
急性肺损伤大鼠肺组织基质金属蛋白酶2及其抑制因子蛋白和mRNA的表达
阮 琼1,苏中昊2,杨爱东2,李文雯2,汪东颖2,吴中华2,庞慧芳2
(1.上海市第八人民医院急诊内科,上海 200233;2.上海中医药大学基础医学院,上海 201203)
目的 探讨内毒素致急性肺损伤(ALI)大鼠肺组织核转录因子-κB(NF-κB)、基质金属蛋白酶2(MMP-2)及其抑制因子(TIMP-2)蛋白和mRNA表达的变化。方法 20只雄性Wistar大鼠随机分为2组:对照组、LPS模型组,每组再分为4 h和8 h两个亚组。尾静脉注射脂多糖(LPS)(10 mg/kg)建立大鼠急性肺损伤模型。检测血白细胞计数、支气管肺泡灌洗液(BALF)蛋白含量,采用免疫组化ABC法和实时荧光定量PCR分别测定肺组织NF-κB、MMP-2、TIMP-2蛋白及其mRNA的表达,并观察肺组织病理变化。结果 与对照组相比,模型组4 h和8 h时大鼠肺组织中的NF-κB、MMP-2蛋白染色阳性面积率及其 mRNA表达均显著增高(P<0.01)、TIMP-2蛋白染色阳性面积率及其mRNA表达均明显降低(P<0.05或P<0.01)。病理学观察显示,模型组大鼠肺组织出现出血及坏死。结论 内毒素致急性肺损伤的发病机制可能与NF-κB、MMP-2蛋白及其mRNA表达升高、TIMP-2蛋白及其mRNA表达降低有关。
脂多糖;急性肺损伤;NF-κB;MMP-2;TIMP-2
急性肺损伤(acute lung injury,ALI)是心源性以外的各种肺内外致病因素导致的急性、进行性缺氧性呼吸衰竭,以呼吸困难、难治性低氧血症和非心源性肺水肿为临床特征,严重的ALI或ALI的最终严重阶段被定义为急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)[1],研究表明,核转录因子-κB(nuclear factor-κB,NF-κB)、基质金属蛋白酶2(matrix metalloproteinase-2,MMP-2)及其抑制因子(tissue inhibitor of matrix metalloproteinases,TIMP-2)在内毒素致急性肺损伤的发病中有重要作用。本实验通过建立内毒素致ALI模型,观察大鼠肺组织 NF-κB、MMP-2、TIMP-2蛋白及其 mRMA表达的变化,为揭示急性肺损伤的发病机制提供实验依据。
1 材料和方法
1.1 实验动物
清洁级Wistar雄性大鼠20只,体重(220±20)g,由上海中医药大学实验动物中心提供[SCXK(沪)2007-005]。专用标准颗粒饲料、水喂养。
1.2 主要试剂
LPS:购自美国 Sigma 公司(LPS:O111:B4,批号 L-2630);NF-κBp65(NLS):sc-114 购自美国 Santa Cruz生物技术公司;大鼠MMP-2和TIMP-2免疫组化试剂盒购自武汉博士德生物工程有限公司;大鼠 NF-κB、MMP-2、TIMP-2和GAPDH引物和探针序列由广州达辉生物技术有限公司合成,序列分别为:NF-κB:上游引物:5′-CTACACCGAAGCAATTGAAGTGA-3,下 游 引物:5′-CAGCGAGTGGGCCTGAGA-3,探针序列:5′-AGGCAGCCTCCAGCCCAGTGA-3,5′端 FAM 修饰;3′端 Tamra 修饰;MMP-2:上游引物: 5′-CCC ATG AAG CCT TGT TTA CCA-3′,下 游 引 物:5′-TGG AAG CGG AAC GGA AAC T-3′,探 针 序 列:5′-TGGCAATGCTGATGGACAGCC-3′,5′端 FAM 修饰,3′端 Tamra 修饰;TIMP-2:上游引物:5′-CTC ATC GCG GGC CGT TTA AG-3,下游引物:5′-GAA GGC TTC GGG TCA TCG AG-3′,探 针 序 列:5′-CATGGAGAGCCTCTGTGGAT-3′,5′端 FAM 修饰,3′端 Tamra 修饰;GAPDH:上游引物:5′-CCG AGG GCC CAC TAA AGG-3,下 游引物:5′-GCT GTT GAA GTC ACA GGA GAC AA – 3,探针序列:5′-CATCCTGGGCTACACTGAGGACCA-3,5′端 FAM 修饰,3′端Tamra修饰。Trizol总 RNA提取试剂、反转录和PCR扩增所需的酶及其他试剂均购自美国Invitrogen公司。
1.3 动物模型与分组
按随机数字表将大鼠随机分为对照组、模型组,再随机分为4 h、8 h两个亚组(每组5只)。模型组经尾静脉注射LPS(10 mg/kg)复制急性肺损伤大鼠模型[2,3],正常组注入等容积生理盐水。
1.4 动物标本制备
所有动物均于设定的相应时相点(造模后4 h和8 h),用乌拉坦1.0 g/kg腹腔麻醉,分离大鼠腹主动脉,取一次性5 mL注射器从大鼠下腔静脉抽取静脉血约1 mL注入肝素钠抗凝管中,混匀后进行白细胞计数检测。取血后解剖大鼠颈部,暴露气管,抽取生理盐水灌洗支气管,取离心后的支气管肺泡灌洗液(bronchial alveolar lavage fluid,BALF),用考马斯亮兰法测定蛋白浓度;开胸分离右肺上叶用10%甲醛溶液固定,用于病理检测及肺组织NF-kB、MMP-2和TIMP-2蛋白免疫组化检测;右肺下叶置于液氮罐中作 NF-kBmRNA、MMP-2mRNA和 TIMP-2mRNA表达检测。
1.5 免疫组织法检测肺组织 NF-κBp65、MMP-2及TIMP-2蛋白含量
采用IMS细胞图像分析系统医学图像分析软件,对免疫组织化学结果进行图像采集和定量分析。每张切片在高倍镜下随机选择不相重叠的3个视野,细胞核为蓝色,NF-κBp65、MMP-2及 TIMP-2阳性细胞为棕黄色。计算出每例样本的蛋白染色阳性面积率(蛋白染色阳性面积率 =阳性细胞面积/总面积)作为比较参数。
1.6 实时荧光定量PCR检测肺组织NF-κBmRNA、MMP-2mRNA及TIMP-2mRNA的表达
按Trizol法提取总RNA后,逆转录合成 cDNA,在20 μL的反应体系中分别加入样本RNA2 μg全文统一,RT buffer(5 × )4 μL,10mmoldNTPs 1 μL,N9 随机引物 1 μL,逆转录酶 MMLV 1 μL,RNA 酶抑制剂1 μL,0.1 mol/LDTT2 μL,加 DEPC 处理水到 20 μL,混匀后于下列温度反应:37℃1 h;95℃5 min,灭活MMLV,产物即为cDNA。PCR扩增:在50 μL反应体系中加入 cDNA 5 μL,ddH2O 水 32 μL,PCR buffer(5 × )10 μL,荧光探针 0.5 μL,Taq DNA 聚合酶1 μL,dNTPs 0.5 μL,TNF-α 上下游引物各0.5 μL,扩增条件:(1)93℃ 2 min(2)93℃ 45 s 55℃ 1 min,10 cycle(3)93℃ 30 s,55℃ 45 s,30 cycle。
扩增产物分析:数据采用仪器自带软件ABI Prism 7300 SDS Software分析。NF-κBmRNA、MMP-2 mRNA及TIMP-2mRNA表达水平以它们与GAPDH的相对表达量来计算。
1.7 肺组织病理学观察
制备肺组织标本,常规苏木素-伊红(HE)染色,光镜下观察肺组织病理改变。
1.8 统计学处理
采用SPSS13.0软件包分析统计,所有数据均采用均数±标准差(±s)表示,多组均数采用单因素方差分析,组间两两比较用 LSD检验,以 P<0.05为差异有统计学意义。
2 结果
2.1 大鼠血白细胞计数及支气管肺泡灌洗液蛋白含量比较
与对照组相比,模型组4 h和8 h时白细胞计数明显降低(P<0.05或 P<0.01),肺泡灌洗液的蛋白含量明显升高(P<0.01)。(见表1)
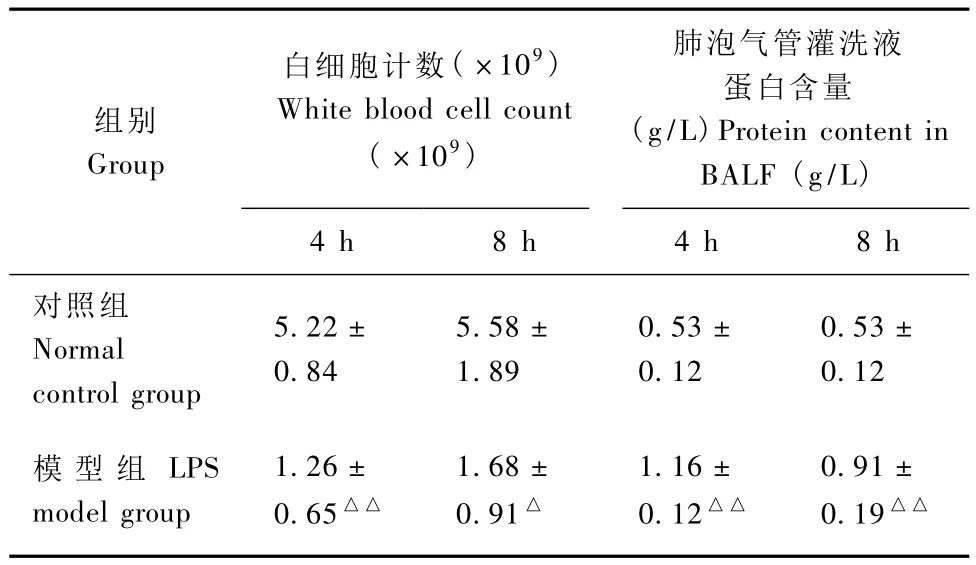
表1 两组大鼠血白细胞计数及支气管肺泡灌洗液蛋白含量比较 (n=5)Tab.1 Comparison of blood white blood cell count and protein content in BALF between the two groups(n=5)
2.2 大鼠肺组织NF-κB、MMP-2及 TIMP-2蛋白染色阳性面积率的比较
与对照组相比,模型组 4 h和 8 h时 NF-κB P65、MMP-2蛋白染色阳性面积率均明显升高(P <0.01);TIMP-2蛋白染色阳性面积率明显降低(P<0.01)(见表2)。

表2 两组大鼠肺组织NF-κB、MMP-2及TIMP-2蛋白染色阳性面积率的比较 (n=5)Tab.2 Comparison of expression of NF-κB ,MMP-2 and TIMP-2 protein dyeing positive rate of area in lung tissues between the two groups(n=5)
2.3 大鼠肺组织 NF-κB、MMP-2及 TIMP-2mRNA表达的比较
与对照组相比,模型组 4 h和 8 h时 NF-κB、MMP-2mRNA表达均显著增高(P<0.01),TIMP-2mRNA表达均明显降低(P<0.05)。(见表3)
2.4 大鼠肺组织病理学改变
光镜观察:对照组大鼠肺表面呈淡红色,结构完整,肺泡隔均匀一致,组织小叶结构清晰,纤维结缔组织无增生,肺泡腔清晰可见,肺泡壁无增厚,支气管粘膜上皮完整,肺泡腔细支气管腔未见明显炎细胞及渗出物。模型组4 h与8 h时大鼠肺泡腔内充满炎性渗出物和出血,肺泡壁毛细血管扩张充血,细支气管粘膜上损伤部分脱落,管壁上大量淋巴细胞浸润,管壁增厚,可见肺不张,肺气肿(彩插3见图1)。
3 讨论
MMP-2属于明胶酶的一种,亦称明胶酶 A,MMP-2以无活性酶原的形式由多种细胞分泌,如成纤维细胞、巨噬细胞、内皮细胞等,在激活剂的作用下转变为成熟的酶,其作用底物为 IV、V型胶原。MMP-2激活与表达后,能降解基底膜的主要成分IV胶原,使基底膜变薄甚至断裂,引起血管通透性增加、炎症细胞浸润,蛋白外渗,肺泡内液体增多、肺间质和肺泡水肿形成,甚至出现肺出血等。MMP-2是所有MMPs中分布最广的,当细胞恶变或损伤时,常有MMP-2的升高[4]。研究表明,正常肺组织中MMP-2呈弱表达,而脂多糖(LPS)和前炎症细胞因子(如 TNF-α)能促进 MMP-2 的表达[5]。本实验显示,正常对照组MMP-2 mRNA表达很低,静脉注射内毒素后,MMP-2在转录水平的表达增高,此实验结果与先前研究结果一致。
TIMPs是一组内源性特异性抑制MMPs活性的糖蛋白,其与 MMPs形成 1∶1复合体而抑制其活性[6]。TIMP-2是 MMP-2的特异性抑制蛋白,特异性抑制MMP-2的活性。在正常肺组织中,细胞外基质的合成和降解保持动态平衡,这对于保证正常肺功能非常重要[7]。MMPs和 TIMPs的平衡被破坏时,肺泡上皮基底膜被破坏之后可导致肺泡上皮细胞受损,富含蛋白和蛋白酶的水肿液充满肺泡,使表面活性物质灭亡。此外,基底膜完整性受到破坏后,各种损伤因子易于进入肺间质和肺泡腔,加重肺间质和实质损伤,进而引起肺功能障碍,导致肺泡萎陷和顽固性低氧血症[8]。
研究表明,转录因子 NF-κB在某些 MMP、TIMP基因启动子上有某些特异性结合位点,当细胞外信号激活这些转录因子后即可诱导MMP、TIMP表达。NF-κB可跨膜激活 P53,间接诱导 MMP-2的转录;激活的NF-κB又可反馈上调 IL-6,TNF-α等促炎因子进一步影响 MMPs 表达[9,10]。
本实验结果表明,模型组大鼠肺组织出现出血及坏死,提示造模成功。与对照组相比,模型组大鼠肺组织中的NF-κB、MMP-2蛋白及其 mRNA表达均显著增高(P<0.01)、TIMP-2蛋白及其 mRNA表达均明显降低(P<0.05或P<0.01)。提示内毒素致急性肺损伤的发病机制可能与 NF-κB、MMP-2蛋白及其 mRNA表达升高、TIMP-2蛋白及其 mRNA表达降低有关。

表3 两组大鼠肺组织NF-κB、MMP-2及TIMP-2 mRNA表达的比较 (n=4)Tab.3 Comparison of expression of NF-κB ,MMP-2 and TIMP-2 mRNA in lung tissues between the two groups(n=4)
[1 ] Bernard GR,Artigas A,Brigham KL,et al.The American-Europe An Consensus Conference on ARDS: Definitions,mechanisms,relevant outcomes,and clinical trial coordination[J].Crit Care Med,1994,149(1):818-824.
[2 ] Kao SJ,Wang D,Lin HI,et al.N-acetylcysteine abrogates acute lung injury induced by endotoxin[J].Clin Exp Pharmacol Physiol,2006,33(1 ~ 2):33-40.
[3] 林英,朱曦,和宇,等.颈脊髓切断对内毒素血症大鼠急性肺损伤的影响[J].中国危重病急救医学,2008,20(10):621-624.
[4] Ries C, Petrides PE. Cytokine regulation of matrix metalloproteinase activity and its regulatory dysfunction in disease[J].Biol Chem Hoppe Seyler,1995,376(6):345-355.
[5] Coimbra R,Melbostad H,Loomis W,et al.LPS-induced acute lung injury is attenuated by phosphodiesterase inhibition:effects on proinflammatory mediators,metalloproteinases,NF-kappaB,and ICAM-1 expression[J].J Trauma,2006,60(1):115-125.
[6 ] Davidson B,Goldberg I,Kopolovic J,et al.MMP-2 and TIMP-2 expression correlates with poor prognosis in cervical carcinoma-a c1inicopatho1ogic study using immunohistochemistry and mRNA in situ hybridization [J].GynecolOncol,1999,73(3):372-382.
[7 ] Ohbayashi H.Matrix metalloprotrinases in lung diseases[J].Curr Protein Pept Sci,2002,3(4):409-421.
[8 ] Ricou B,Nicod L,Lacraz S,et al.Matrix metalloproteinases and TIMP in acute respiratory distress syndrome[J].Am J Respir Crit Care Med,1996,154(2 Pt 1):346-352.
[9] Bond M,Fabunmi RP,Baker AH,et al.Synergistic upregulation ofmetalloproteinase-9 by growth factors and inflammatory cytokines:an absolute requirement for transcription factor NFKappaB[J].FEBS Lett,1998,435(1):29-34.
[10] Han YP,Tuan TL,Hughes M,et al.Transforming growth factorbeta-and tumor necrosis factor-alpha-mediated induction and proteolytic activation of MMP-9 in human skin[J].J Biol Chem,2001,276(25):22341-22350.
Expression of the MMP-2 and TIMP-2 Protein and Its mRNA in Rats with Acute Lung Injury Caused by Lipopolysaccharide
RUAN Qiong1,SU Zhong-hao2,YANG Ai-dong2,LI Wen-wen2,WANG Dong-ying2,WU Zhong-hua2,PANG Hui-fang2
(1.Department of Emergency Medicine,Shanghai Eingth People's Hospital,Shanghai 200233,China;2.The Basic Medicine College of Shanghai University of Traditional Chinese Medicine,Shanghai 201203,China)
Objective To investigate the changes of NF-κB,MMP-2 and TIMP-2 protein and its mRNA in the rats with acute lung injury(ALI)caused by lipopolysaccharide(LPS).Methods Twenty male Wistar rats were randomly divided into two groups: normal control group,LPS model group.Each group had two subgroups,4 hours and 8 hours after LPS were injected.The ALI model was established by intravenous injection of LPS(10 mg/kg)through a tailvein.Then the white blood cell(WBC)in blood and the protein content in bronchial alveolar lavage fluid(BALF)were measured,the expressions of nuclear factor-κB(NF-κB) ,matrixmetalloproteinase-2(MMP-2) and tissueinhibitorofmatrix metalloproteinases(TIMP-2)protein in pulmonary tissues were measured by immunohistochemistry ABC,the expression NF-κB ,MMP-2 and TIMP-2mRNA were measured by real-time fluorescent polymerase chain reaction(PCR) ,while the histopathology of the lung injury was observed by light microscope.Results Compared with normal group,the expression of NF-κB and MMP-2 protien dyeing positive rate of area and its mRNA in LPS model group were obviously increased at 4 hours and 8 hours(P<0.01) ,and the expression of TIMP-2 protein dyeing positive rate of area and its mRNA at 4 hours and 8 hours were obviously decreased in LPS model group(P<0.05or P<0.01).Light microscope observation indicatedthat there were pulmonary hemorrhage and necrosis in model group.Conclusion The increasing of expression NF-κB and MMP-2 protein and its mRNA and the decreasing of expression TIMP-2 protein and its mRNA may be the mechanism of ALI caused by LPS.
Lipopolysaccharide;Acute lung injury;NF-κB;MMP-2;TIMP-2
R563.9 R332
A
1671-7856(2011)03-0039-04
2010-08-26
10.3969/j.issn.1671.7856.2011.03.010
上海市教委高校高水平特色发展项目(No.(2005)81);上海高校选拔培养优秀青年教师科研专项基金(P13908)。
阮琼(1969-),女,主治医师,主要从事急诊医学临床与实验研究。
杨爱东,副教授,硕士生导师,主要从事中医药防治急性肺损伤的分子机制研究。aidongy@126.com。
