加热温度对猪肉肌原纤维蛋白凝胶特性的影响
2011-10-18孔保华夏秀芳李明清
孔保华,王 宇,夏秀芳,刘 骞,李明清
(东北农业大学食品学院,黑龙江 哈尔滨 150030)
加热温度对猪肉肌原纤维蛋白凝胶特性的影响
孔保华,王 宇,夏秀芳,刘 骞,李明清
(东北农业大学食品学院,黑龙江 哈尔滨 150030)
本实验研究在不同温度(50~90℃)条件下加热对猪肉肌原纤维蛋白凝胶特性的影响。结果显示:温度为70、80℃制备的凝胶保水性较好;50℃和60℃形成的凝胶颜色较深;70~90℃形成凝胶的白度基本相同,无显著差异(P>0.05);凝胶硬度和咀嚼性随温度的升高先升高后降低,在温度为70~80℃时达最大值;浊度随着温度的升高而总体呈升高趋势,但达到70℃以上时,升高趋势变缓。通过十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)研究发现,在45~65kD之间,在温度升高到70℃以上时,逐渐出现了明显的条带,表明部分蛋白发生了分解。表明肌原纤维蛋白在70~80℃所制得凝胶产品的功能特性较好。
肌原纤维蛋白;加热温度;功能性;凝胶特性
无论是肉类还是谷物类食物,大部分都需要经过加热才能食用,一般经过加热处理的食物更易于被人体消化和吸收。通过加热,一方面可以改善食品的色、香、味,使其易于消化吸收;另一方面可以抑制或杀灭食品中的微生物,提高食品货架期[1],此外加热对于肉制品的品质影响也非常大。一般来说,加热会引发一系列的物理化学反应,如质构变化、风味形成等,加热能使肌肉蛋白质(主要是肌原纤维)在合适的条件下形成凝胶。同时也能够杀死病原微生物保证食品安全[2]。肌肉蛋白质的凝胶性能决定着产品的质量、口感、乳化性及保水性等。肌肉凝胶的形成是蛋白变性和蛋白相互凝集形成三维网状结构的一个过程,肌球蛋白对凝胶的形成有很大的作用,并容易受到温度、pH值和离子浓度等的影响[3]。肌球蛋白是肌原纤维蛋白中最重要的一种蛋白质,通过电镜研究不同温度对肌原纤维蛋白影响后得出,在30℃加热30min,对肌球蛋白没有影响;在35℃加热30min,大部分肌球蛋白仍保持完整的结构,有自己单独的头部,仅有少数肌球蛋白通过头部结合形成二聚体;在40℃加热30min后,肌球蛋白分子大部分形成二聚体,单体很少存在;50℃加热30min后,肌球蛋白进一步凝集,肌球蛋白的尾部很难辨认;当在60℃加热30min时,肌球蛋白凝集成球状,尾部全部消失[4]。本实验主要研究在不同温度(50~90℃)条件下加热对肌原纤维蛋白功能性的影响,包括凝胶保水性、凝胶质构、颜色,并通过SDS聚丙烯酰胺凝胶电泳研究加热对蛋白质的影响,以期通过研究确定形成最好的凝胶功能特性的温度,以用于指导实际生产。
1 材料与方法
1.1 材料与试剂
宰后经过解僵成熟24h猪背最长肌 北大荒肉业;其余化学试剂均为分析纯。
1.2 仪器与设备
TA-XT plus型质构分析仪 英国Stable Micro System公司;TU-1800紫外-可见光分光光度计 北京普析通用仪器有限责任公司;冷冻离心机 上海分析仪器公司;DK-98-1型电热恒温水浴锅 天津泰斯特仪器有限公司;色差计 上海申光仪器厂;IKA-T18型匀浆机德国IKA公司;S-3400N扫描电镜 日本日立公司。
1.3 方法
1.3.1 肌原纤维蛋白提取
肌原纤维蛋白提取方法参考Liu等[5]的方法并略作修改,取猪背最长肌,剔除脂肪和结缔组织,切成1cm3小块,加入4倍体积缓冲液(10mmol/L Na3PO4、0.1mol/L NaCl、2mmol/L MgCl2和 1mmol/L EGTA,pH7.0),匀浆60s,2000×g冷冻离心15min,取沉淀重复上面步骤两次,得到粗提的肌原纤维蛋白。然后取此沉淀加入4倍体积的0.1mol/L NaCl溶液,匀浆60s,2000×g冷冻离心15min,重复此操作一遍,取沉淀加4倍体积的0.1mol/L NaCl溶液,匀浆60s,4层纱布过滤,取上清液,用0.1mol/L HCl调节pH值至6.0,2000×g冷冻离心15min,沉淀即为提纯的肌原纤维蛋白,4℃冷藏备用。以上操作均在4℃进行。用双缩脲法以标准牛血清白蛋白为标准蛋白测定肌原纤维蛋白含量。
1.3.2 制备凝胶
用蒸馏水调节肌原纤维蛋白(pH7.0)质量浓度为40mg/mL,室温下保持2h取15mL加入到3cm×5cm玻璃称量瓶中,盖上盖子,从25℃开始水浴加热,当中心温度达到目标温度(50、60、70、80、90℃)后,继续保持加热20min,随后取出放入冰浴中30min,4℃保存过夜。
1.3.3 凝胶保水性测定
凝胶保水性(water holding capacity,WHC)参考Kocher等[6]的方法并略作修改。将制备的肌原纤维蛋白凝胶取出,测量前在室温(22±2)℃放置30min。取5g不同的凝胶样品加入离心管(直径30mm)中,3000×g 离心15min,去除离心出的水分,称量凝胶质量。按式(1)计算凝胶保水性。式中:ma为离心后凝胶质量;mp为离心管质量;mb为离心前凝胶质量。

1.3.4 凝胶质构的测定
用TA-XT plus 型质构分析仪进行质构分析。测定前将肌原纤维蛋白凝胶在室温(22±2)℃放置30min,然后将待测样品连同称量瓶置于平台上固定好,参数如下:探头型号选择P/0.5,测试前速度2mm/s,测试速度1mm/s,测试后速度2mm/s,下压距离为凝胶高度的50%,触发力为5g[7]。
1.3.5 凝胶白度测定
凝胶的白度值用色差计测定,计算公式参考Zhu等[8]方法计算,其中L*、a*和b*值分别为亮度指数、色调和彩度指数,L*=0为黑色,L*=100为白色,+a*值越大,颜色越接近红色,-a*值越小越接近绿色;+b*值越大,颜色越接近黄色,-b*值越小越接近蓝色[10]。凝胶白度按式(2)计算。

1.3.6 肌原纤维蛋白浊度的测定
肌原纤维蛋白的浊度按Benjakul等[9]的方法进行测定。配制蛋白质量浓度为1mg/mL的肌原纤维蛋白溶液,然后吸取5mL放入试管中,将试管分别放在不同温度的水浴锅中加热30min,取出,冷却,以不加蛋白的溶液为空白,在波长600nm处测定吸光度。
1.3.7 猪肉肌原纤维蛋白聚丙烯酰胺凝胶电泳
参考LaemmLi等[10]的方法进行测定。分离胶15%,浓缩胶5%。
1.3.8 凝胶微观结构的测定
通过扫描电镜观测肌原纤维蛋白凝胶的微观结构。参考Pan等[11]方法进行样品制备。然后用E-1010型离子溅射镀膜仪进行离子溅射喷金,将处理好的样品放入样品盒中进行检测。
1.3.9 统计分析
全部实验重复3次,每次进行3个平行,每次重新提取肌原纤维蛋白,采用Statistix 8.0 (Analytical Software Inc., USA)线性模型处理数据并进行方差分析(ANOVA)。用Duncan氏比较法进行差异性检验,ANOVA显著(P<0.05)。
2 结果与分析
2.1 不同加热温度对肌原纤维蛋白凝胶保水性的影响
通过双缩脲法测得所提取的肌原纤维蛋白蛋白质含量为6.25%。不同温度加热后制备的凝胶的保水性如图1所示。保水性的高低可直接影响到肉的风味、颜色、质地、嫩度、凝结性等[12],是肌肉食用品质评定的重要指标之一。

图1 不同加热温度对肌原纤维蛋白凝胶保水性的影响Fig.1 Effect of heating temperature on WHC of myofibrillar protein gels
由图1可以看出,凝胶的保水性在70、80℃时达到最大值,其原因可能是因为肌原纤维蛋白在70~80℃之间变性达到最大,蛋白和蛋白的互作形成良好三维网状结构,水分被锁住,提高了保水性。凝胶的实质是蛋白质-蛋白质交联,将水、脂肪、糖等物质包裹在内,形成三维网络结构,是蛋白质溶液与蛋白质沉淀的中间状态。蛋白质浓度、加热温度、时间、pH值以及离子强度和种类等对凝胶的持水性都有影响。结果显示最大的保水性值出现在70℃和80℃,可能是因为,在70℃到80℃之间,肌原纤维蛋白变性形成网状结构,在90℃变性的蛋白经受蛋白-蛋白相互作用趋势的增加使凝胶的强度增加,但过度加热引起蛋白质的变性收缩,使保水性降低,这可能是因为聚集现象使蛋白网络结构部分的破坏。Benjakul等[9]研究指出,当温度小于55℃时蛋白质重链及头部不能形成凝胶的结构。当温度大于60℃时头部促成了凝胶网络结构的形成。
2.2 不同加热温度对肌原纤维蛋白凝胶白度的影响
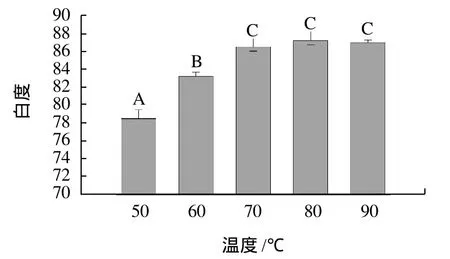
图2 不同温度对肌原纤维蛋白凝胶白度的影响Fig.2 Effect of heating temperature on whiteness of myofibrillar protein gels
由图2可以发现,从50℃到70℃凝胶的白度呈升高趋势,且差异显著(P<0.05),从70℃到90℃凝胶白度变化不显著(P>0.05)。肉的颜色是影响消费者购买力的最重要因素[13]。在肌原纤维蛋白加热到70℃变性的温度后,凝胶的颜色有较大的改变,并且在随后继续加热的情况下,颜色并无太大的改变,说明了白度和蛋白的变性有很大关系。Hwang等[14]用鱼糜研究温度和蛋白变性的关系,结果表明鱼糜凝胶的白度变化与蛋白变性程度关联。Akamittath等[15]研究认为蛋白变性和脂肪氧化会引起样品表面亮度L*值和黄色b*值的增大、红色a*值的降低,同时组织间自由水分增多,这些变化是由于蛋白质的变性或脂肪氧化增加了自由水的含量。
2.3 不同温度对肌原纤维蛋白浊度的影响

图3 不同温度对肌原纤维蛋白浊度的影响Fig.3 Effect of heating temperature on turbidity of myofibrillar protein gels
由图3可见,随着温度的升高,浊度总体呈升高趋势,从50℃加热到60℃的过程中,浊度无显著变化(P>0.05)。从60℃到70℃的加热过程中,浊度显著升高(P<0.05),但是随着温度的进一步升高,浊度变化不明显(P>0.05)。这说明,肌原纤维蛋白在60℃到70℃的范围内发生变性,蛋白分子交联作用加大,导致浊度升高。
2.4 不同温度对肌原纤维蛋白凝胶质构的影响

图4 不同温度对肌原纤维蛋白凝胶质构的影响Fig.4 Effect of heating temperature on TPA of myofibrillar protein gels
由图4可见,硬度和咀嚼性随温度的升高先升高后降低,在50℃到70℃范围内升高比较缓慢,到80℃达到最大值,但是随着温度的进一步升高,硬度和咀嚼性有所下降。胶黏性和黏聚性随着温度的升高,一直呈现降低的趋势。说明温度升高,蛋白变性加剧,刚性变大而胶黏性减弱。说明加热到80℃左右是肉品加工的一个比较好的温度范围。Yasul等[16]通过研究兔肉肌原纤维蛋白在不同温度下凝胶质构的变化情况指出,兔肉肌球蛋白在60℃时凝胶硬度达到最大值,在60~70℃保持恒定,形成凝胶的最适温度大约为60~70℃。
2.5 肌原纤维蛋白SDS-PAGE凝胶电泳

图5 不同加热温度制得肌原纤维蛋白的SDS-聚丙烯酰胺凝胶电泳Fig.5 SDS-PAGE pattern of myofibrillar proteins at different heating temperatures
由图5可以看出,不同温度对肌原纤维蛋白的分子变化基本无影响,只是随着温度的升高,在45~65kD之间,50℃和60℃温度范围内,此分子质量区间基本没有蛋白条带存在;等温度升高到70、80℃和90℃时,逐渐出现了明显的条带。可能是随着温度的升高,蛋白有一定的分解。Hernandez-Herrero等[17]报道鳕鱼在冻藏过程中大分子的蛋白(肌球蛋白的重链)电泳条带没有发生明显的变化,而一些连接蛋白发生了明显的降解。有文献报道[18]研究了添加谷氨酰胺转胺酶后,在不同温度下加热对肌原纤维蛋白的影响,结果发现,低于50℃的时候,添加蛋白酶也不会使蛋白发生分解,只有温度高于50℃时,分子质量约200kD的肌球蛋白重链,以及95kD的α-肌动蛋白会发生降解,甚至一些20~40kD的小分子蛋白条带也被酶解而消失。
2.6 不同温度对肌原纤维蛋白微观结构的影响
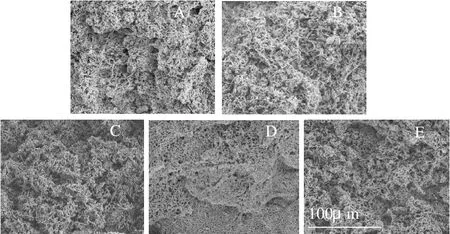
图6 不同温度对肌原纤维蛋白凝胶微观结构的影响(×500)Fig.6 Effects of heating temperature on microstructure of myofibrillar protein gel (×500)
由图6可以看出,在不同的温度条件下加热,肌原纤维蛋白凝胶的结构有很大不同,50℃加热的样品比较松软,图片显示其结构松散,纤维之间交联不紧密。随着温度的逐渐升高,凝胶的结构也越来越紧密,到90℃的时候,图片显示蛋白经过充分的变性,形成结构良好的空间结构,紧致而且细腻。
3 结 论
由实验结果可知,温度对猪肉肌原纤维蛋白凝胶的功能特性有较大影响。温度为70、80℃时,凝胶的保水性达到最大值;50~70℃凝胶的白度随着温度的升高,呈现一直升高的趋势;凝胶的硬度和咀嚼性随温度的升高先升高后降低,胶黏性和黏聚性随着温度的升高而一直降低。从扫描电镜图片来看,在不同加热温度条件下制备凝胶的结构有很大不同,随着温度的升高,凝胶结构变得越来越致密,但是质地在高温条件下比较粗糙,保水性也不好。综合比较,70~80℃是最适合猪肉制品加工的温度范围。
[1] 向聪. 肉类保藏技术(二) 肉制品的加热处理[J]. 肉类研究, 2008, 22(10): 77-80.
[2] 孔保华. 畜产品加工储藏新技术[M]. 北京: 科学出版社, 2007: 73-78.
[3] LANIER T C, CARVAJAL P, YONGSAWATDIGUL J. Surimi and surimi seafood[M]. New York: Marcel Dekker, 2004: 78-96.
[4] SHARP A, OFFER G. The mechanism of formation of gels from myosin molecules[J]. Journal of the Science of Food and Agriculture, 1992, 58:63-73.
[5] LIU Gang, XIONG Youling. Contribution of lipid and protein oxidation to rheological differences between chicken white and red muscle myofibrillar proteins[J]. Journal of Agricultural and Food Chemistry, 1996,44(3): 779-784.
[6] KOCHER P N, FOEGEDING E A. Microcentrifuge-based method for measuring water-holding of protein gels[J]. Journal of Food Science,1993, 58(5): 1040-1046.
[7] CHIN K B, GO M Y, XIONG Youling. Konjac flour improved textural and water retention properties of transglutaminase-mediated, heat-induced porcine myofibrillar protein gel: Effect of salt level and transglutaminase incubation[J]. Meat Science, 2009, 81(3): 565-572.
[8] ZHU Kerui, KANU P J, CLAVER I P, et al. A method for evaluating hunter whiteness of mixed powders[J]. Advanced Powder Technology,2009, 20(2): 123-126.
[9] BENJAKUL S, VISESSANGUAN W, ISHIZAKI S, et al. Differences in gelation characteristics of natural actomyosin from two species of bigeye snapper[J]. Journal of Food Science, 2001, 66(9): 1311-1318.
[10] LAEMMLI U K. Cleavage of structural proteins during the assembly of the head of bacteriophage t4[J]. Nature, 1970, 227(5259): 680-685.
[11] PAN B S, YEH W T. Biochemical and morphological changes in grass shrimp muscle following freezing by air blast and liquid nitrogen methods[J]. Journal of Food Biochemistry, 1993, 17(3): 147-160.
[12] HUFF-LONERGAN E, LONERGAN S M. Mechanisms of water-holding capacity of meat: Mechanisms of water-holding capacity of meat: Therole of postmortem biochemical and structural changes[J]. Meat Science,2005, 71(1): 194-204.
[13] FAUSTMAN C, CASSENS R G. The biological basis for discoloration in fresh meat: a review[J]. Journal of Muscle Foods, 1990, 1(3): 217-243.
[14] HWANG J S, LAI K M, HSU K C. Changes in textural and rheological properties of gels from tilapia muscle proteins induced by high pressure and setting[J]. Food Chemistry, 2007, 104(2): 746-753.
[15] AKAMITTATH J G, BREKKE C J, SCHANUS E G. Lipid oxidation and color stability in restructured meat systems during frozen storage[J].Journal of Food Science, 2006, 55(6): 1513-1517.
[16] YASUI T, ISHIOROSHI M, NAKANO H, et al. Changes in shear modulus, ultrastructure and spin-spin relaxation times of water associated with heat-induced gelation of myosin[J]. Journal of Food Science,1979, 44(4): 1201-1204.
Influence of Heating Temperature on Gel Properties of Porcine Myofibrillar Protein
KONG Bao-hua,WANG Yu,XIA Xiu-fang,LIU Qian,LI Ming-qing
(College of Food Science, Northeast Agricultural University, Harbin 150030, China)
Gel properties of porcine myofibrillar protein (MP) after heat treatment at varying temperatures (50, 60, 70, 80 ℃and 90 ℃) were investigated. The results showed that gels prepared at 70 or 80 ℃ had a better water holding capacity (WHC)compared with those at other temperatures; gels prepared at 50 or 60 ℃ had a darker color, while those at higher temperatures had similar color (P>0.05). The hardness and chewiness rose at the beginning of heating and then decreased with increasing temperature; the best functional properties were obtained at a temperature ranging from 70 to 80 ℃. Turbidity first went up with increasing temperature and then changed little when the temperature was above 70 ℃. SDS-PAGE studies indicated that visible 45 - 65 kD bands appeared when the temperature reached 70 ℃ or higher, suggesting the occurrence of partial protein degradation. Thus, MP gels formed at a temperature between 70 ℃and 80 ℃ have better functional properties.
myofibrillar protein;heating;functional properties;gelation
TS251.5
A
1002-6630(2011)05-0050-05
2010-07-08
黑龙江省杰出青年基金项目(JC200702);国家公益性行业(农业)科研专项经费项目(200903012-02)
孔保华(1963—),女,教授,博士,研究方向为畜产品加工。E-mail:kongbh63@hotmail.com
