肉中4种致病菌的P C R快速检测方法的建立
2011-10-13刘红玉崔洪斌
刘红玉,李 岩,崔洪斌
(1.东北农业大学食品学院,黑龙江 哈尔滨 150030;2.哈尔滨医科大学公共卫生学院,黑龙江 哈尔滨 150086)
肉中4种致病菌的P C R快速检测方法的建立
刘红玉1,李 岩1,崔洪斌2
(1.东北农业大学食品学院,黑龙江 哈尔滨 150030;2.哈尔滨医科大学公共卫生学院,黑龙江 哈尔滨 150086)
目的:建立一种能同时检测肉中金黄色葡萄球菌、志贺氏菌、沙门氏菌和单核增生李斯特菌的多重PCR检测方法。方法:根据金黄色葡萄球菌的耐热核酸酶基因(nuc)、沙门氏菌的侵袭蛋白基因(invA)、志贺氏菌的侵袭性质粒抗原基因(ipaH)和单核细胞增生性李斯特菌的内化素基因(inlA)设计引物,通过优化好的反应体系进行多重聚合酶链反应(PCR)扩增目的基因。结果:特异性实验结果表明4种菌均能在相应位置扩增出特异性条带。对污染4种菌的猪肉进行检测,确定出金黄色葡萄球菌和沙门氏菌的检出限是102CFU/mL,志贺氏菌和单核增生李斯特菌的检出限是101CFU/mL。结论:本实验建立的多重PCR方法比传统细菌检测方法更特异、快速、灵敏,适用于肉中金黄色葡萄球菌、志贺氏菌、沙门菌和单核增生李斯特菌的快速检测。
多重聚合酶链反应(PCR);致病菌;肉;检测
食源性致病菌是引起食源性疾病的重要原因,食源性疾病可以侵犯任何人群,儿童、孕妇、年老体弱者和免疫力低下的人群更容易感染食源性疾病,成为最主要的受害人群[1],因此加强食品中致病微生物的检测技术研究具有重要的现实意义。传统检测方法检测时间长、程序繁琐,已无法满足快速检测的要求。近几年常用的食源性致病菌的PCR检测方法已被建立起来,如金黄色葡萄球菌[2]、志贺氏菌[3]、沙门氏菌[4]单核细胞增生李斯特氏菌[5]和大肠杆菌等,但是单一致病菌的PCR检测技术和一般方法显然都不能满足对大批食品进行致病菌快速检测的需要,针对这种情况,建立了同时检测多种致病菌的多重PCR技术,并且这种技术已经有了很大发展[6]。本研究以金黄色葡萄球菌的耐热核酸酶基因(nuc)、沙门氏菌的侵袭蛋白基因(invA)、志贺氏菌的侵袭性质粒抗原基因(ipaH)和单核细胞增生性李斯特菌的内化素基因(inlA)作为研究对象,建立一种灵敏性高、特异性好且稳定的多重PCR体系,对快速、准确的一次性检测肉中4种致病菌感染状况进行探讨。
1 材料与方法
1.1 材料、试剂与仪器
金黄色葡萄球菌、志贺氏菌、沙门氏菌、单核增生李斯特菌标准株由黑龙江大学生命科学学院提供;新鲜猪肉 市购。
细菌基因组DNA试剂盒、dNTPs、DNA Marker DL2000 北京百泰克生物技术有限公司;EZgeneTMTissue gDNA Kit(BIOMIGA);10 × buffer(Mg2+Plus)、6×buffer、Taq酶 大连宝生物工程有限公司;琼脂糖 西班牙Biowest公司;50×TAE;Tris-HCl;EB;无水乙醇;TGRADIENT型PCR仪 德国Biometra公司;DYY-III型电泳仪 北京六一仪器厂;BTS-20.M凝胶成像系统 英国Uvitec公司。
扩增的目的基因及引物设计:选择金黄色葡萄球菌的耐热核酸酶基因[7-8](nuc)、沙门氏菌的侵袭蛋白基因[9-10](invA)、志贺氏菌的侵袭性质粒抗原基因[11-12](ipaH)和单核细胞增生性李斯特菌的内化素基因[13-14](inlA)作为目的基因,用Primer 5分析软件设计4对特异性引物,由金思特(南京)有限公司合成(表1)。

表1 扩增的目的基因及引物设计Table 1 Target genes and corresponding primer sequences
1.2 方法
1.2.1 细菌的培养
在5mL新鲜无菌的营养肉汤培养基中,37℃振荡过夜。
1.2.2 细菌基因组DNA的制备
根据细菌基因组DNA试剂盒说明书进行。
1.2.3 多重PCR扩增
对引物添加量、dNTPs添加量、退火温度、PCR循环数进行优化,确定最适反应体系。最终确定反应体系为50μL:10×buffer(Mg2+Plus)5μL,dNTPs(2.5mmol/L)5μL,上、下游引物(10mmol/L)各2μL,模板4μL,Taq酶1μL,其余用双蒸水补足至50μL。PCR扩增程序:采用热启动。95℃预变性5min;94℃变性30s;56℃退火45s;72℃延伸 1min;进行35个循环,最后72℃延伸5min。
1.2.4 特异性检测
1.2.4.1 引物特异性检测
从金黄色葡萄球菌、志贺氏菌、沙门氏菌、单核增生李斯特菌、大肠杆菌和枯草芽孢杆菌中提取DNA进行PCR扩增检测引物特异性。
1.2.4.2 反应特异性检测
将金黄色葡萄球菌、志贺氏菌、沙门氏菌和单核增生李斯特菌随机进行组合,提取DNA进行多重PCR扩增检测多重PCR反应特异性。
1.2.5 灵敏度检测
将过夜培养的金黄色葡萄球菌、志贺氏菌、沙门氏菌和单核增生李斯特菌的单一菌液和4种菌的混合菌液分别用无菌的生理盐水10倍稀释,使4种菌的浓度均依次为107~100CFU/mL。根据细菌基因组DNA试剂盒说明书进行,提取的DNA作为多重PCR反应的模板。检测单一致病菌的灵敏度和同时检测4种致病菌的灵敏度。
1.2.6 多重PCR反应产物检测
取5μL PCR反应产物在3%琼脂糖凝胶上进行电泳,利用凝胶成像系统观察结果并成像。
1.2.7 多重PCR检测人工污染的肉样
挑选25g放入无菌样品袋内,加入225mL生理盐水,均质后,取出部分清液加入到灭菌营养肉汤液体培养基里,37℃培养过夜。将过夜培养的金黄色葡萄球菌、志贺氏菌、沙门氏菌和单核增生李斯特菌混合培养液,10倍稀释,使浓度依次为107~100CFU/mL,分别接种于2.5g肉糜上,根据EZgeneTMTissue gDNA Ki说明书进行,提取DNA作为多重PCR模板。利用已经建立的多重PCR反应程序进行检测,取5μL PCR产物在3% 琼脂糖凝胶上进行电泳,利用凝胶成像系统观察结果并成像,确定4种致病菌在猪肉中的检测限。
2 结果与分析
2.1 特异性检测
2.1.1 多重PCR引物特异性检测
目标菌株仅对其对应引物有特异性反应,在相应位置出现了特征条带,而对其他菌的引物没有扩增现象(图 1)。
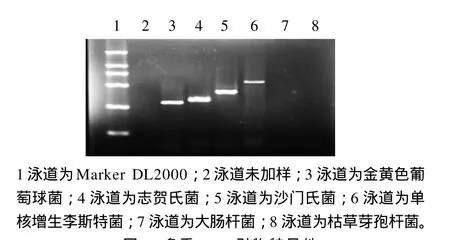
图1 多重PCR引物特异性Fig.1 Specificity of multiplex PCR primers
图1显示,金黄色葡萄球菌、志贺氏菌、沙门氏菌和单核增生李斯特菌均为阳性结果,均能在相应位置扩增出特异性条带;其他的菌为阴性结果,没有扩增出特异性条带;因此该引物特异性较强。
2.1.2 多重PCR反应特异性检测
将4种致病菌随机组合,进行多重PCR反应特异性检测(图 2)。
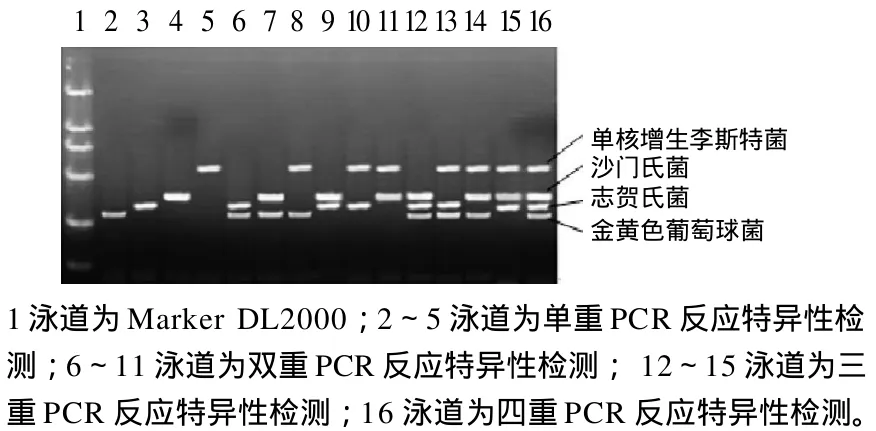
图2 多重PCR反应特异性Fig.2 Specificity of multiplex PCR reaction
由图2可知,多重PCR反应均能特异性的扩增出目的片段。由此可知,该多重PCR方法特异性强,可同时检测4种食源性致病菌的一种或几种。
2.2 多重PCR反应的灵敏度检测
2.2.1 多重PCR检测单一致病菌的灵敏度
将初始浓度均为107CFU/mL的4种菌分别10倍梯度稀释,提取的DNA作为PCR反应模板,确定多重PCR检测单一致病菌的灵敏度。由图3可知,多重PCR检测4种单一致病菌的灵敏度均为101CFU/mL。

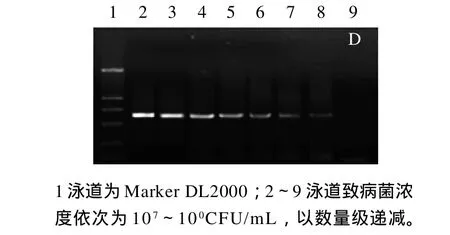
图3 多重PCR分别检测金黄色葡萄球菌(A)、沙门氏菌(B)、志贺氏菌(C)、单核增生李斯特菌(D)的灵敏度Fig.3 Sensitivity of multiplex PCR detection forStaphylococcus aureus(A),Salmonellaspp. (B),Shigellaspp. (C) andListeria monocytogenes(D)
2.2.2 多重PCR同时检测4种致病菌灵敏度
初始浓度为107CFU/mL的4种混合菌液梯度稀释,提取的DNA作为多重PCR反应模板,确定多重PCR同时检测4种致病菌的灵敏度(图4)。

图4 多重PCR同时检测4种致病菌的灵敏度Fig.4 Sensitivity of multiplex PCR detection for four pathogens in meat
由图4可知,多重PCR同时检测4种致病菌的灵敏度为金黄色葡萄球菌为102CFU/mL、志贺氏菌为101CFU/mL、沙门氏菌为102CFU/mL、单核增生李斯特菌为101CFU/mL。
2.3 人工污染肉确定检出限
从肉中提取的DNA按照优化好的条件多重PCR扩增,扩增结果见图5。

图5 猪肉中4种致病菌多重PCR检测Fig.5 Multiplex PCR detection of four bacterial pathogens in meat
由图5可知,猪肉中多重PCR同时检测4种致病菌的灵敏度为金黄色葡萄球菌为102CFU/mL、志贺氏菌为101CFU/mL、沙门氏菌为102CFU/mL、单核增生李斯特菌为101CFU/mL。
3 讨 论
研究发现,多重PCR的优化主要是优化引物的合适配比、dNTP量、MgCl2浓度、退火温度和循环次数。在本实验中10×buffer中带Mg2+(15mmol/L),加入5μL的10×buffer后,体系中的Mg2+相当于最适添加量,所以没有优化。只对引物添加量、dNTP量、退火温度和循环次数进行了优化,从中确定最适添加量。本研究的多重PCR技术具有很高的特异性,在很大程度上简化了操作步骤,节省了试剂,并缩短了时间、降低了费用,具有重要的研究意义和应用价值[15]。本实验检测的单一致病菌的灵敏度均达到101CFU/mL,而同时检测4种致病菌的灵敏度时金黄色葡萄球菌和沙门氏菌的灵敏度是102CFU/mL,志贺氏菌和单核增生李斯特菌的灵敏度是101CFU/mL。说明多种因素对多重PCR的灵敏度有影响,包括引物的相互影响、引物退火温度等。对于细菌量较少的检测标本,要经过增菌,避免多重PCR出现假阴性结果。
[1] 刘秀梅. 全球微生物食品安全现状与挑战[EB/OL]. [2004-11-16]. http://www.nutrisources.com/Article-print. asp?ArticleID=903.
[2] 田静, 计融, 杨军, 等. PCR方法快速检测食品中的金黄色葡萄球菌[J]. 卫生研究, 2007, 36(2): 183-186.
[3] 赵丽华, 周勇, 万成松. 分子信标PCR检测志贺菌ipaH基因[J]. 热带医学杂志, 2006, 6(5): 499-502.
[4] 汪琦, 张昕, 张惠媛, 等. 利用PCR方法快速检测食品中的沙门氏菌[J]. 检验检疫科学, 2005, 15(6): 26-28.
[5] BECKER B, JORDAN S, HOLZAPFEL W H. Rapid and specific detection ofListeria monocytogenesin smoked salmon with BAX-PCR[J]. Food Control, 2005, 16(8): 717-721.
[6] AVIJIT R, AMER F, BARTHE G, et al. A multiplex polymerase chain reaction method for reliable, sensitive and simultaneous detection of multiple viruses in citus trees[J]. Journmal of Virological Methods,2005, 129(l): 47-55.
[7] TAMARAP S, MCKILLIP J L, DRAKE M. Development of a multiplex polymerase chain reaction assay for detection and differentiation ofStaphylococcus aureusin dairy products[J]. Food Prot, 2001, 64(5):664-668.
[8] 田静, 计融, 杨军, 等. PCR方法快速检测食品中的金黄色葡萄球菌[J]. 卫生研究, 2007, 36(2): 183-186.
[9] COHEN N D, NEIBERGS H L, MEGTUDER E D, et al. Genus specific detection ofSalmonellaeusing the polymerase chain reaction (PCR)[J].Vet Diagn Invest, 1993, 5(3): 368-371.
[10] 刘华伟, 郭蔼光. PCR技术在沙门氏菌快速检测中的应用[J]. 动物医学进展, 2004, 25(6): 55-58.
[11] HARTMAN A B, VENKATESAN M, OAKE E V. Sequence and molicular characterization of a multicopy invasive plasmid antigen geneipaHofShigella flexneri[J]. Bacteriol, 1990, 172(4): 1905-1915.
[12] THONG K L, HOE S L L, PUTHUCHEARY S D, et al. Detection of virulence gene malaysianShigellaspecies by multiplex PCR assay[J].BMC Infectious Diseases, 2005, 5(1): 8-11.
[13] ALMEIDA P F, ALMEIDA R C C. A PCR protocol using inl gene as a target for specific detection ofListeria monocytogenes[J]. Food Control,2000, 11(2): 97-101.
[14] 邵俊花, 葛长荣. 单核细胞增生性李斯特氏菌污染及其检测方法研究进展[J]. 食品科技, 2007(l): 11-14.
[15] MEKONNEN K, DIIVIND E, RUTH-ANNE S, et al. A multiplex polymerase chain reaction assay for genus group and species-specific detection of mycobacteria[J]. Diag Microbiol Infect Dis, 2004, 49(2): 99-1041.
Establishment of A Rapid Detection Method for Bacterial Pathogens in Meat by Polymerase Chain Reaction
LIU Hong-yu1,LI Yan1,CUI Hong-bin2
(1. College of Food, Northeast Agricultural University, Harbin 150030, China;2. College of Public Health, Harbin Medical University, Harbin 150086, China)
Objective: To establish a multiplex PCR for simultaneously detectingStaphylococcus aureus,Shigellaspp.,Salmonellaspp. andListeria monocytogenesin meat. Methods: The primers were designed according toStaphylococcus aureus nucgene,Shigellaspp.ipaHgene,Salmonellaspp.invAgene andListeria monocytogenesinlAgene. The target genes were amplified by multiplex PCR under optimized reaction conditions. Results: Four bacterial pathogens could be amplified, which revealed the special bands at the corresponding locations. When the meat samples were contaminated with four pathogens, the detection limits ofStaphylococcus aureusandSalmonellaspp. were 102CFU/mL, and the detection limits ofShigellaspp. andListeria monocytogeneswere 101CFU/mL. Conclusion: The established multiplex PCR method is more specific, rapid, and sensitive than traditional detection methods, which is suitable for the rapid detection of Staphylococcus aureus,Shigellaspp.,Salmonellaspp.andListeria monocytogenesin meat.
multiplex polymerase chain reaction (PCR);pathogen;meat;detection
TS201.6
A
1002-6630(2011)06-0213-04
2010-04-12
黑龙江省科技厅资助项目(GA07B401)
刘红玉(1970—),女,副教授,博士,主要从事食品科学研究。E-mail:liuhongyu70@sohu.com
