酒花黄酮提取工艺和含量测定
2011-10-13杨建华胡君萍
李 敏,杨建华,李 渊,胡君萍,*
(1.新疆医科大学药学院,新疆 乌鲁木齐 830011;2.新疆医科大学附属肿瘤医院,新疆 乌鲁木齐 830011)
酒花黄酮提取工艺和含量测定
李 敏1,杨建华2,李 渊1,胡君萍1,*
(1.新疆医科大学药学院,新疆 乌鲁木齐 830011;2.新疆医科大学附属肿瘤医院,新疆 乌鲁木齐 830011)
建立酒花黄酮的提取方法和含量测定方法。采用NaNO2-Al(NO3)3-NaOH显色法,以芦丁为对照品,通过单因素试验和L9(34)正交设计确定酒花黄酮的提取方法,并测定和比较酒花、酒糟和啤酒中黄酮的含量。结果表明:酒花黄酮提取方法为样品加入50倍的甲醇,超声提取2次,每次1h,酒花黄酮含量为69.98mg/g,酒糟和啤酒中黄酮的含量较低。对照品芦丁在10.2~40.8μg/mL质量浓度范围内与吸光度呈良好线性关系,平均回收率99.33%,RSD=3.60%。该提取方法合理,含量测定方法简便、快速、准确,可用于酒花黄酮提取物制备及其质量控制。
酒花;黄酮;提取工艺;含量测定
啤酒花Humulus lupulusL.是桑科(Moraceae)葎草属(HumulusLinn.)多年生草质蔓生藤本植物,其雌性球穗花序简称酒花[1]。酒花是一种使用历史悠久的药食同源植物,不仅用于啤酒的酿制,还具有抗菌和镇静作用,传统医学用作结核病、麻风病、神经衰弱症的治疗[2-3]。酒花原产欧洲,主产地分布于美国、欧洲、澳大利亚、南美洲和中国,我国新疆天山、阿尔泰山的山坡林间有大量野生分布,在东北、华北有栽培[4]。酒花富含树脂、挥发油、多酚、黄酮等多种生物活性成分,其中黄酮类成分(酒花黄酮)是代表酒花多种生物活性的一类重要物质。酒花黄酮包括黄
酮醇糖苷和异戊二烯查尔酮两类,前者主要包括黄芪苷、异槲皮素、芸香苷、山柰酚苷等成分,具有抗病毒、抗菌、抗肿瘤、抗氧化等活性[5];后者包括黄腐酚、异黄腐酚、异戊二烯基柚皮素等成分,为酒花所特有,具有预防癌症和抑制癌细胞扩增[6-9]、抗病毒[10]、抗菌[11]、抗氧化[12]及雌激素样作用[13]。酒花黄酮结构类型多样、生物活性显著、在啤酒花中含量高、药食用途广泛,显示了良好的开发利用前景。新疆是酒花的主产区,酒花资源丰富,但其药用价值尚未得到有效开发。本实验建立酒花黄酮的提取工艺和含量测定方法,比较不同酒花样品的黄酮含量,为进一步制备酒花黄酮提取物及其功能性开发利用提供一定参考。
1 材料与方法
1.1 材料、试剂与仪器
颗粒酒花(产地新疆吉木萨尔县)经新疆医科大学药学院胡君萍副教授鉴定为啤酒花Humulus lupulusL.;啤酒花及酒糟样品干燥,粉碎,过40目筛,冷藏备用。颗粒酒花、酒糟、啤酒 新疆乌苏啤酒厂。
芦丁标准品 中国药品生物制品检定所;亚硝酸钠、硝酸铝、氢氧化钠、9 5%乙醇、甲醇、乙酸乙酯、丙酮(均为分析纯)。
ST-02A型多功能粉碎机 永康帅通工具有限公司;AB104-N电子天平 上海Mettler Toledo公司;SX721分光光度计 山东高密分析仪器厂;KQ300DE型数控超声清洗机(功率300W,频率400kHz) 昆山市超声仪器有限公司;KD-S2.4数显恒温水浴锅 金坛市医疗仪器厂。
1.2 方法
1.2.1 酒花黄酮测定原理[14]
在黄酮类化合物溶液中加入铝离子试剂后,黄酮类化合物中的酚羟基与铝离子生成络合物,控制适宜的pH值,所生成的络合物在可见区能获得特征吸收峰,其质量浓度与吸光度符合比尔定律,其颜色深浅与黄酮类化合物的量成一定的比例关系,可以定量测定。
1.2.2 对照品溶液的配制
精密称取干燥至质量恒定的芦丁对照品25.5mg,置于50mL容量瓶中,用50%甲醇溶解并定容至刻度,摇匀,制成质量浓度0.51mg/mL的对照品溶液。
1.2.3 供试品溶液的制备
精密称取颗粒酒花粉末1g、酒糟粉末3g,加入50倍体积的甲醇溶液,超声提取2次,每次1h,过滤,合并滤液,浓缩,定容至50mL,摇匀,即分别制得酒花供试品溶液和酒糟供试品溶液。
啤酒临用前超声20min去除泡沫,即得啤酒供试品溶液(每100mL啤酒的质量为4.1382g)。
1.2.4 测定波长的选择
精密吸取酒花供试品溶液1mL,置于10mL容量瓶中,加入5% NaNO2溶液0.3mL,摇匀,放置6min后加入10% Al(NO3)3溶液0.3mL,放置6min,再加入10%NaOH溶液4.0mL,摇匀,用溶剂稀释至刻度,摇匀。以溶剂代替供试品溶液同法制备空白对照,15min后扫描200~800nm波长范围的吸光度,确定最大吸光度在510nm,因此分光光度法选择510nm为测定波长。
1.2.5 标准曲线的制备
精密量取芦丁对照品溶液0.2、0.4、0.6、0.8、1.0、1.2、1.4、1.6mL于10mL容量瓶中,分别加入5%NaNO2溶液0.3mL,摇匀,放置6min后加入10% Al(NO3)3溶液0.3mL,放置6min,再加入10% NaOH溶液4.0mL,摇匀,用溶剂稀释至刻度,15min于波长510nm处测定吸光度。以质量浓度C(μg/mL)为横坐标、吸光度A为纵坐标,建立标准曲线,得回归方程:A=0.0108C-0.023,r=0.9985,表明芦丁在10.2~40.8μg/mL质量浓度范围内与吸光度呈良好线性关系。
1.2.6 精密度实验
精密吸取酒花供试品溶液0.3mL,按1.2.5节方法测定吸光度6次,其RSD为2.46%。
1.2.7 稳定性实验
精密吸取酒花供试品溶液0.3mL,按1.2.5节方法,每隔0.5h测定1次吸光度,共测5次,计算吸光度的RSD为1.33%,表明显色液在2.5h内较稳定。
1.2.8 重复性实验
精密吸取0.3mL酒花供试品溶液6份,按1.2.5节方法测定吸光度,计算结果的RSD为2.00%。
1.2.9 回收率实验
精密吸取酒花供试品溶液9份各0.15mL,分别加入对照品溶液(0.51mg/mL)0.2、0.4、0.6mL,按1.2.5节方法测定吸光度,计算回收率和RSD。结果见表1。
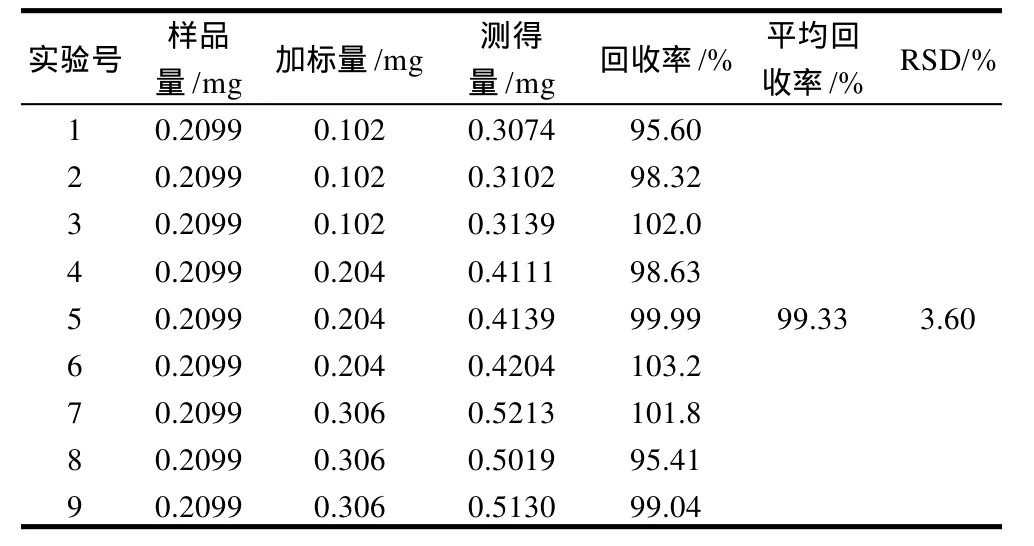
表1 回收率实验结果Table 1 Results of recovery rate experiments
1.2.10 酒花黄酮提取工艺优化
在建立酒花黄酮含量测定方法的基础上,采用单因素试验筛选了酒花黄酮的5种提取溶剂(水、乙醇、甲醇、丙酮和乙酸乙酯)和4种提取方法(冷浸法、回流法、索式提取法和超声法);并采用L9(34)正交设计,考察了溶剂体积、提取时间和提取次数对酒花黄酮含量的影响,优化并确定了酒花黄酮的最佳提取工艺。
1.2.11 样品中黄酮含量测定
按1.2.3节分别制备酒花、酒糟和啤酒供试品溶液各6份,精密吸取酒花供试品溶液0.3mL、酒糟供试品溶液4.0mL、啤酒供试品溶液4.0mL,按1.2.5节方法测定吸光度,代入回归方程计算各供试品中黄酮的含量[黄酮含量/(mg/g)=CDV/m×100,其中C为样品溶液质量浓度/(μg/mL),V为样品溶液稀释后总体积/mL,D为样品稀释倍数,m为样品质量/g]。
2 结果与分析
2.1 酒花黄酮提取工艺的筛选
2.1.1 提取溶剂的选择
精密称取颗粒酒花粉末1g共10份,分别加入水、乙醇、甲醇、丙酮、乙酸乙酯各5 0 m L,超声提取30min,过滤。精密吸取滤液1.0mL,按1.2.5节方法测定吸光度,另取25mL滤液浓缩干燥,计算浸膏得率[浸膏得率/%= 浸膏质量×2/样品质量×100]。结果见表2。
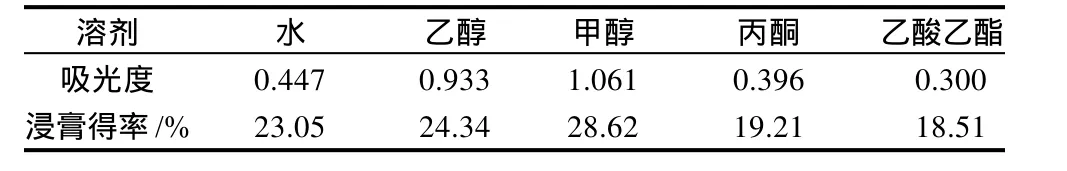
表2 不同溶剂提取液的吸光度和提取率(n=2)Table 2 Absorbance and extraction rates of the extracts using different extraction solvents (n=2)
由表2可知,各溶剂对酒花黄酮提取率差异明显,以甲醇溶液的吸光度和浸膏得率为高,因此选择甲醇为酒花黄酮的提取溶剂。
2.1.2 提取方法的选择
精密称取颗粒酒花样品粉末适量,加入50倍量甲醇溶液,分别采用冷浸法(室温浸泡30min)、回流法(75℃水浴回流30min)、索式提取法(75℃水浴至提取液无色)和超声法(超声30min)提取,提取液冷却至室温,补足质量损失,过滤。分别取滤液1.0mL,按1.2.5节方法测定吸光度,另取25mL滤液浓缩干燥,计算浸膏得率。结果见表3。

表3 不同提取方法所得提取液的吸光度和提取率(n=2)Table 3 Absorbance and extraction rates of the extracts using different extraction methods (n=2)
结果表明,上述提取溶液中以超声法吸光度略高,而回流法浸膏得率略高,考虑到超声法简便易行,故采用超声法提取酒花黄酮。
2.1.3 酒花黄酮提取工艺优化
在以上单因素试验的基础上,采用L9(3)4正交设计(表4),确定酒花黄酮最佳提取工艺。精密称取酒花样品粉末各1g,以甲醇为提取溶剂,采用超声提取法,优选溶剂体积、提取时间和提取次数,提取液过滤,滤液浓缩并定容至50mL。精密吸取上述溶液0.3mL,按1.2.5节方法测定吸光度,按回归方程计算黄酮的含量。结果见表5。

表4 酒花黄酮提取正交试验的因素和水平Table 4 Factors and levels of orthogonal tests for optimizing the extraction conditions of flavonoids

表5 酒花黄酮提取正交试验结果(n=2)Table 5 Results and analysis of orthogonal tests for optimizing the extraction conditions of flavonoids (n=2)
由表5极差分析可得,各因素对黄酮提取工艺的影响顺序为B(提取时间)>C(提取次数)>A(溶剂体积),酒花黄酮最佳提取工艺A2B2C2,即精密称取供试品粉末适量,加入50倍体积甲醇溶液、超声提取2次、每次1h。
2.2 样品中黄酮含量测定
分别制备酒花、酒糟和啤酒供试品溶液,按1.2.10节方法测定各供试品中的黄酮含量。实验结果见表6。结果表明,上述3种样品中,颗粒酒花黄酮含量最高,其次为商品啤酒,而酒糟中黄酮含量很低。

表6 3种供试品中的黄酮含量(n=6)Table 6 Contents of total flavonoids in three samples (n=6)
3 结 论
本研究采用单因素和正交试验确定了酒花黄酮的提取工艺,即精密称取供试品粉末适量,加入50倍体积甲醇溶液、超声提取2次、每次1h。并以芦丁为对照品,采用NaNO2-Al(NO3)3-NaOH显色法测定颗粒酒花、酒糟和啤酒中黄酮的含量,方法操作简便、稳定性和重现性好,对设备要求低,是检测酒花黄酮的可靠方法。
啤酒酿造企业使用的酒花制品有全酒花、酒花粉、颗粒酒花、酒花浸膏、酒花油制品等[15]。本实验的研究对象颗粒酒花是世界上使用最广泛的酒花制品,它是将粉碎至一定规格的粉状酒花压制成直径为2~8mm,长约15mm的短棒,充以惰性气体并包装,因此颗粒酒花能有效防止酒花中有效成分的氧化和损失。酒花黄酮是酒花多酚的重要组成部分[16],本研究结果表明,颗粒酒花、酒糟和啤酒3种酒花样品的黄酮含量差异很大,其中颗粒酒花黄酮含量最高,达69.98mg/g,而酒糟中黄酮含量极低,不足颗粒酒花的1%。
[1] 中国科学院植物研究所. 中国高等植物图鉴: 第1册[M]. 北京: 科学出版社, 1994: 502.
[2] 周娟, 邹翔, 季宇彬. 啤酒花的有效成分及活性研究[J]. 哈尔滨商业大学学报: 自然科学版, 2005(4): 414-417.
[3] 欧阳军. 啤酒花化学药理研究与临床应用[J]. 中国民族医药杂志,1999(1): 95.
[4] 朱丹, 牛广才, 姜述君, 等. 酒花的化学成分及药理作用[J]. 中国药业, 2008, 17(21): 1-2.
[5] 李隽, 崔承彬, 蔡兵, 等. 啤酒花黄酮的研究进展[J]. 中草药, 2008,39(7): 1110-1114.
[6] PAN L, BECKER H, GERHAUSER C. Xanthohumol induces apoptosis in cultured 40-16 human colon cancer cells by activation of the death receptor- and mitochondrial pathway[J]. Mol Nutr Food Res, 2005, 49(9): 837-843.
[7] HO Y C, LIU C H, CHEN C N, et al. Inhibitory effects of xanthohumol from hops (Humulus lupulusL.) on human hepatocellular carcinoma cell lines[J]. Phytother Res, 2008, 22(11): 1465-1468.
[8] COLGATE E C, MIRANDA C L, STEVENS J F, et al. Xanthohumol,a prenylflavonoid derived from hops induces apoptosis and inhibits NF-kappaB activation in prostate epithelial cells[J]. Cancer Lett, 2007, 246(1/2): 201-209.
[9] DELMULLE L, BELLAHCENE A, DHOOGE W, et al. Anti-proliferative properties of prenylated flavonoids from hops (Humulus lupulusL.)in human prostate cancer cell lines[J]. Phytomedicine, 2006, 13(9/10):732-734.
[10] WANG Qian, DING Zhihui, LIU Jikai, et al. Xanthohumol, a novel anti-HIV-1 agent purified from HopsHumulus lupulus[J]. Antiviral Res,2004, 64(3): 189-194.
[11] GERHAUSER C. Broad spectrum anti-infective potential of xanthohumol from hop (Humulus lupulusL.) in comparison with activities of other hop constituents and xanthohumol metabolites[J]. Mol Nutr Food Res,2005, 49(9): 827-831.
[12] STEVENS J F, MIRANDA C L, FREI B, et al. Inhibition of peroxynitrite-mediated LDL oxidation by prenylated flavonoids: the alpha, beta-unsaturated keto functionality of 2'-hydroxychalcones as a novel antioxidant pharmacophore[J]. Chem Res Toxicol, 2003, 16(10):1277-1286.
[13] MILLIGAN S R, KALITA J C, POCOCK V, et al. The endocrine activities of 8-prenylnaringenin and related hop (Humulus lupulusL.) flavonoids[J]. J Clin Endocrinol Metab, 2000, 85(12): 4912-4915.
[14] 努尔阿米娜·阿尤甫, 阿不都拉·阿巴斯. 曼陀罗种子中总黄酮含量测定及提取工艺的研究[J]. 食品科学, 2008, 29(3): 260-263.
[15] 朱恩俊. 酒花及酒花制品在啤酒工业中的应用[J]. 中国食物与营养,2006(8): 25-28.
[16] 刘玉梅, 汤坚, 刘奎舫. 啤酒花的化学研究及其和啤酒酿造的关系[J]. 酿酒科技, 2006(2): 71-75.
Optimization of Extraction Process and Content Determination of Total Flavonoids inHumulus lupulusL.
LI Min1,YANG Jian-hua2,LI Yuan1,.H.UJun-ping1,*
(1. College of Pharmacy, Xinjiang Medical University,..830011, China;2. Affiliated Tumor Hospital, Xinjiang Medical University, 830011, China)
Ultrasonic extraction conditions for total flavonoids fromHumulus lupulusL. were optimized by single factor experiments and orthogonal design with the aim of establishing a sample preparation method for determination of the content of total flavonoids inHumulus lupulusL. by NaNO2-Al(NO3)3-NaOH colorimetric method using rutin as the reference. The optimal extraction process parameters were material-to-liquid ratio of 1:50, extraction duration of 1 h and repeated extraction number of 2. The content of total flavonoids fromHumulus lupulusL. was 69.98 mg/g under the optimal extraction conditions, which was much higher than that of residues and beer. The linear range was between 10.2 μg/mL and 40.8 μg/mL with a correlation coefficient of 0.9985. The average recovery rate was 99.33% with a relative standard deviation of 3.60%. The extraction and determination methods were simple and feasible, which is suitable for the preparation and quality control of flavonoids extracted fromHumulus lupulusL.
Humulus lupulusL.;total flavonoids;extraction;determination
O623.54
A
1002-6630(2011)06-0016-04
2010-04-18
新疆维吾尔自治区高校科研计划重点项目(XJEDU2009I24)
李敏(1983—),女,讲师,硕士,主要从事天然药用植物资源的开发与利用研究。E-mail:hjp-yft@163.com
*通信作者:胡君萍(1971—),女,副教授,博士,主要从事新疆特色药用资源的开发与利用研究。E-mail:yjh-yft@163.com
