果糖与氨基酸美拉德反应产物的抗氧化性研究
2011-10-11张晓溪张泽生孙媛霞
张晓溪,曾 艳,张泽生,孙媛霞,*
(1.天津科技大学食品工程与生物技术学院,天津300457;2.中科院天津工业生物技术研究所,天津300308)
果糖与氨基酸美拉德反应产物的抗氧化性研究
张晓溪1,2,曾 艳2,张泽生1,孙媛霞2,*
(1.天津科技大学食品工程与生物技术学院,天津300457;2.中科院天津工业生物技术研究所,天津300308)
为分析果糖参与的美拉德反应对氨基酸、多肽与蛋白质理化性质及抗氧化性的影响,利用果糖与四种代表性氨基酸(赖氨酸、甘氨酸、组氨酸、半胱氨酸)进行模式美拉德反应;考察了反应过程中体系的褐变与pH变化,并测试了体系的ABTS、DPPH自由基清除能力,铁氰化钾还原能力以及铁铜离子螯合能力在美拉德反应前后的变化。结果表明,反应体系的酸度以及褐变程度均随美拉德反应的进行逐渐增加,体系清除自由基能力与还原能力也大幅度提高。此外,氨基酸的结构与种类对美拉德反应的进行以及相应产物的性能都会产生较大影响。
果糖,美拉德反应,抗氧化能力,褐变
美拉德反应(Maillard reaction,MR),又称非酶褐变反应,指的是氨基化合物(氨基酸、肽及蛋白质)与羰基化合物(糖类)经过一系列复杂反应,生成还原酮、含氮含硫杂环化合物以及类黑精等产物的过程[1]。大量研究证实美拉德反应产物(Maillard Reaction Products,MRPs)具有抗氧化、抗诱变、抗病毒等特性[2]。尤其是抗氧化性,使之具有取代BHA、BHT类合成抗氧化剂的潜力。MRPs的特性不仅受反应温度、反应时间及反应体系pH等因素的影响,而且反应物种类在其中更是起着主导作用。目前国内对Maillard反应模型的研究中,氨基酸主要选择赖氨酸、精氨酸或甘氨酸,糖源则是葡萄糖或木糖[3-4],果糖的Maillard反应模型甚少受到关注。与葡萄糖(己醛糖)比较,果糖(己酮糖)具有甜度高、能量低的特点,同时其代谢不需要胰岛素辅助,对血糖影响小,适宜葡萄糖代谢异常及肝功能不全的患者食用[5]。此外,果糖在体内还有稳步释放能量的作用,饮用果糖饮料不但可增加体能和耐力,还可保持体力和消除疲劳[6]。由于果糖在食品方面的应用日趋广泛,以果糖为糖源的Maillard反应也成为食品工业中引人注目的研究热点。因此,本文选择果糖与四种代表性氨基酸在特定温度、时间以及pH下进行美拉德反应,考察了反应过程中体系的褐变与酸度变化,并测试了反应前后体系中Maillard反应产物的抗氧化作用变化,以期对果糖参与的美拉德反应在改善氨基酸、多肽与蛋白质抗氧化性方面的应用提供预见性指导。
1 材料与方法
1.1 材料与设备
D-果糖(Fru)、L-赖氨酸(Lys)、L-甘氨酸(Gly)、L-组氨酸(His)、L-半胱氨酸(Cys) 均为生化试剂,购于天津市光复精细化工研究所;NaOH、HCl、吡啶、FeCl2、K3Fe(CN)6均为分析纯,购于北京化学试剂公司;DPPH(1,1-二苯基苦基肼)、ABTS(2,2′-连氮基-双-(3-乙基苯并二氢噻唑啉-6-磺酸)铵盐)、Ferrozine 均为分析纯,购于 Sigma-Aldirch公司;邻苯二酚紫、三氯乙酸 均为分析纯,购于Alfa公司。
AL204电子天平、FE20/EL20 pH计 瑞士梅特勒Mettler Toledo;DF-101S集热式恒温加热磁力搅拌器 巩义予华;UV-1800紫外分光光度计 岛津。
1.2 实验方法
1.2.1 美拉德反应产物(MRPs)的制备 在含有一定量D-果糖的纯水溶液中分别加入四种氨基酸(Lys、Gly、His、Cys)后,调节pH至9并定容到20mL,溶液中氨基酸和糖的浓度均为0.1mol/L。四种糖-氨基酸混合溶液在120℃油浴中回流加热反应,每间隔1h取样一次,测试反应体系的pH与褐变程度变化,用于检测Maillard反应进程。反应4h后停止加热。所有反应获取的样品在冰水浴中快速冷却并进行测定,剩余样品-20℃冰箱保存。
未经加热的糖-氨基酸溶液作为对照样品,其它加热样品的制备与分析测试实验均重复三次。计算多次测试值的标准偏差,在图中用棒状线表示。
1.2.2 理化特性的测定
1.2.2.1 褐变的测定 在不同热反应时间下制备的样品均用纯水稀释8倍后,在420nm处测定其吸光值变化。
1.2.2.2 pH的测定 吸取一定量的反应液,快速冷却至室温(25℃)后,测定pH。
1.2.2.3 全波长扫描的测定 经4h热反应的样品用纯水稀释50倍,在200~700nm紫外可见吸收波长下进行扫描。
1.2.3 ABTS自由基清除能力的测定 ABTS自由基清除能力的测定采用Re和Pellegrini等人的方法[7]。首先进行 ABTS自由基的制备,即配制 ABTS(7mmol/L)和过硫酸钾(2.63mmol/L)混合液,室温避光静置12~16h,使用前用10mmol/L磷酸盐缓冲液(pH7.4)进行适当稀释,使其位于734nm处的吸光值为0.7±0.02。

ABTS自由基清除能力测定的具体操作如下:移取50μL被稀释40倍的MRPs样品加入到3mL稀释的ABTS自由基溶液中,轻微振荡混匀并置于暗处反应6min,测定反应液在734nm的吸光值,记为Asample。以50μL纯水代替MRPs样品,相同操作,记为Ablank。此外,移取 50μL稀释的 MRPs样品于 3mL的10mmol/L磷酸盐缓冲液(pH 7.4)中,相同操作,测定反应液在734nm的吸光值,记为Acontrol。1.2.4 DPPH自由基清除能力的测定 DPPH自由基清除能力的测定采用Yen和Hsieh的方法[8]。移取400μL被稀释40倍的MRPs样品于2mL 0.25mmol/L的DPPH甲醇溶液中,轻微振荡混匀,将反应体系置于暗处反应30min,测定反应液在517nm的吸光值,记为Asample。以400μL纯水代替MRPs样品,相同操作,记为Ablank。此外,移取400μL稀释的MRPs样品于2mL甲醇中,测定反应液在517nm的吸光值,记为Acontrol。

1.2.5 铁氰化钾还原能力的测定 MRPs铁氰化钾还原能力的测定采用Oyaizu的方法[9]。移取20μL MRPs于1mL纯水中,加入1mL磷酸盐缓冲溶液(0.2mol/L,pH6.6)和1mL 1%的铁氰化钾溶液,混匀。50℃水浴保温20min,加入1mL 10%的三氯乙酸,振荡摇匀后在常温下离心10min,取上清液1mL,加入1mL纯水和200μL 0.1%的三氯化铁溶液,振荡数秒后静置10min,测定其在700nm的吸光值Asample。以20μL纯水代替MRPs样品,相同操作,记为Ablank。此外,以纯水代替所加入的三种试剂,相同操作,记为Acontrol。MRPs样品的铁氰化钾还原能力以700nm处的相对吸光值A作为衡量标准。


1.2.6 铁离子螯合能力的测定 MRPs铁离子螯合能力的测定采用Dinis和Madeira等人的方法[10]。移取50μL的MRPs于2.8mL纯水中,混匀,加入50μL 2.0mmol/L的FeCl2溶液,放置30s,再加入5mmol/L的Ferrozine溶液100μL,快速剧烈振荡,静置10min,测定溶液在562nm的吸收值,记作Asample。以50μL纯水代替MRPs样品,同样操作,记为Ablank。此外,移取50μL稀释的MRPs样品于2.95mL纯水中,记录其在562nm处的吸光值,记为Acontrol。1.2.7 铜离子螯合能力的测定 MRPs铜离子螯合能力的测定采用 Wang和 Xiong的方法[11]。移取1mL 2mmol/L的CuSO4溶液与1mL吡啶溶液混合,振荡混匀后,加入100μL 0.1%的邻苯二酚紫溶液,再次振荡混匀,随后加入1mL纯水与100μL相应的MRPs样品,振荡混匀后静置10min,记录溶液在632nm的吸光值。记作Asample。以50μL纯水代替稀释的MRPs样品,同样操作,记为Ablank。此外,移取50μL MRPs样品于3mL纯水中,记录其在632nm的吸光值,记为Acontrol。
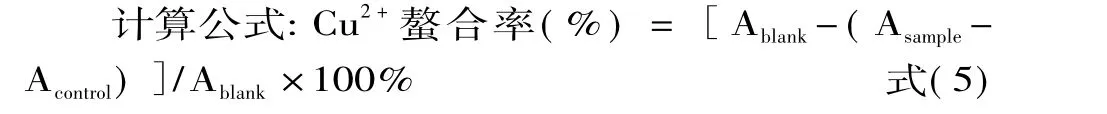
2 结果与分析
2.1 褐变程度的变化
根据文献报道,美拉德反应体系在420nm处的紫外吸收大小与美拉德反应中期产物的形成有关[12]。在本实验中,测定了四种氨基酸(Lys、Gly、His、Cys)与 D-果糖(Fru)的美拉德反应产物在420nm处的紫外吸收随反应时间的变化(图1)。结果表明,除Cys-Fru外,其它三种糖-氨基酸反应体系在420nm处的吸收值均随着反应时间的延长而明显增加,这说明美拉德反应的中期产物在不断积累。在四种氨基酸中Lys因存在两个氨基,美拉德反应速率最快,中期产物增加迅速,因此褐变程度比其余氨基酸的反应体系大。而Cys-Fru在整个反应阶段褐变程度增加不明显。这一现象与有关报道相符[13]。主要原因可能是由于巯基硫原子极化形成的空d轨道重叠后亲核作用增强,半胱氨酸的巯基(-SH)在亲核加成反应中能以比氨基(-NH2)高200~300倍的反应速率优先与羰基化合物结合,抑制美拉德反应的进行[13-14]。

图1 D-果糖与四种氨基酸的美拉德反应体系的褐变程度变化
2.2 pH的变化
图2描述了四种氨基酸(Lys,Gly,His,Cys)与D-果糖(Fru)进行美拉德反应过程中pH随反应时间的变化。四种氨基酸参与的反应体系在反应初期,溶液均呈碱性。随着反应进行,四种反应体系的pH出现不同程度的下降。这不仅是因为反应中的羰氨缩合封闭了游离的氨基,而且在反应中还形成了甲酸、乙酸等酸性物质[15]。在这四种体系中,pH下降幅度最大的是Gly,最小的则为Cys。与褐变变化不同的是,赖氨酸由于存在的两个α-氨基,其pH下降幅度低于Gly[16]。
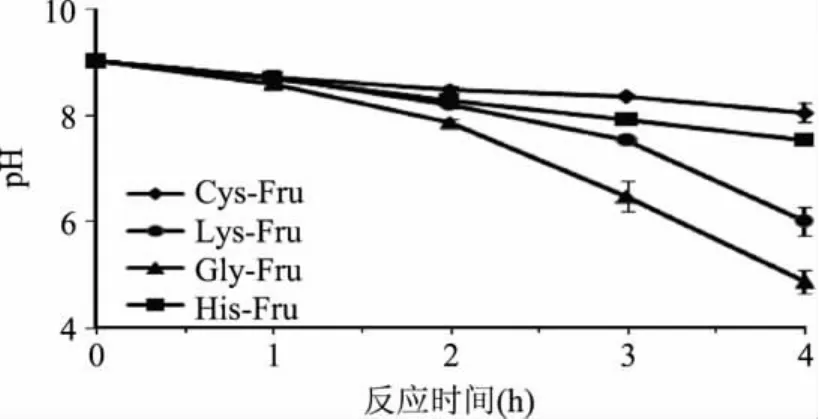
图2 D-果糖与四种氨基酸美拉德反应体系pH随时间的变化
2.3 全波长扫描检测结果
在200~700nm波长范围内,测定了加热反应4h的美拉德反应产物(稀释50倍)的紫外可见吸收光谱(图3)。虽然种类不同,但这四种氨基酸反应体系的吸收曲线却有着大体相同的趋势和轮廓。其主要吸收范围均位于200~400nm。这说明这四种体系进行美拉德反应4h的主要产物为中、小分子,其在可见光区几乎没有吸收。从200~400nm范围内的紫外吸收强度来看,Lys-Fru>His-Fru>Gly-Fru>Cys-Fru。这一吸收强度的排序除His-Fru外,均与褐变程度的变化相同。His-Fru体系在271nm与316nm处出现两个峰,推测其为300nm附近吸收峰裂分造成,这一现象可能是由组氨酸自身所带有的咪唑基团引起的。

图3 D-果糖与四种氨基酸体系在反应4h后的紫外可见吸收光谱图
2.4 自由基清除能力
图4显示了果糖与四种氨基酸进行美拉德反应前后自由基清除能力的变化。除Cys-Fru体系外,其他三种氨基酸与果糖进行4h美拉德反应后,ABTS和DPPH自由基清除能力均有显著增加,并且增加分别在6倍和10倍以上。这说明美拉德反应在提高氨基酸的自由基清除能力上具有强大功效。

图4 D-果糖与四种氨基酸美拉德反应前后ABTS(a)和DPPH(b)自由基清除能力变化
美拉德反应前,在四种氨基酸-糖体系中只有Cys-Fru的抗氧化性较好,根据文献报道这主要归功于其所含有的巯基具有较强的清除自由基能力[17]。而反应后,可能是因为巯基在反应中遭到了破坏,Cys-Fru的ABTS自由基清除能力下降,而DPPH自由基清除率仍有小幅度增加,推测这两种自由基清除能力的变化不同可能是由两种自由基清除能力的作用原理不同引起的。
2.5 美拉德反应产物的铁氰化钾还原能力变化
除自由基清除能力外,美拉德反应产物的抗氧化能力还能通过其还原能力体现。图5描述了四种氨基酸与果糖反应前后铁氰化钾还原能力的变化。由图5可知,除Cys之外,其余三种氨基酸-糖混合溶液本身无任何还原能力,但经过美拉德反应后还原能力都有显著的增加,这说明果糖参与的美拉德反应能够有效提高产物的还原能力。而Cys-Fru反应体系的还原能力变化与其在ABTS自由基清除能力上的变化是一致的。
2.6 美拉德反应产物的金属离子(Fe2+、Cu2+)螯合能力
一些具有多价态的金属离子可以参与某些特定的自由基生成反应,如Fe2+参与Feton反应可产生氧自由基。而一旦金属离子被螯合,其参与的自由基生成反应就有可能被束缚[18]。因此物质的抗氧化性也与其对金属离子的螯合性(尤其是Fe2+、Cu2+)密切相关。我们也对美拉德反应前后这四种体系螯合铁铜离子的能力变化进行了测试。
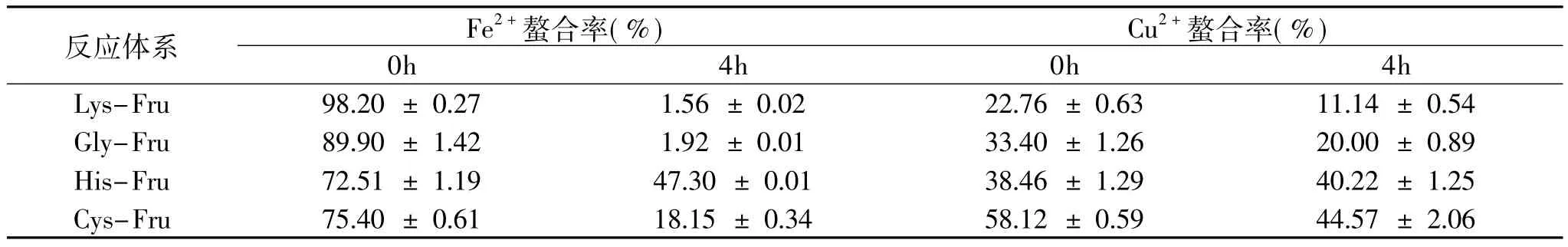
表1 美拉德反应产物对金属离子(Fe2+、Cu2+)螯合能力的变化
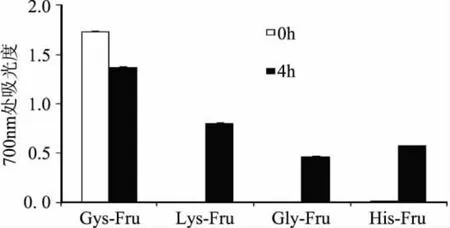
图5 D-果糖与四种氨基酸美拉德反应前后铁氰化钾还原能力的变化
由表1可知,在Fe2+的螯合上,4h美拉德反应后,四种体系的螯合能力均明显减弱。尤其是Lys和Gly对应的体系几乎不能螯合Fe2+。我们推断这一现象的出现主要是因为美拉德反应4h后,氨基酸中能够有效螯合Fe2+的氨基基团被大量消耗[19],而同样能够有效螯合Fe2+的类黑精大分子却还未大量产生。His和Cys的下降幅度相对较低,一是因为其美拉德反应速率比Lys和Gly低,二是其带有的特殊官能团咪唑基与巯基可能会在一定程度上螯合Fe2+,起到补偿作用。
在Cu2+的螯合上,四种体系的变化都不如对Fe2+的螯合变化明显。除His外,其余三种氨基酸Cu2+的螯合能力在美拉德反应后均有小幅度的下降。我们猜测由于氨基不能作为Cu2+的优良配体,所以四种体系螯合Cu2+的变化小。此外,由于咪唑基作为Cu2+的优良配体[20]热稳定性高,His-Fru体系对Cu2+的螯合经历4h的美拉德反应后几乎不受影响。
3 结论
已有文献表明MRPs的抗氧化作用主要基于其能破坏自由基链并延缓其生成,还原过氧化物和钝化自由基,络合重金属[21]。本研究利用果糖与四种代表性氨基酸(Lys,Gly,His,Cys)进行美拉德反应,并对各体系在反应中的pH变化、褐变以及反应前后与抗氧化性相关的一系列指标进行了测定比较。结果表明,在反应过程中四种体系的酸度和褐变程度均不断增强。通过美拉德反应过程,除半胱氨酸外,其他三种氨基酸反应体系的自由基清除能力(包括ABTS和DPPH)与还原能力均有显著的提高,而且美拉德反应能改变氨基酸螯合金属离子的能力。氨基酸结构的不同,会导致相应美拉德反应产物各种能力的差异,如由于巯基作用半胱氨酸在美拉德反应前后的抗氧化性变化异于其余三种氨基酸,而美拉德反应对组氨酸螯合Cu2+的作用改变微弱可能归功于组氨酸的咪唑基是Cu2+的优良配体基团。
综上所述,我们认为果糖参与的美拉德反应是提高氨基酸、多肽以及蛋白质抗氧化作用的一种重要途径,但是在进行美拉德反应时,需要充分考虑氨基酸、多肽以及蛋白质自身结构组成的功效。
[1]吴松,秦军.美拉德反应产物的研究进展[J].中国科技信息,2005(11):71.
[2]Borrelli R C,Mennella C,Barba F,et al.Characterization of coloured compounds obtained by enzymatic exraction of backery products[J].Food Chem Toxicol,2003,41:1367-1374.
[3]王惠英,孙涛.L-赖氨酸与D-核糖的模式美拉德反应产物抗氧化性能研究[J].食品科学,2008,29(5):112-115.
[4]张凌燕,李倩,尹姿,等.3种氨基酸和葡萄糖美拉德产物的物理化学特性及抗氧化活性的研究[J].中国食品科技,2008(3):12-22.
[5]闫序东.果糖结晶工艺研究[D].江南大学,2008.
[6]周日尤,向春燕.低聚果糖的功能、应用、生产及发展前景[C].上海:第十一届中国国际食品添加剂和配料展览会学术论文集,2007:116-120.
[7]Re R,Pellegrini N,Proteggente A,et al.Antioxidant activity applying an improved ABTS radical cation decolourization assay[J].Free Radical Biol Med,1999,26:1231-1237.
[8]Yen G,Hsieh P.Antioxidative activity and scavenging effects on active oxygen of xylose-lysine Maillard raction products[J].J Sc Food Agric,1995,67:415-420.
[9]Oyaizu M.Antioxidative activity of browning products of glucosamine fractionated by organic solvent and thin-layer chromatography[J].J Jpn Soc F,1988,35:771-775.
[10]Dinis T C P,Madeira V M C,Almeida L M.Action of phenolic derivatives(acetoamino-phen,salycilate and 5-aminosalycilate)as inhibitors of membrane lipid peroxidation and as peroxyl radical scavenges[J].Arch Biochem Biopys,1994,315:161-169.
[11]Wang L,Xiong Y L.Inhibition of lipid oxidation in cooked beef patties by hydrolyzed potato protein is related to its reducing and radical scavenging ability[J].J Agric Food Chem,2005,53:9186-9192.
[12]Lee H S,Nagy S.Relationship of sugar degradation to detrimental changes in citrus juice quality[J].Food Technol,1998,42:91-97.
[13]Molnar-Perl I,Friedman M.Inhibition of browning by sulfur amino acids.2.Fruit juices and protein containing foods[J].J Agric Food Chem,1990,38:1648-1651.
[14]Friedman M.Improvement in the safety of foods by sulfhydryl-containing amino acids and peptides.A review[J].J Agric Food Chem,1994,42:3-20.
[15]Rufian-Henares J A,Morales F J.A new application of a commercial microtiter plate-based assay for assessing the antimicrobial activity of Maillard reaction products[J].Food Res In,2006,39:33-39.
[16]张国珍.食品生物化学[M].北京:农业出版社,1990:60-65,308-313.
[17]Billaud S C C,Pöchtrager S.A comparison study between antioxidant and mutagenic properties of cysteine glucose-derived Maillard reaction products and neoformed products from heated cysteine and hydroxymethylfurfural[J].Food Chem,2009,114:132-138.
[18]Dinis T C P,Madeira V M C.Action of phenolic derivatives(acetaminophen,salicylate,and 5-aminosalicy-late)as inhibitors of membrane lipid peroxidation and as peroxyl radical scavengers[J].Arch Biochem Biophys,1994,315:161-169.
[19]Bishov S J,Henick K S.Antioxidant effect of protein hydrolysates in a freeze-dried model system [J].J Food Sci,1972,37:873-875.
[20]焦勇,韩大雄,杨频.铜离子(II)抑制Aβ多肽聚集机理的分子模拟[J].中国科学B辑化学,2005,35(4):303-311.
[21]Duh P D.Antioxidative activity of Budrock Arctium lappa Linn:Its scavenging effect on free radical and active oxengy[J].JAOCS,1998,75:455-461.
Study on maillard reaction of D-fructose and amino acids and antioxidant activity of their products
ZHANG Xiao-xi1,2,ZENG Yan2,ZHANG Ze-sheng1,SUN Yuan-xia2,*
(1.College of Food Engineering and Biotechnology,Tianjin University of Science and Technology,Tianjin 300457,China;2.Tianjin Institute of Industrial Biotechnology,Chinese Academy of Sciences,Tianjin 300308,China)
To analyze how the Maillard reaction of D-fructose influences the physiochemical properties and the antioxidant activity of amino acid,polypeptide and protein,the four Maillard reaction models were built between D-fructose and amino acids(lysine,glycine,histidine and cysteine,respectively).The pH value and absorbance of the systems during the Maillard reaction were measured.The change of the scavenging effect on free radicals(ABTS and DPPH),reducing power and the metal-ion chelating activities of Maillard reaction products(MRPs)in the systems were also evaluated.The results showed that the browning and acidity of the MRPs kept increasing with the heating time.The radical scavenging activity and reducing power of MRPs were enhanced greatly.In addition,the species and structure of amino acid had an important influence on the proceeding of the Maillard reaction and the properties of corresponding MRPs.
D-fructose;Maillard reaction;antioxidant activity;browning
TS201.2
A
1002-0306(2011)06-0175-05
2010-05-20 *通讯联系人
张晓溪(1986-),女,硕士研究生,主要从事美拉德反应及抗氧化性能研究。
国家高科技研究发展计划(863计划)(2009AA02Z201);天津市自然科学基金(10JCYBJC08900)。
