多模态分子影像对肝癌进展和血管生成的研究
2011-10-11马喜波秦承虎朱守平薛贞文
马喜波, 田 捷, 杨 鑫, 秦承虎, 朱守平, 薛贞文
中国科学院自动化研究所医学图像处理研究组,北京 100190
多模态分子影像对肝癌进展和血管生成的研究
马喜波, 田 捷, 杨 鑫, 秦承虎, 朱守平, 薛贞文
中国科学院自动化研究所医学图像处理研究组,北京 100190
通过对HCCLM3-fLuc-GFP肝癌的进展和血管生成的多模态成像分析,对肝癌细胞在体内生长的适应过程和级数生长特性,分别进行了生物自发荧光成像 (bioluminescent imaging,BLI)研究、激发荧光成像(fluorescent imaging,FMI)研究和小动物计算机断层成像 (micro-computed tomography,Micro-CT)研究,对采集的成像数据进行定性定量分析,并与肿瘤的体积测量数据进行了相关性分析。结果表明,肿瘤细胞在接种后第4天细胞数量基本为原接种数量的一半,第7天体内的细胞基本与接种数量相等,7天内细胞基本完成了体内的适应过程,之后肝癌细胞进入了快速增殖期。BLI成像、FMI成像均与肿瘤体积的测量结果高度相关 (R2=0.9263,R2=0.9068)。通过计算机断层成像 (Micro-CT),对肿瘤的新生血管进行分析,并用可视化的手段对肿瘤的血管新生特性进行三维显示,Micro-CT成像结果验证了BLI、FMI成像揭示的肿瘤生长后期的非指数生长特性。
生物自发荧光成像;激发荧光成像;计算机断层成像;肝癌进展;血管生成
引 言
肝癌是威胁人类生命的一种重要癌症,其死亡率历年都居高不下[1~3]。HCCLM3是近年来发现的一种肝癌亚型,主要见于亚洲人群,在欧美国家极少,对其发病机理和抗癌疗效的研究报道极少[4~6],因此对HCCLM3的分子影像研究尤为重要。目前主要利用传统的生物学手段,如采用测量肿瘤体积的方法研究肝癌进展。由于在肿瘤接种的早期,肿瘤细胞对体内环境有一个适应的过程,在此过程中还未形成瘤块,这是传统方法无法测量的;后期,在肿瘤体积较大时,肿瘤内部由于营养供应不全出现局部坏死[7],导致测量肿瘤体积的方法不能真实、完全地反应肿瘤的生长进展。目前,血管生成研究主要采用病理切片的方法,实验鼠的处死给后续的连续观测造成极大的困难,血管生成研究也无法做到整体性。分子影像方法通过使用造影剂 Fenestra VC[8,9],可以在体地对肿瘤周围的新生血管成像并进行直观的三维显示。
分子影像学 (molecular imaging)是美国哈佛大学Weissleder等人于1999年提出的概念,是指应用影像学方法,对活体状态下的生物过程进行细胞和分子水平的定性及定量研究[10,11]。它是以体内特定分子作为成像对比度的医学影像技术,能在真实、完整的动物或人体内,通过图像直接显示细胞或分子水平的生理和病理过程。分子影像学融合了分子生物化学、数据处理、纳米技术、图像处理等技术,具有高特异性、高灵敏度和超高图像分辨率的特性,可以为临床诊断提供定性、定位、定量的资料。
生物自发荧光成像 (bioluminescent imagin,BLI)以其高灵敏、低成本的特性正在引起生物医学研发领域的关注,也已被初步应用于肿瘤机理研究和药物疗效评价的相关领域中[12~15]。激发荧光成像 (fluorescent imagin,FMI)由于不需要转基因技术构建内部的荧光探针而有可能应用于临床,但其灵敏度低、自体荧光噪声高的缺点限制了其在肿瘤早期探测、联合用药疗效评估中的应用[16~19]。小动物计算机断层成像 (micro-computed tomography,Micro-CT)对肿瘤的探测也存在灵敏度低的缺点,但其对肿瘤新生血管的可视化显示技术,在新型肿瘤研究初期以及抗肿瘤血管生成药物的疗效评价中,隐藏着巨大的应用价值[20,21]。多模态分子影像技术可以综合各个成像模态的优点,从而对肿瘤进展和新生血管进行定量化研究,为肿瘤机理研究和药物研发提供了可靠的在体成像方式[22~24]。
材料与方法
材料
HCCLM3-fLuc-GFP人肝癌细胞系由上海第二军医大学赵健老师赠与。D-Luciferin购自海德创业生物科技有限公司,将其配制成15 mg/mL的溶液后,置于-20℃冷冻保存,备用。18F-FDG由北京大学医学部放射性同位素中心提供。血管造影剂Fenestra VC购自ART Advanced Research Technologies Inc,直接使用。
细胞培养和动物模型的构建
HCCLM3-fLuc-GFP人肝癌细胞系在含10%胎牛血清的DMEM培养基中培养,置于含5%CO2的37℃恒温箱中孵育。雌性BALB/c裸鼠 (4~5周龄)购自北京大学医学部动物实验中心。所有动物实验严格按照 “北京大学动物保护和使用委员会”的规定执行。HCC-LM3-fLuc-GFP荷瘤鼠模型通过对BALB/c裸鼠右腋皮下注射2×106细胞建立。荷瘤鼠模型建立12 h后开始进行成像实验研究。
生物自发荧光成像和图像获取
所有的生物自发荧光实验均使用同一个在体的光学分子影像系统ZKKS-MI-IV(由中科凯盛医疗技术有限公司和中国科学院自动化研究所分子影像中心共同研制)。成像采用背照式CCD相机,光圈大小通过f-number值来调节。通过液氮制冷技术将相机温度降至-120℃,并保持稳定,CCD的暗电流可降低至0.5 electrons/pixel·hour。为了计算获得图像的绝对光强度值,通过一个12英寸的积分球来校准CCD输出值的绝对光强度。
成像前,将实验鼠置于麻醉盒中 (通有2%的异氟烷)5 min,使其麻醉。成像过程中,将实验鼠置于暗箱的成像平台上,并通过平台上输气孔中的2%异氟烷来保持实验鼠的麻醉状态。为了更直观地区分肿瘤和正常组织并确定肿瘤在荷瘤鼠体的位置,通常将得到的荧光图像和背景图像叠加到一起并加伪彩。 图像采集和处理均使用自行研发的操作系统WinMI进行。
激发荧光成像和图像获取
激发荧光成像实验使用的光学分子影像系统也是ZKKS-MI-IV,成像同样采用背照式CCD相机。根据GFP(green fluorescent protein)的波长范围,成像中采用中心波长为488 nm、波长范围20 nm的激发光滤光片,采用中心波长是525 nm、波长范围为20 nm的接收光滤波片。为了避免激发光光源对成像的影响,成像平台由暗箱进行屏蔽。
成像过程中,将实验鼠麻醉后置于成像平台上。图像的叠加方法同上,同样采用我们自行研发的WinMI系统。
计算机断层成像、图像重建和可视化
荷瘤鼠肿瘤新生血管信息的获得由Micro-CT系统实现。Micro-CT系统硬件主要由射线源、探测器和电控位移系统组成。射线源采用牛津的UltraBright,焦斑尺寸13~40 μm,管电压10~90 kV,管电流 100~2000 μA,最高输出功率80 W,并可通过配备的控制箱调节电压、电流和功率。探测器采用日本滨松的C7942CA-02,像素尺寸50 μm,像素数目2400×2400,有效面积 (120×120)mm2。电控位移系统由平移台、转台及控制箱组成。电控平移台选用北京卓立汉光公司的KSA200-11,其分辨率达到1.25 μm,电控转台采用卓立汉光公司的RAK-100,其角度分辨率达到0.0125°。电控平移台和转台采用卓立汉光的控制箱进行调节。
成像前,将扫描对象固定在转台上,并使其处于CT的有效视野中,利用自行开发的CT控制软件设置相应的扫描参数,如探测器积分时间、扫描角度间隔、扫描电压、功率等,CT控制软件通过控制箱调节各设备至所需状态。成像过程中,转台采用步进式前进,每旋转一个角度间隔,探测器采样一次并储存。扫描结束后,利用自行开发的CT重建后处理软件3DMED(MITK,Medical Image Processing and Analyzing Group,Institute of Automation,Chinese Academy of Sciences,Beijing,China;www.mitk.net),将扫描得到的一系列投影数据转化为三维数据,通过分割、配准和可视化,对肿瘤的新生血管进行图像显示。
体外细胞自发荧光成像实验
为了分析细胞数量与荧光强度的关系,我们采用不同浓度梯度的细胞进行自发荧光成像。首先,收集足够的HCCLM3-fLuc-GFP细胞,按照4倍的稀释比例将其从1×105、2.5×104依次稀释至780个细胞,做3个重复;然后,将细胞依次加入黑色的96孔板中,每孔加入50 ml荧光素酶底物D-luciferin(3 mg/mL),用PBS将每孔的反应体系调至100 ml。
孵育10 min后,用ZKKS-MI-IV系统进行荧光图像采集。CCD的成像参数设置如下:f-number=2.8, binning=6, controllergain=3, rate=1 MHz, resolution=16 bits, exposure time=300 s。通过在荧光强度值上减掉相应的背景噪声,我们得到感兴趣区域的灰度值。根据积分球校准得到的灰度值和光强度值之间的关系,可以计算感兴趣区域的荧光强度值,单位为光子数/秒 (photon/s)。
在体生物自发荧光成像实验
自发荧光成像实验分别在肿瘤细胞接种后的第12 h(记为第0 d)和第4、7、10、14、17、21、24、28、31、35、38、41 d进行。为了避免食物对荧光图像采集的影响,成像的12 h前对荷瘤鼠禁食。成像的相机参数设置如下:f-number=2.8,binning=4,controller gain=3,rate=1 MHz,resolution=16 bits,readout=low noise,exposure time=30 s。注射底物剂量为100 μl/10g,根据底物与荧光素酶作用的时间曲线,10~25 min后开始采集荧光图像。感兴趣区域的选取和荧光强度的计算同体外细胞实验,根据积分球校准得到的灰度与绝对光强度的关系,最终得到单位时间内的光子数 (photon/s)以衡量荧光强度的大小。
在体激发荧光成像实验
激发荧光成像实验的采集时间也分别在肿瘤细胞接种后的第12 h(记为第0 d)和第4、7、10、14、17、21、24、28、31、35、38、41 d进行。成像的相机参数设置如下,f-number=2.8,binning=1,controller gain=3,rate=1 MHz,resolution=16 bits,readout=low noise,exposure time=2 s.根据与背景的差异来选取感兴趣区域,同时也以单位时间内的光子数 (photon/s)来计数发射荧光的强度。
在体Micro-CT肿瘤新生血管成像
肿瘤新生血管图像采集在肿瘤接种后第39 d进行。成像使用的造影剂为Fenestra VC,分别在注射造影剂后第9、18和27 min进行3次扫描,每次约9 min。成像参数设置如下:X光管电压=60 kVp,功率=60 W,光源前用0.5 mm厚的铝板滤除软X射线,探测器积分时间=0.467 s(内触发),投影数据在B1条件下采集后,由软件拼合成B2输出 (即为B1 to B2),单帧投影图像大小为1120×1144,像素大小=0.1 mm×0.1 mm。360°范围内采集500个投影数据。扫描持续时间为8.5 min。
肿瘤组织病理分析
HCCLM3-fLuc-GFP荷瘤鼠在接种后第5 w处死,取肿瘤组织,固定后常规石蜡包埋,4 μm切片。切片依次经如下处理:
1)二甲苯脱蜡,经各级乙醇至水洗:二甲苯 (Ⅰ)5 min→二甲苯 (Ⅱ)5 min→100%乙醇2 min→95%乙醇1 min→80%乙醇1 min→蒸馏水洗2 min;
2)苏木素染色5 min,自来水冲洗;
3)盐酸乙醇分化30 s;
4)自来水浸泡15 min或温水 (约50°)5 min;
5)伊红液2 min;
6)常规脱水、透明、封片:95%乙醇 (Ⅰ)3 min→95%乙醇 (Ⅱ)1 min→100%乙醇(Ⅰ)1 min→100%乙醇 (Ⅱ)1 min→二甲苯石碳酸 (3∶1)1 min→二甲苯 (Ⅰ)1 min→二甲苯 (Ⅱ)1 min→中性树脂封固。
经上述处理后,将病理学切片用光学显微镜观察,用Leica DFC300 FX病理图像分析系统分析、采集图像。数据分析
定量数据通过加和取平均的方法获得,并以标准偏差的方式来表示。平均值采用单因素方差分析法 (one-way analysis of variance,ANOVA)和t检验进行数据分析对比,当P<0.05时可认为结果有统计学意义。
结果与讨论
体外自发荧光成像
通过体外培养HCCLM3-fLuc-GFP和HCCLM3细胞,进而对其增殖性、成瘤性、转移性进行对比研究,没有发现明显的不同。由于萤火虫荧光素酶基因 (fLuc)和绿色荧光蛋白基因 (GFP)构建在同一个载体上,并共用同一个启动子,所以通过研究萤火虫荧光素酶报告基因的表达水平与细胞数量的关系,即可得知GFP与细胞数量的关系。通过对不同数量的HCCLM3-fLuc-GFP细胞的BLI图像采集和光子计算,我们发现细胞数量和fLuc的表达呈现稳定的线性相关性 (R2=0.9987,见图1)。
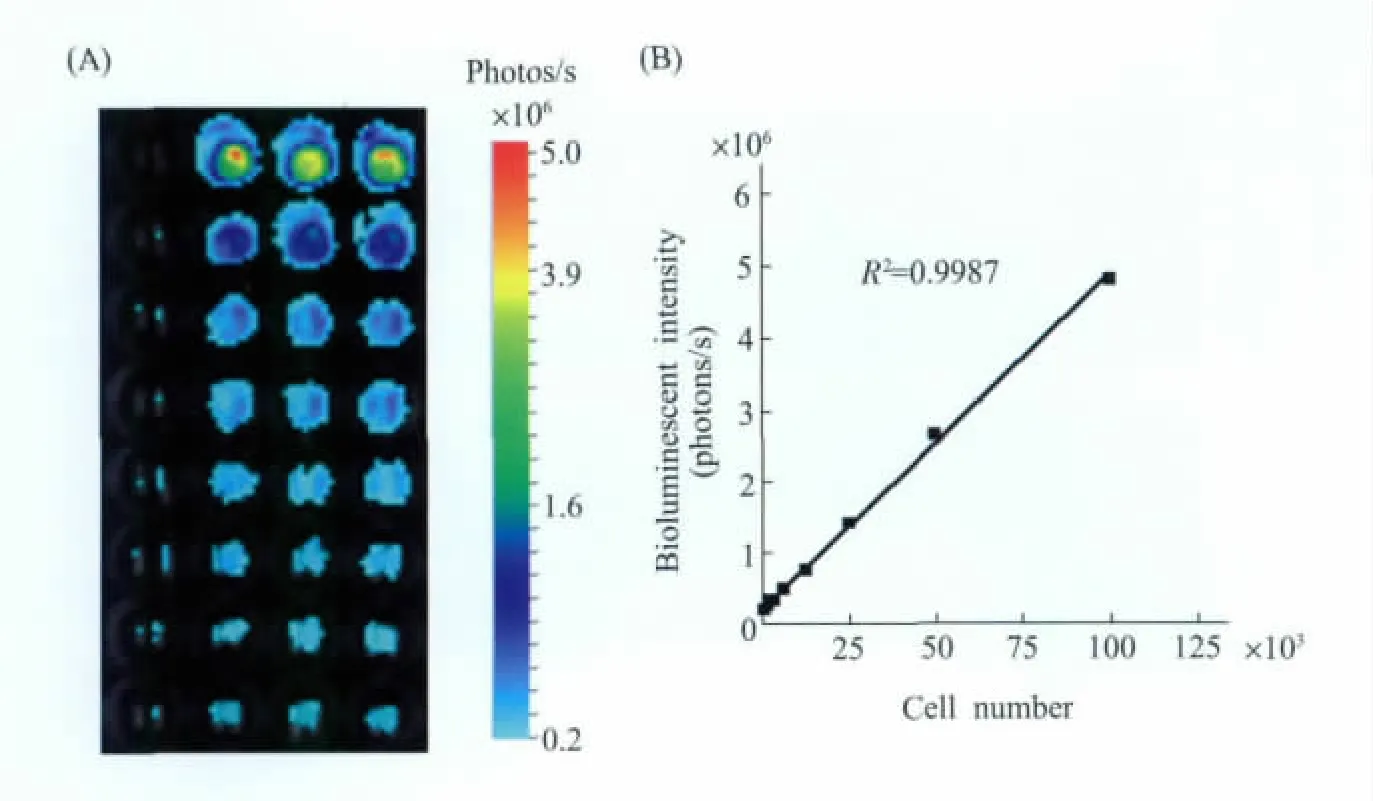
图1 (A)不同细胞数量的生物自发荧光图像,细胞数量由高到低对应着荧光强度由强到弱;(B)HCCLM3-fLuc-GFP的细胞数量与荧光信号强度的线性相关性。线性回归分析表明,细胞数量与荧光信号强度呈现高度相关性 (R2=0.9987,P<0.0001)[14]Fig.1 (A)A diluted series of HCCLM3-fLuc-GFP cells was visualized by bioluminescent imaging.A higher number of cells showed more intense bioluminescent signal;(B)Correlation between the bioluminescent signals of HCCLM3-fLuc-GFP cells and cell number. Linear regression analysis indicated high correlation between the bioluminescent signals and the cell number(R2=0.9987,P<0.0001)[14]
在体自发荧光、激发荧光和病理分析结果对肿瘤进展的观测

图2 HCCLM3-fLuc-GFP荷瘤鼠接种后不同时间的自发荧光图像[14]Fig.2 Serial bioluminescence images of the HCC-LM3-fLuc-GFP tumor-bearing nude mice after tumor inoculation[14]
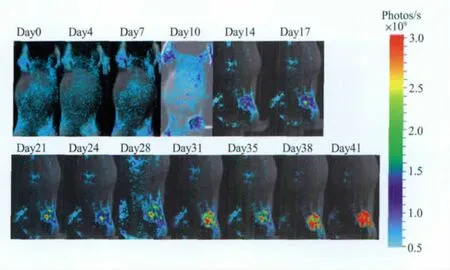
图3 HCCLM3-fLuc-GFP荷瘤鼠接种后不同时间的激发荧光图像Fig.3 Serial fluorescence images of the HCC-LM3-fLuc-GFP tumor-bearing nude mice after tumor inoculation
为了监测HCCLM3-fLUC-GFP肿瘤的进展,组内7只裸鼠在接种后12 h即开始进行BLI和FMI图像数据采集。在接种后1 w内,肿瘤细胞生长呈现先衰减后生长的趋势,接种后的前4 d是肿瘤细胞适应体内环境的过程,后3 d才开始出现增长。约1 w后,肿瘤荧光达到接种当天的强度 (见图2,图3),之后便呈现级数生长的趋势。定量的生物荧光强度和激发荧光强度分析结果也验证了这一结论 (见图4A,B)。在肿瘤生长的前3 w,荷瘤鼠体重随之逐渐生长,裸鼠活跃,肿瘤对其影响较小;随着肿瘤体积的增大,荷瘤鼠体重反而减少且活动不便,反映了肿瘤体积增大对裸鼠心、肝、肺等脏器的压迫及竞争抑制作用(见图4C)。通过对肿瘤体积、肿瘤生物荧光定量计算结果和肿瘤激发荧光定量计算结果的相关性分析发现,肿瘤体积和肿瘤生物荧光强度呈较高的相关性 (R2=0.9263,见图4D),肿瘤体积和肿瘤激发荧光强度的相关性略低于前者 (R2=0.9068,见图4E),分析结果显示肿瘤生物荧光强度和激发荧光强度呈现高度相关性 (R2=0.9961,见图4F)。肿瘤在生长到一定的体积后,由于内部供养不足,可能呈现局部坏死,接种后第5 w的病理分析见图5,由图可见,结缔组织将瘤体分为多个小的肿瘤灶,每一肿瘤病灶中央坏死。肿瘤病灶的中央坏死将导致肿瘤体积测量大小跟荧光强度的采集出现不一致的结果,而肿瘤生物荧光的强度和激发荧光的强度均反映了肿瘤内活细胞的数量,故两者呈现高度相关性。

图4 (A)接种后HCC-LM3-fLuc-GFP肿瘤的定量自发荧光强度值;(B)接种后HCC-LM3-fLuc-GFP肿瘤的定量激发荧光强度值;(C)接种后不同时间的裸鼠体重变化;(D)HCC-LM3-fLuc-GFP肿瘤大小与自发荧光强度的线性相关性;(E)HCC-LM3-fLuc-GFP肿瘤大小与激发荧光强度的线性相关性;(F)测量的HCC-LM3-fLuc-GFP肿瘤自发荧光强度与激发荧光强度的相关性。x±s,n=7Fig.4 (A)The quantified bioluminescent intensity of the HCC-LM3-fLuc-GFP tumors in the nude mice;(B)The quantified fluorescent intensity of the HCC-LM3-fLuc-GFP tumors in the nude mice;(C)HCC-LM3-fLuc-GFP tumor sizes of the nude mice at different time after inoculation;(D)Correlation between tumor bioluminescent signals measured by in vivo bioluminescence imaging and tumor sizes measured by caliper;(E)Correlation between tumor fluorescent signals measured by in vivo fluorescent imaging and tumor sizes measured by caliper; (F) Correlation between tumor bioluminescent signals measured by in vivo bioluminescence imaging and tumor fluorescent signals measured by in vivo fluorescent imaging.x±s,n=7
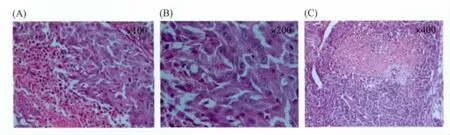
图5 HCCLM3-fLuc-GFP 荷瘤鼠接种后第5 w的肿瘤病理观测结果Fig.5 The pathologicalresults oftumorat5thweek afterHCCLM3-fLuc-GFP cells inoculation
由图2和图3可以看出,BLI成像的灵敏度明显高于FMI的成像灵敏度,在肿瘤接种早期,生物荧光能够精确地反映肿瘤细胞的生长状态,而激发荧光的显像结果在前3次测量中没有明显不同,且肿瘤发射荧光强度与自体荧光强度没有明显区分。由此可见,BLI成像对肿瘤的早期探测以及抗肿瘤药物的疗效评估将是一个有效的工具和手段。
在体Micro-CT对肿瘤新生血管的观测
20世纪70年代初期,Forkman[25,26]即提出:肿瘤的生长需要丰富的血液供应,肿瘤的生长是血管生成依赖的。对肿瘤新生血管研究的传统手段局限于病理染色及切片在显微镜下的观察[27,28],这一方法必须处死裸鼠取出肿瘤进行观测,从而无法对肿瘤新生血管进行连续的后续观测,且无法对其进行整体的研究分析。同时,传统的病理观测手段也非常耗时,无法就新生血管与荷瘤鼠自身血管间的联系进行观测研究。Micro-CT系统通过对肿瘤的新生血管进行三维X射线扫描,并对整体血管进行三维立体化显示,从而可以直观地解释肿瘤生长速度与肿瘤新生血管的依赖关系 (见图6)。Fenestra VC造影剂通过尾静脉注射入裸鼠体内后,在约10~30 min内,造影剂基本还处于血液循环中,所以,其对血管的造影效果基本一致。由Micro-CT的断层图像可以清晰地看到心脏、肝脏中的大血管和肿瘤中的新生血管 (见图6箭头所示的白色区域)。 三维可视化的显示结果可以清晰地显示肿瘤新生血管和心脏、肝脏中血管的连接关系。

图6 (A)荷瘤鼠Micro-CT断层成像结果;(B)肿瘤血管和荷瘤鼠正常血管的三维可视化显示图 (红色是荷瘤鼠大血管、心脏和肝脏血管,绿色是肿瘤的新生血管)Fig.6 (A)The micro computational tomography images of tumor-bearing mouse;(B)Three dimension images of blood vessels(red stands for blood vessels in the heart,lung,liver of the tumor-bearing mouse,green stands for the tumor angiogenesis)
本实验结果显示,与其他肿瘤新生血管相比,该肿瘤的新生血管密度不大,由于营养供给不足,导致该肿瘤生长后期生长趋缓,这可以很好地解释肿瘤生长后期的非指数生长特性。Micro-CT的成像结果充分验证了生物荧光成像的结果。
结 论
在本论文中,我们首先使用生物自发荧光成像和激发荧光成像技术对肿瘤的进展进行了定性、定量的荧光强度图像采集和计算,并与传统的肿瘤测量结果进行了相关性分析,发现二者具有强相关性。分析结果同时表明,肿瘤的生物荧光和激发荧光成像能更好地反应活肿瘤细胞的数量,同时,生物自发荧光成像相对激发荧光成像具有更高的成像灵敏度,使之能够更好地应用于肿瘤转移灶的探测及抗肿瘤药物的疗效评估。其次,通过Micro-CT对肿瘤新生血管的断层成像研究及三维可视化显示结果,为在活体条件下对肿瘤新生血管相关机制的研究及抗肿瘤新生血管药物疗效 (如恩度等)的综合评价,提供了有效的成像手段。
1. Vecchia CL,Lucchini F,Franceschi S,Negri E,Levi F.Trendsin mortality from primary liver cancer in Europe.Eur J Cancer,2000,36:909~915
2. Jemal A,Tiwari RC,Thun MJ.Cancer statistics.Cancer J Clin,2004,54:8~29
3. Chen Z,Liu B,Chen J.Smoking and liver cancer in China: Case-controlcomparison of36000 livercancer deaths vs.17000 cirrhosis deaths.Int J Cancer,2003,107(1):106~112
4.Zhao J,Dong L,Lu B,Wu G,Xu D,Chen J,Li K,Tong X,Dai J,Yao S,Wu M,Guo Y.Down-regulation of osteopontin suppresses growth and metastasis of hepatocellular carcinoma via induction of apoptosis.Gastroenterology,2008,135:956~968
5.Zhao J,Lu B,Xu H,Tong X,Wu G,Zhang X,Liang A,Cong W,Dai J,Wang H,Wu M,Guo Y.Thirty-kilodalton tat-interacting protein suppresses tumor metastasis by inhibition ofosteopontin transcription in human hepatocellular carcinoma.Hepatology,2008,48(1):265~275
6. Zhao J,Chen J,Lu B,Dong L,Wang H,Bi C,Wu G,Guo H,Wu M,Guo Y.TIP30 induces apoptosis under oxidative stress through stabilization ofp53 messenger RNA in human hepatocellularcarcinoma. CancerRes,2008,68(11):4133~4141
7. Black RA,Rauch CT,Kozlosky CJ,Peschon JJ,Slack JL,Wolfson MF, CastnerBJ, Stocking KL, Reddy P,Srinivasan S,Nelson N,Boiani N,Schooley KA,Gerhart M,Davis R,Fitzner JN,Johnson RS,Paxton RJ,March CJ, CerrettiDP. A metalloproteinase disintegrin that releases tumor-necrosis factor-α from cells.Nature,1997,385(6618):729~733
8. Kindlmann GL,Weinstein DM,Jones GM,Johnson CR,CapecchiMR, KellerC. Practicalvesselimaging by computed tomography in live transgenic mouse models for human tumors.Mol Imaging,2005,4:417~424
9. Laperle CM,Hamilton TJ,Philip W,Wakker EJ,Shi DX,Anastasio MA,Derdak Z,Wands JR,Diebold G,Petruck CR.Low density contrast agents for X-ray phase contrast imaging:The use of ambient air for X-ray angiography of excised murineliver tissue.PhysMed Biol,2008,53:6911~6923
10.Ntziachristos V,Ripoll J,Wang LV,Weissleder R.Looking and listening to light:The evolution of whole body photonic imaging.Nat Biotechnol,2005,23(3):313~320
11.Massoud TF,Gambhir SS.Optical imagingof Renilla luciferase reporter gene expression in living mice. Proc Natl Acad Sci USA,2002,99:377~382
12. Pasini AP, Mirasoli M. Bioluminescence and chemiluminescence in drug screening.Anal Bioanal Chem,2003,377:826~833
13.Wang W,Deiry WS.Bioluminescent molecular imaging of endogenousand exogenousp53-mediated transcription in vitroandin vivousing an HCT116 human colon carcinoma xenograft model.Cancer Biol Ther,2003,2:196~202
14.Ma X,Liu Z,Yang X,Gao Q,Zhu S,Qin C,Liu K,Zhang B, Han D, Wang F, Tian J. Dual-modality monitoring of tumor response to cyclophosphamide therapy in mice with bioluminescence imaging and small-animal positron emission tomography.Mol Imaging,2010,in press.
15.Beckers B,Lang H,Schimke D,Lammers A.Evaluation of a bioluminescence assay for rapid antimicrobial susceptibility testing of mycobacteria.Eur J Clin Microbiol,1985,4:556~561
16. Chen X, Conti PS, MoatsRA. In vivo near-infrared fluorescence imaging of integrin αvβ3in brain tumor xenografts.Cancer Res,2004,64:8009~8014
17.ChengZ,WuY,XiongZ,Gambhir SS,ChenX.Near-infrared fluorescent RGD peptides for optical imaging of integrin αvβ3expression in living mice. Bioconjugate Chem,2005,16:1433~1441
18.Wu Y,Cai W,Chen X.Near-infrared fluorescence imaging of tumor integrin αvβ3expression with Cy7-labeled RGD multimers.Mol Imaging Biol,2006,8:226~236
19.ShuX,Royant A,LinMZ,AguileraTA,Ram VL,Steinbach PA,Tsien RY.Mammalian expression of infrared fluorescent proteins engineered from a bacterial phytochrome.Science,2009,324:803~807
20.Savai R,Langheinrich AC,Schermuly RT,Pullamsetti SS,Dumitrascu R,Traupe H,Rau WS,Seeger W,Grimminger F, Banat GA. Evaluation of angiogenesis using microcomputed tomography in a xenograft mouse model of lung cancer.Neoplasia,2009,11:48~56
21.Cheung A,Brown A,Cucevic V,Roy M,Needles A,Yang V,Hicklin DJ,Kerbel RS,Foster FS.Detecting vascular changes in tumour xenografts using micro-ultrasound and micro-CT following treatment with VEGFR-2 blocking antibodies.Ultras Med Biol,2007,33:1259~1268
22.Willmann JK,Bruggen N,Dinkelborg LM,Gambhir SS.Molecular imaging in drug development.Nature,2008,7:591~607
23.Balogova S,Kerrou K,Grahek D,Montravers F,Angelard B, Susini B, EI Chater P, St Guily JL, Talbot JN.Prospective comparison ofFDG and FET PET/CT in patients with head and neck squamous cell carcinoma.Mol Imaging Biol,2008,10:364~373
24.Korpal M,Yan J,Lu X,Xu S,Lerit DA,Kang Y.Imaging transforming growth factor-β signaling dynamics and therapeutic response in breast cancer bone metastasis.Nat Med,2009,15:960~967
25.Forkman J.Tumor angiogenesis:Therapeutic implications.N Engl J Med,1971,285:1182~1186
26.Forkman J.Tumor angiogenesis:Rolein regulation of tumor growth.Symp Soc Dev Biol,1974,30:43~52
27.Forkman J.Tumor angiogenesis.Adv Cancer Res,1974,19:331~358
28.Forkman J.Tumor angiogenesis:A possible control point in tumor growth.Ann Intern Med,1975,82:96~100
Key Words: Bioluminescentimaging; Fluorescentimaging; Micro-computed tomography; Livertumor proliferation;Tumor angiogenesis
Research on Liver Tumor Proliferation and Angiogenesis Based on Multi-Modality Molecular Imaging
MA Xibo,TIAN Jie,YANG Xin,QIN Chenghu,ZHU Shouping,XUE Zhenwen
Medical Image Processing Group,Institute of Automation,Chinese Academy of Sciences,Beijing 100190,China
Sep 15,2010 Accepted:Nov 2,2011
TIAN Jie,Tel:+86(10)82628760,Fax:+86(10)62527995,E-mail:tian@ieee.org;jie.tian@ia.ac.cn
To detect the HCC-LM3-fLuc-GFP tumor adaptive and exponential process of tumor progression,bioluminescent imaging (BLI) and fluorescent imaging (FMI) were used to calculate the bioluminescent intensity and fluorescent intensity.The results showed that in the first four days,tumor cells became fewer because of the phagocytosis and decomposition of the macrophage and the trypsins.At about the seventh day,the tumor cells were equal with the number of the cells on the first day.This adaptive process cost about one week.In the following days,the tumor began to mount up exponentially.A good linear correlation was found between the tumor sizes measured by caliper and the BLI signals(FMI signals)determined by the optical imaging(R2(tumor sizes and BLI signals)=0.9263;R2(tumor sizes and FMI signals)=0.9068;R2(BLI signals and FMI signals)=0.9961).In addition,to study the tumor angiogenesis,Micro-CT was used to visualize the tumor blood vessels.The figures clearly displayed the connection between the tumor blood vessel and heart,liver or lung blood vessels.
2010-09-15;接受日期:2010-11-02
“973”计划项目(2006CB705700,2011CB707700),中国科学院知识创新工程重要方向项目(KGCX2-YW-907),国家自然科学基金项目(81027002,81071205),中国科学院百人计划,北京市教委科技重点项目(KZ200910005005)
田捷,电话:(010)82628760,传真:(010)62527995,E-mail:tian@ieee.org;jie.tian@ia.ac.cn
TP399
10.3724/SP.J.1260.2011.00355
This work was supported by grants from the"973"Program(2006CB705700,2011CB707700),the Knowledge Innovation Project of the Chinese Academy of Sciences(KGCX2-YW-907),the National Natural Science Foundation of China(81027002,81071205),the Hundred Talents Program of the Chinese Academy of Sciences,the Science and Technology Key Project of Beijing Municipal Education Commission(KZ200910005005)
