分子影像监测血管内皮细胞生长因子预处理促进体外和体内脂肪间充质干细胞存活与增殖的研究
2011-10-11范伟伟王亚斌张荣庆李聪叶
范伟伟, 王亚斌, 张荣庆, 李聪叶, 李 霜, 曹 丰
第四军医大学西京医院心血管内科,第四军医大学西京医院分子影像研究中心,西安 710032
分子影像监测血管内皮细胞生长因子预处理促进体外和体内脂肪间充质干细胞存活与增殖的研究
范伟伟, 王亚斌, 张荣庆, 李聪叶, 李 霜, 曹 丰
第四军医大学西京医院心血管内科,第四军医大学西京医院分子影像研究中心,西安 710032
干细胞疗法为缺血性心血管病的组织再生带来希望,然而体内移植后干细胞的不良转归严重制约了其治疗效果。研究表明,血管内皮细胞生长因子 (vascular endothelial growth factor,VEGF)或可对干细胞产生保护作用;同时,分子影像可作为干细胞研究的有力手段,实现体内外干细胞生物学过程的可视化与实时定量监测。该研究首先培养了稳定表达萤火虫荧光素酶报告基因的脂肪间充质干细胞,然后运用报告基因光学成像等分子影像学方法,对体外及体内移植后脂肪间充质干细胞的存活与增殖进行示踪和定量分析,并观察VEGF预处理对细胞活性的影响。光学成像和定量分析结果提示,VEGF可以显著改善体外缺氧损伤后脂肪间充质干细胞的生存与增殖,并延长其体内移植后的生存时间。由此证实,分子影像可以对间充质干细胞的体外与体内生物学过程进行无创、直观、高通量监测,并能有效评价保护性因子VEGF对细胞的作用。
分子影像;间充质干细胞;血管内皮细胞生长因子
引 言
根据世界卫生组织 (WHO)2008年的预测,在未来20年内,缺血性心脏病的死亡率仍将高居全球各类疾病的首位[1]。由于心肌细胞为不可再生的终末分化细胞,因此常规的手术及药物等治疗方法仍不能从根本上逆转缺血导致的心肌组织损伤和进行性功能减退。近年来,干细胞因具有自我更新和多向分化等特性,为缺血性心脏病的再生治疗带来了新的希望[2,3]。研究显示,将胚胎干细胞[4](embryonic stem cells,ESCs)或成体干细胞[5](adult stem cells,ASCs)移植入梗死心肌可改善心室重构和心脏功能,然而其移植后的转归、确切疗效和作用机制仍待进一步阐明[4,5]。我们前期的研究显示,与ESCs相比,ASCs,尤其是间充质干细胞 (mesenchymal stem cells,MSCs),心肌内移植后的存活数量较少,难以发挥长时程治疗作用[2,6,7]。因此,寻找MSCs体外及在体准确、无创、高效和长程的监测手段,同时探索有益于MSCs在缺血组织部位的存活、整合、增殖或分化的有利因素,是进一步研究和促进MSCs有效治疗作用的关键。
新兴的分子影像学 (molecular imaging)可以实现干细胞生物学状态和过程的实时、直观、动态、定量、可重复及特异性成像[8],为干细胞的生物学研究提供了有力平台。此外,研究证实,血管内皮细胞生长因子 (vascular endothelial growth factor,VEGF)作为血管内皮细胞的特异性有丝分裂原,能促进血管新生和心功能的恢复[9],并可能对干细胞具有保护作用[10]。在之前的研究中,我们运用分子影像方法已证实VEGF可以改善移植胚胎干细胞的存活与增殖[10]。
因此,以前期的分子影像研究为基础,本实验采用生物自发光成像 (bioluminescence imaging)等多种评价方法,对稳定表达萤火虫荧光素酶 (firefly luciferase,fluc)报告基因的脂肪源性间充质干细胞 (adipose-derived MSCs,ADMSCs)进行监测与示踪,以实时、定量地评价体外缺氧/复氧 (hypoxia/reoxygenation,H/R)损伤及体内移植后,VEGF预处理对MSCs的生物学活性所产生的影响,旨在为MSCs疗效评估提供无创影像学手段。
材料和方法
材料
实验动物为:1)SPF级β-actin-luc转基因FVB/N小鼠20只 (8~10周龄),购自美国Caliper公司;2)8周龄的雄性BALB/c裸鼠20只 (体质量20~25 g),购自上海实验动物中心,以上动物均饲养于第四军医大学实验动物中心,实验过程中对动物的处置符合中华人民共和国科学技术部2006年颁布的《关于善待实验动物的指导性意见》。DMEM/F12培养基及胎牛血清 (fetal bovine serum,FBS)等购自美国Thermo Hyclone公司;Ⅰ型胶原酶、胰蛋白酶、乙二胺四乙酸 (EDTA)、二甲亚砜 (DMSO)、青/链霉素等均购自美国Sigma公司;VEGF、碱性成纤维细胞生长因子 (basic fibroblast growth factor,bFGF)购自美国PeprotechAsia公司;荧光兔抗鼠单克隆抗体CD44-PE、CD90-APC、CD34-PE、CD45-PE及同种型IgG购自美国eBioscience公司;小动物分子成像系统 (Xenogen IVIS Kinetic)及LivingImage 3.2软件购自美国Caliper公司;D-luciferin购自美国Biotium公司;倒置相差显微镜购自日本OLYMPUS公司,三气孵箱购自美国Thermo公司,流式细胞仪为美国BD公司产品。
方法
ADMSCs的分离培养和表型鉴定
基于Zuk等[11]提出的方法并稍作修改。β-actin-luc小鼠脱颈处死,无菌分离腹腔脂肪组织,剪碎加入0.2% Ⅰ型胶原酶,轻微振摇下在37℃水浴消化1 h。等体积含有DMEM/F12和10%FBS的完全培养基终止消化,细胞悬液室温下200×g离心10 min,重悬后在细胞扩增培养基 (完全培养基中加入5 ng/mL bFGF,青/链霉素各100 U/mL)中,以37℃、5%CO2,饱和湿度培养12 h,去除未贴壁细胞,贴壁细胞消化后,以2×104/cm2密度接种。倒置显微镜观察细胞形态。细胞生长至占瓶底80%时,采用0.05%胰蛋白酶和0.02%EDTA消化传代。
取第3代ADMSCs,PBS重悬计数后,将细胞浓度调整为1.0×106/mL,根据既往研究[11],分别加入荧光素标记的兔抗鼠单克隆抗体CD44-PE、CD90-APC、CD34-PE和CD45-PE,4℃反应30 min,设立同种型非特异性IgG为阴性对照,PBS洗涤后用流式细胞仪进行检测。
ADMSCs生物自发光强度检测
收集第3代ADMSCs。取96孔板1块,每组6个孔,分别加入0.5×104、1.0×104、2.0×104、4.0×104、6.0×104、8.0×104、10.0×104数量的细胞,设 3 个复孔。然后每孔以150 ng/μL的浓度加入报告探针底物萤光素 (D-luciferin),在IVIS中检测生物发光情况,电荷耦合元件 (CCD)曝光时间为3 min,像素合并 (Binning)为4,光圈大小 (F/stop)为1,图像分析采用LivingImage3.2软件,采用fluc平均辐射度定量,单位为光子/秒·厘米2·单位角 (Photons·sec-1·cm-2·steradian-1,P/s·cm2·sr)。PBS 中加入 D-luciferin 作为空白对照。
H/R损伤模型的建立及VEGF分组处理
H/R损伤模型采用第3代ADMSCs,以2.0×104个细胞/孔密度接种于96孔板中,待贴壁后换用无血清DMEM/F12,置于气体浓度为940 ml/L N2、50 ml/L CO2及10 ml/L O2的密闭缺氧孵箱中,于37℃持续缺氧6 h。PBS洗涤后加入ADMSCs完全培养基,放回气体浓度为95%空气及5%CO2的正常孵箱中,于37℃继续培养12 h,完成H/R损伤。
ADMSCs根据是否进行VEGF干预和H/R损伤,分为正常对照组、单纯VEGF干预组、单纯H/R模型组和H/R模型+VEGF干预组。对照组于实验前换用含20%FBS的DMEM/F12培养液,按正常条件培养;H/R模型按上述方法。将培养至第3代的ADMSCs以每块10个孔、每孔2×104个细胞的密度接种于4块96孔培养板。当细胞生长至铺满孔底的70%后,每孔分别以0~10 ng/mL浓度加入VEGF,预处理ADMSCs 48 h,备用。
ADMSCs的体外生物自发光成像和细胞存活率MTT法检测
取上述2块96孔板,1块板继续常规培养 (即单纯VEGF干预组),1块板进行H/R处理。H/R组复氧结束后,每孔以150 ng/μL的浓度加入D-luciferin,在IVIS中检测生物发光情况,并根据VEGF浓度梯度和光学信号强度的关系绘制量效曲线,成像参数设定同上。PBS中加入D-luciferin作为空白对照。
生物自发光成像的同时另取上述2块96孔板,同样分别进行常规培养和H/R处理。复氧结束后,向2块板每孔加入四唑盐溶液 (MTT,5 μg/μL)10 μl,37℃继续孵育4 h。终止培养并吸除培养液后,每孔加入150 μl DMSO振荡10 min至紫色结晶完全溶解。正常培养无VEGF干预的ADMSCs作为对照,选择490 nm波长,在酶联免疫检测仪上测定各孔光吸收值 (A值)。每组均设3个复孔,取平均值计算细胞存活率 (%),即 (处理孔A值/对照孔A值)×100%。
ADMSCs裸鼠后肢肌肉内移植和体内生物自发光成像
收集2.0×107数量的第3代ADMSCs,等分为20份,每份 (含1.0×106个ADMSCs)均重悬于40 μl无菌PBS中,置于EP管内。BALB/c裸鼠 (n=20)随机分为MSCs组和MSCs+VEGF组。动物麻醉后常规皮肤消毒,MSCs组将40 μl细胞悬液谨慎注入裸鼠腓肠肌内,MSCs+VEGF组在40 μl细胞悬液中以10.0 ng/mL加入VEGF。细胞移植12 h后,裸鼠腹腔内以150 mg/kg浓度注射D-luciferin,10 min后,在IVIS中进行生物发光成像。从移植后0天起,采用生物发光成像连续动态观察ADMSCs在体内的存活与增殖情况,监测至移植后第21天。成像参数设定同上。
统计学分析
实验数据均以 x±s表示,应用SPSS17.0软件进行统计分析,组间差异采用One-way ANOVA,组内比较采用Dunnet-t检验,显著性水准为α=0.05。
实验结果
ADMSCs的形态特征、表面标志和生物自发光强度
原代ADMSCs在接种12 h后,倒置显微镜下可见少数集落生长的贴壁细胞,24~48 h后,细胞逐渐融合成单层簇状分布。传代后细胞呈梭形,核居中。平均扩增时间约为48 h。

图1 体外ADMSCs的fluc报告基因光学成像和表面标志 (A)生物自发光成像显示不同数量的ADMSCs稳定表达报告基因fluc;(B)流式细胞学分析证实,以同种型IgG作为阴性对照 (红色),体外培养的ADMSCs高表达MSCs的表面标志CD90和CD44(绿色);(C)定量分析显示ADMSCs细胞数与fluc平均辐射度的直线相关关系Fig.1 Bioluminescence imaging and markers of ADMSCsin vitro (A)ADMSCs by diverse numbers stably carried the reporter gene by bioluminescence imaging; (B) Flow cytometry identified that ADMSCs highly expressed the CD90 and CD44(green)as the markers of MSCs,compare to negative isotype IgG control(red);(C)Quantitative analysis showed a linear correlation existed between cell number and fluc average radiance
报告基因光学成像结果显示,体外培养的ADMSCs稳定表达β-actin-luc(图1A)。流式细胞仪检测结果显示,所分离细胞的CD44、CD90阳性率分别为89.7%和99.0%,而CD34、CD45阳性率均小于3%,表明分离培养的ADMSCs高表达MSCs表面标志 (图1B)。定量分析表明,D-luciferin滴入后,即刻ADMSCs的fluc总辐射通量范围是2.78×105至1.99×106(P/s),CCD曝光时间为3 min;调整感兴趣区域 (region of interest,ROI)面积为π×0.822cm2时,计算出0.5×104至 10.0×104细胞数的ADMSCs的 fluc平均辐射度,从1.20×105±1.22×104至 1.10×106±4.21×105(P/s·cm2·sr) 逐渐增强,与对照组 (1.26×104±1.10×103P/s·cm2·sr)相比具有统计学差异 (P<0.01)。相关分析显示,ADMSCs细胞数与fluc平均辐射度呈正直线相关 (相关系数r2=0.94,方程为y=9.203x+76881)(图1C)。
VEGF预处理对H/R损伤后ADMSCs生物发光成像的影响
生物发光成像结果显示,在单纯VEGF干预组,1.0~10.0 ng/mL浓度的VEGF对正常培养条件下ADMSCs的fluc生物发光信号强度的影响无统计学差异 (P>0.05)(图2A,B)。

图2 生物发光成像评价VEGF对正常培养ADMSCs的影响 VEGF(浓度为1.0~10.0 ng/mL)对正常培养条件下ADMSCs生物发光信号强度的影响Fig.2 Bioluminescence imaging of ADMSCs by VEGF pretreatment The images (A)and the chart(B)indicate that there is no effect of VEGF(1.0~10.0 ng/mL)on ADMSCs'bioluminescence signalintensity under common culture condition
H/R损伤后,无VEGF干预的ADMSCs(单纯H/R模型组),其fluc平均辐射度下降为6.18×104±4.23×103P/s·cm2·sr,与正常培养条件下的 ADMSCs(3.62×105±1.13×104P/s·cm2·sr)相比,差异具有统计学意义 (P<0.01);对于4.0~10.0 ng/mL VEGF预处理的ADMSCs,其H/R损伤后fluc平均辐射度较单纯H/R模型组增强,为1.44×105±1.77×104至2.01×105±1.00×104(P/s·cm2·sr),具有统计学显著性 (P<0.05);而 1.0~3.0(ng/mL)VEGF 浓度组,ADMSCs的fluc平均辐射度与单纯H/R组相比无统计学差异 (P>0.05)。结果表明,4.0~10.0(ng/mL)VEGF预处理可提高细胞H/R损伤后的生物发光信号强度 (图3A,B)。量效曲线分析显示,不同的VEGF预处理浓度 (1.0~10.0 ng/mL),与H/R损伤后ADMSCs的光学信号强度成一定的正相关关系,其效应具有一定的递增趋势 (r2=0.82,方程为y=13475x+65547);然而,VEGF 4.0~10.0 ng/mL浓度梯度组之间无统计学差异 (P>0.05)(图3C)。以上CCD曝光时间均为3 min。
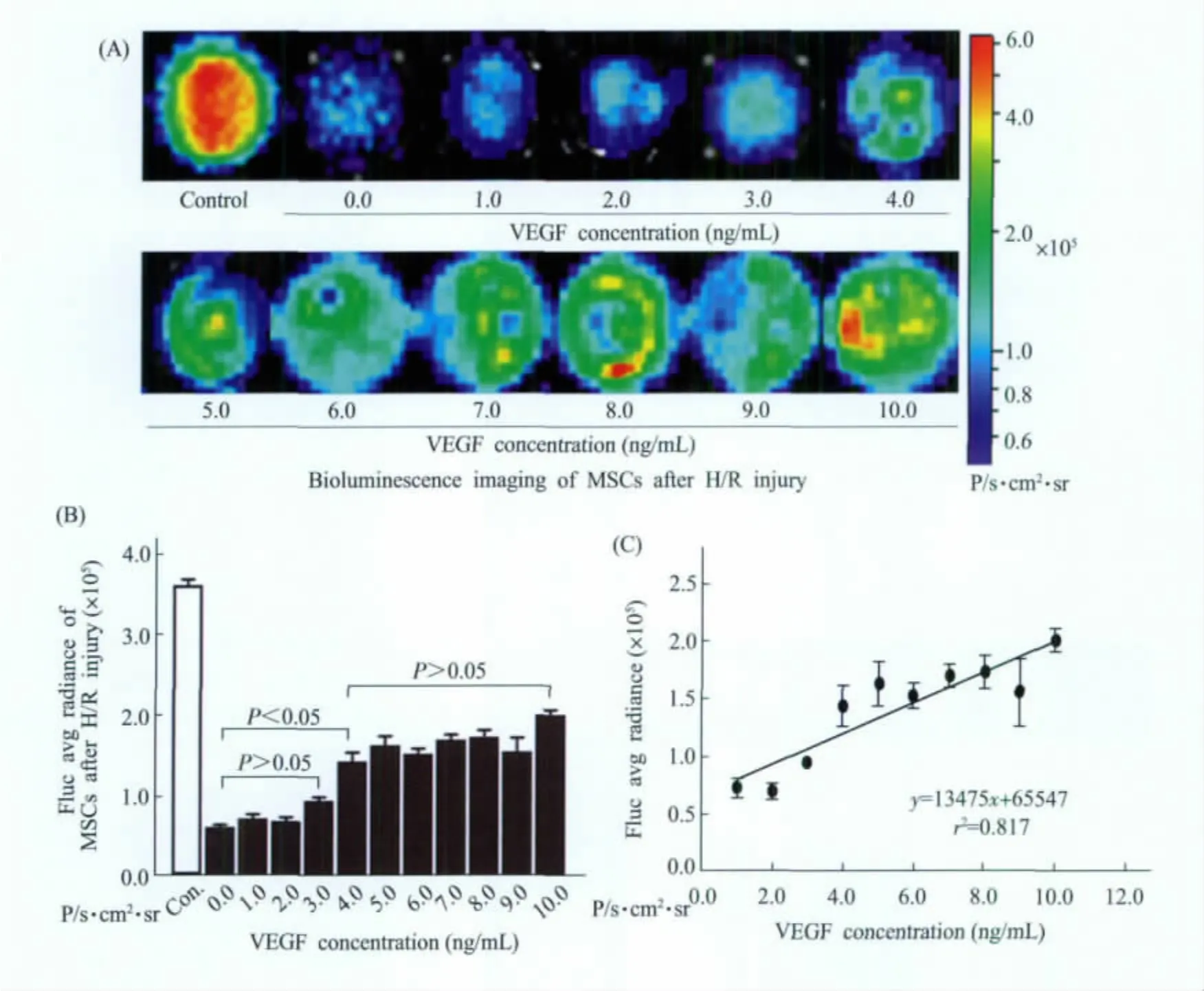
图3 生物发光成像评价VEGF对H/R损伤后ADMSCs存活与增殖的影响 生物发光成像(A)、定量分析(B)和量效曲线(C),提示VEGF(4.0~10.0 ng/mL)可促进H/R损伤后ADMSCs的存活与增殖Fig.3 Bioluminescenceimaging of ADMSCsby VEGF pretreatment with H/R injury The images(A),chart(B)and dose-respose curve(C)indicate the effect of VEGF(1.0~10.0 ng/mL)on bioluminescence signal intensity of ADMSCs after H/R injury.The fluc average radiance of ADMSCs has a significant decrease after H/R injury,and VEGF(4.0~10.0 ng/mL)can promote the bioluminescence signal of ADMSCs
VEGF对H/R损伤后ADMSCs生存活力的影响
ADMSCs的MTT显色深浅随孔板中活细胞数增加而逐渐加深,其A值亦随之升高。取A值均数计算细胞存活率,结果显示,对于正常培养条件下的ADMSCs,不同浓度的VEGF对其生存率的影响与对照组相比没有统计学差异 (P>0.05),且无量效关系(r2=0.095);然而,对于H/R损伤后的ADMSCs,5.0 ng/mL 〔(41±6.9)%〕~10.0 ng/mL 〔(55±4.4)%〕浓度的VEGF预处理可提高其生存率,与单纯H/R损伤模型组 〔(28±3.7)%〕相比具有统计学意义 (P<0.05),而1.0 ng/mL 〔(33±5.4)%〕~4.0 ng/mL 〔(29±2.7)%〕VEGF浓度组与单纯H/R组相比则无统计学差异 (P>0.05)。5.0~10.0 ng/mL VEGF浓度组之间对细胞活力的影响有增强的趋势,但无统计学差异 (P>0.05),VEGF的量效呈弱直线相关关系(r2=0.78)(图 4)。ADMSCs体内移植后存活与增殖情况的分子影像监测
生物自发光成像显示,ADMSCs移植入裸鼠腓肠肌后,其体内光学信号随时间的延长逐渐减弱 (图5A);MSCs组和MSCs+VEGF组ADMSCs移植后即刻,其fluc平均辐射度分别为 2.92×106±1.75×105和 2.95×106±1.31×105(P/s·cm2·sr)(P>0.05);而在移植后 7~21 天,MSCs+VEGF组ADMSCs的信号强度显著高于MSCs组,第7天分别为2.54×106±9.64×104和 1.85×106±8.95×104(P/s·cm2·sr)(P<0.05),至第 21 天分别为 4.14×105±5.34×104和 1.15×105±4.26×104(P/s·cm2·sr)(P<0.05)(图 5B)。结果提示 10.0 ng/mL VEGF 可促进 ADMSCs体内的增殖和存活,并延长ADMSCs移植后的生存时间。

图5 ADMSCs体内移植后生物发光成像示踪与定量 生物自发光成像和定量分析显示,ADMSCs体内移植后,其光学信号强度随时间延长而逐渐减弱,而10.0 ng/mL VEGF预处理可促进ADMSCs的体内存活与增殖,并延长ADMSCs移植后的生存时间Fig.5 In vivo visualization and quantification of implanted ADMSCs by bioluminescence imaging Bioluminescence imaging(A) and quantitative analysis(B)show that the fluc average radiance of ADMSCs has a time-dependent and gradual decrease after transplantation, while VEGF(10.0 ng/mL)pretreatment can enhance the ADMSCs'survival and proliferation in vivo
讨 论
干细胞通过组织新生和旁分泌等作用促进受损心肌组织再生,逐渐成为缺血性心脏病治疗的新选择[13]。干细胞的种类多样,其中骨髓来源的MSC(BMMSC)被证实可以提高心脏功能[14],但受到其不易获取、增殖能力较低等因素的局限。Zuk等[15]的研究表明,脂肪来源的MSC具有较强的增殖与分化潜能,或可作为再生医学较好的细胞来源。因此,实验选取ADMSC作为目标细胞进行研究。
然而,在缺血心肌组织中,MSCs能否在相对缺氧的移植区域中生存,移植后细胞的生物学活性和增殖能力如何等,仍是MSCs治疗面临的巨大挑战。对于研究者,最为关键的是寻找一种准确、无创的监测手段,对干细胞及其生物学状态进行示踪与评估。
分子影像学技术可以在活体细胞和分子水平对干细胞的生物过程进行成像和定量研究,对干细胞的高效、长时程监测具有独特的优势[8,16]。在以往的实验中,我们运用分子影像学方法评价了携带多重报告基因人源ESCs的体外及体内转归[16]。我们前期的分子影像研究还证实,BMMSCs心肌内移植后,由于存活数量等因素,导致其长期、有效的治疗作用严重受限[6]。本研究中,我们选取稳定携带报告基因β-actin-luc小鼠的脂肪组织为来源,在体外培养ADMSCs;通过生物自发光成像、细胞表面标志流式细胞学鉴定及定量分析,证实该细胞具备MSCs的形态学与表型特点,能稳定表达报告基因fluc,可以实现体外和体内生物学过程的分子影像实时定量监测。
同时,针对MSCs移植后的不良转归,我们选择VEGF作为可能的保护因子进行研究。VEGF是目前发现的最强效促血管生成因子,具有促进缺血组织血管形成和抗缺血组织凋亡的功能,并能促进MSCs的血管新生作用[17]。我们前期的分子影像学研究也证实,诱导型表达VEGF165,可以提高移植小鼠ESCs的心脏功能与存活率[10]。
鉴于生物自发光信号可以直观准确地反映细胞的生物学活性,因此,研究建立在以报告基因光学成像为主要监测手段的干细胞影像学平台上。首先通过建立H/R模型在体外模拟缺血再灌注损伤,观察了H/R环境下ADMSCs的生物学活性变化以及VEGF预处理对细胞的保护作用。体外生物发光成像结果表明:VEGF对常氧条件下生长的ADMSCs活性无显著影响;H/R损伤后,ADMSCs的生物学活性显著下降,而一定浓度的VEGF(4~10.0 ng/mL)可以明显提高H/R后ADMSCs的生存与增殖。这一结果也被MTT试验证实。我们还运用生物发光示踪进一步定量监测了ADMSCs体内移植后的转归及VEGF对移植细胞的作用。结果显示,VEGF能够改善移植细胞的体内转归,并延长细胞在移植组织中的存活时间。
本研究以分子影像为主要监测手段,实现了体内MSCs的无创可视化,并以此为基础证实了VEGF可能是干细胞移植后存活的保护性因子。研究初步建立的可视化方法为有效评价体内干细胞移植的长期获益、安全性及作用机制,改善干细胞的移植后转归,最终实现干细胞治疗缺血性心脏病的临床转化创造了有利条件。
1. World Health Organization.World Health Statistics 2008.Geneva:WHO,2008:30
2. Segers V,Lee R.Stem cell therapy for cardiac disease.Nature,2008,451:937~942
3. Thomson JA,Itskovitz-Eldor J,Shapiro SS,Waknitz MA,Swiergiel JJ,Marshall VS,Jones JM.Embryonic stem cell lines derived from human blastocysts. Science, 1998,282(5391):1145~1147
4.Reubinoff BE,Pera MF,Fong CY,Trounson A,Bongso A.Embryonic stem cell lines from human blastocysts:Somatic differentiationin vitro.Nat Biotechnol,2000,18:399~404
5. LaflammeMA,Murry CE.Regenerating theheart.Nat Biotechnol,2005,23:845~856
6.Sheikh AY,Lin SA,Cao F,Cao Y,van der Bogt KE,Chu P,Chang CP,Contag CH,Robbins RC,Wu JC.Molecular imaging of bone marrow mononuclearcell homing and engraftment in ischemic myocardium.Stem Cells,2007,25(10):2677~2684
7.van der Bogt KE,Sheikh AY,Schrepfer S,Hoyt G,Cao F,Ransohoff KJ,Swijnenburg RJ,Pearl J,Lee A,Fischbein M,Contag CH,RobbinsRC,WuJC.Comparisonof different adult stem cell types for treatment of myocardial ischemia.Circulation,2008,118(14 Suppl):S121~129
8. Massoud TF,Gambhir SS.Molecular imaging in living subjects:Seeing fundamental biological processes in a new light.Genes Dev,2003,17:545~580
9. Hedman M, Hartikainen J, Syvänne M, Stjernvall J,Hedman A,Kivelä A,Vanninen E,Mussalo H,Kauppila E,Simula S, Närvänen O, Rantala A, Peuhkurinen K,Nieminen MS, Laakso M, YläHerttuala S. Safety and feasibility of catheter-based localintracoronary vascular endothelial growth factor gene transfer in the prevention of postangioplasty and in-stent restenosis and in the treatment of chronic myocardial ischemia: Phase II results of the Kuopio Angiogenesis Trial(KAT). Circulation, 2003,107(21):2677~2683
10.Xie XY,Cao F,Sheikh AY,Li ZJ,Connolly AJ,Pei XT,Li RK, Robbins RC, Wu JC. Genetic modification of embryonicstem cellswith VEGF enhancescell survival and improves cardiac function.Cloning Stem Cells,2007,9(4):549~563
11.Zuk PA,Zhu M,Mizuno H,Huang JI,Futrell WJ,Katz AJ,Benhaim P,Lorenz HP,Hedrick MH.Multilineagecells from human adipose tissue: Implications forcell-based therapies.Tissue Eng,2001,7:211~226
12.OrlicD,Hill JM,Arai AE.Stem cellsfor myocardial regeneration.Circ Res,2002,91:1092~1102
13.Reinlib L,Field L.Cell transplantation as future therapy for cardiovascular disease?A workshop of the National Heart,Lung, and Blood Institute. Circulation, 2000, 101:E182~E187
14.Perin EC,Dohmann HF,Borojevic R,Silva SA,Sousa AL,Mesquita CT,Rossi MI,Carvalho AC,Dutra HS,Dohmann HJ, Silva GV, Belém L, Vivacqua R, RangelFO,Esporcatte R,Geng YJ,Vaughn WK,Assad JA,Mesquita ET, Willerson JT. Transendocardial, autologous bone marrow cell transplantation for severe, chronic ischemic heart failure.Circulation,2003,107:2294~2302
15.Zuk PA,Zhu M,Ashjian P,De Ugarte DA,Huang JI,Mizuno H,Alfonso ZC,Fraser JK,Benhaim P,Hedrick MH.Human adipose tissue is a source of multipotent stem cells.Mol Biol Cell,2002,13:4279~4295
16.Cao F,Lin S,Xie XY,Ray P,Patel M,Drukker M,Dylla SJ,Connolly AJ,Chen X,Weissman IL,Gambhir SS,Wu JC.In vivovisualization of embryonic stem cell survival,proliferation, and migration after cardiac delivery.Circulation,2006,113:1005~1014
17.MatsumotoR,OmuraT,YoshiyamaM,Hayashi T,Inamoto S,Koh KR,OhtaK,Izumi Y,NakamuraY,Akioka K,Kitaura Y,Takeuchi K,Yoshikawa J.Vascular endothelial growth factor-expressing mesenchymal stem cell transplantation for the treatment of acute myocardial infarction. Arterioscler Thromb Vasc Biol, 2005, 25(6):1168~1173
Molecular Imaging for Monitoring Survival and Proliferation of Adipose Derived Mesenchymal Stem Cellsin vitroandin vivoafter Pretreatment with VEGF
FAN Weiwei,WANG Yabin,ZHANG Rongqing,LI Congye,LI Shuang,CAO Feng
Department of Cardiology,Xijing Hospital,Fourth Military Medical University;
Molecular Imaging Center,Fourth Military Medical University,Xi'an 710032,China
This work was supported by grants from The National Natural Sciences Foundation of China(81090274,30970845)and Xijing Research Boosting Program on Stem Cell Research(XJZT08Z04)
Oct 20,2010 Accepted:Jan 17,2011
CAO Feng,Tel:+86(29)84771024,E-mail:wind8828@gmail.com
Although stem cell therapy holds promise for the regenerative treatment of ischemic heart disease,the tragic fate of engrafted stem cells is still a hurdle for the therapeutic effect.Previous studies showed that molecular imaging could be a realtime and quantitative effective approach to visualize and monitor stem cells,while vasoactive factors such as vascular endothelial growth factor(VEGF)may have protective effect on the stem cell.In this study,adipose tissue derived mesenchymal stem cells(ADMSCs),which stably expressed firefly luciferase gene,were cultured at the first step.Then bioluminescence imaging and other methods were used to visualize and quantify the ADMSCs'survival and proliferation,and confirmed whether VEGF pretreatment could affect the cells'viability.The results from bioluminescence imaging and quantitative analysis implied that VEGF pretreatment significantly enhanced the survival and proliferation of ADMSCs after hypoxia/reoxygenation injuryin vitro,and prolonged ADMSCs'lifetimein vivo.Eventually,it concluded that reporter genemolecular imaging could beadirect,efficient and noninvasive strategy for monitoring the MSCs'biological processin vitroandin vivo,while it could well evaluate the effect of protective factors,such as VEGF,on MSCs with high efficacy.
Molecular imaging;Mesenchymal stem cells;VEGF
2010-10-20;接受日期:2011-01-07
国家自然科学基金项目(81090274,30970845);西京医院助推计划重大项目(XJZT08Z04)
曹丰,电话:(029)84771024,E-mail:wind8828@gmail.com
Q421
10.3724/SP.J.1260.2011.00345
