稀土发光材料在荧光成像中的应用
2011-10-11吴伯岳严秀平
吴伯岳,严秀平
南开大学化学学院分析科学研究中心,天津 300071
稀土发光材料在荧光成像中的应用
吴伯岳,严秀平
南开大学化学学院分析科学研究中心,天津 300071
稀土发光材料由于具有荧光寿命长、发射峰半峰宽窄和Stokes位移大等发光性质,在生命科学研究的各个领域,包括荧光免疫分析、离子识别、蛋白质活性测定、核酸检测等,有着广泛而重要的应用前景。本文以稀土配合物、稀土掺杂上转换材料和长余辉材料为代表,就当前稀土发光材料的发光性质及其在生物成像标记方面的研究做一综述,并对稀土发光材料,特别是长余辉材料,在荧光成像应用过程中存在的主要问题进行了讨论。
稀土发光材料;荧光成像;稀土配合物;上转换材料;长余辉材料
引 言
随着医学和生命科学的发展,光学成像技术作为一种简单、快速、灵敏且低成本的手段,在疾病早期诊断和治疗等方面发挥着越来越重要的作用[1]。如何开发更加高效、多功能的荧光成像探针,同步观察细胞内多种生物活性物质的细胞定位、相互作用及其动态变化,以获得“细胞内的生命快照”,受到越来越多的关注[2]。
由于大多数生物活性分子没有天然荧光或荧光量子产率很低,因此对生物体内重要目标分子的实时动态监测必须借助外来的标记物,以便获得可测量的信号用来分析。理想的标记物应具有以下性质:1)光稳定性良好,不易被光解或漂白;2)对生物体本身功能没有影响或影响很小;3)发射光谱特性突出,特别是对多种组分标记后,在同一光源照射下(同一波长光激发下)可发射不同颜色的光,以便于对各种组分的区分;4)激发光范围可变,避免使用高能紫外光对生物组织的伤害[3]。目前,在生物成像研究中应用最普遍的荧光探针是有机荧光染料 (如异硫氰酸荧光素FITC及花菁染料cy3和cy5等)。有机荧光染料不仅光化学稳定性差,而且容易发生光漂白与光解,不利于较长时间的观察。此外,由于它们的激发光谱较窄且发射光谱较宽,不同的有机荧光分子常需要不同波长的光来激发。因此,如何对细胞内,特别是活细胞内的蛋白质分子进行实时、原位的动态监测,进而为蛋白质的研究提供活体全景式的技术平台,目前已成为国际上的研究热点和尚未解决的技术难点。
近年来,随着纳米技术、生物技术与材料制备技术的飞速发展,特别是对以物理学、化学、材料学等为基础发展起来的具有优异光学性质及水溶性和生物相容性的量子点制备技术的深入研究,量子点已广泛应用于各种生物分子的荧光检测,特别是为多种分子的同时实时动态检测提供了可能。目前的研究证实,半导体量子点的发光特性具有以下特点[4,5]:1)量子点的激发波长范围宽且连续分布,而发射波长的范围窄且分布对称,斯托克斯 (Stokes)位移大,不同半导体材料的量子点或同一材料不同粒径的量子点在同一光源照射下发射不同颜色的光,即发射光谱很少交叠;2)量子点荧光量子产率高,发光强度大,光化学稳定性好,不易被光解或漂白。量子点的这些光学特征十分适合于作为荧光成像探针。但是,现有量子点在拥有上述优点的同时也存在一定的问题:1)生物自身荧光干扰。作为生物标记物,大部分量子点的发光在可见光范围内,容易受到生物组织背景荧光的干扰,影响成像或检测的效果。2)量子点潜在的化学毒性。由于已知的量子点多数含有重金属离子,如Cd2+、Hg2+、Pb2+等,这些离子会在生物环境中缓慢地从量子点表面剥离,而现有的在量子点表面包覆无毒ZnS壳层的方法并不能长时间 (~24 h)地保护生物组织和避免细胞死亡[6,7]。这些性质都限制了量子点作为荧光探针在生物成像和荧光检测方面的应用。
稀土发光材料由于具有荧光寿命长、发射峰半峰宽窄和Stokes位移大等发光性质,引起了人们的重视与关注[8,9]。目前,由于稀土化合物优越的光学特性,该类荧光探针在生命科学研究的各个领域都已经得到广泛应用,包括荧光免疫分析[10~13]、阴阳离子识别[14~19]、蛋白质活性测定[20~24]、核酸检测[25~30]等。近年来,随着各种类型的水溶性稀土化合物的不断合成,稀土化合物荧光探针得到了更广泛的应用,尤其在荧光成像方面,越来越显示出它的优越性[31]。
稀土配合物在荧光成像领域的应用
稀土配合物的发光机理
稀土离子的发光是通过自旋禁阻的f-f跃迁而产生 (摩尔吸光系数<10 l/mol·cm)的,而且与稀土离子配位的水分子的高频O-H振动能够淬灭其发光。因此在溶液中,稀土离子Sm3+、Eu3+、Tb3+、Dy3+等在高能量激发下本身虽然会发射荧光,但是非常微弱。然而,当它们与一些有机配位体 (如β-二酮类、芳香羧酸衍生物类)形成配合物时,其荧光强度就会明显地增强。
稀土配合物的发光是配体向稀土离子能量转移的结果,其发光是由稀土离子本身所决定的[32]。稀土配合物的荧光产生过程如下:当稀土配合物受到光激发时,有机配体分子首先吸收能量,从单重态的基态S0跃迁至激发态S1,随后激发态可以通过辐射方式回到基态S0,也可以通过非辐射方式传递给三重态的激发态T1或T2;三重态的激发能以非辐射方式将能量传递给稀土离子,或者通过辐射方式失去能量回到基态,从而发出磷光;处于激发态的稀土离子的能量跃迁也有两种方式,以非辐射方式或者辐射方式跃迁到较低的能态再到基态,当以辐射方式从高能态跃迁到较低能态时就产生了荧光[32]。图1为稀土配合物发光机理示意图。稀土离子荧光的发射取决于配体的三重激发态T1能级的位置,及其与稀土离子激发态的能量匹配程度。
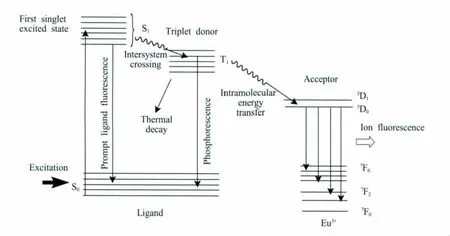
图1 稀土(铕)配合物发光机理[32]当稀土配合物受到紫外线照射时,有机配体的电子激发到第一激发单重态 (S1)的振动能级。配合物分子经历快速分子内转换,如通过与溶剂分子的相互作用,跃迁到S1的较低振动能级。处于S1的电子可以经辐射跃迁回到基态 (S0),也可以经非辐射由单重态S1到三重态T1。处于三重态T1的电子可以通过自旋禁阻跃迁回到基态,并发射分子磷光。除此之外,配合物分子也可从三重态T1经非辐射方式跃迁到稀土离子的激发态。经这种分子内能量转移的间接激发后,处于稀土离子激发态的电子会以辐射跃迁到较低的4f能级,并产生稀土离子的特征光谱,或以非辐射跃迁方式回到基态Fig.1 Schematic diagram for the radiative processes of the chelate leading to Eu3+fluorescence[32] Upon irradiation with ultraviolet radiation,the organic ligands of the lanthanide complex are excited to a vibrational level of the first excited singlet state.The molecule undergoes fast internal conversion to lower vibrational levels of the S1state,for instance,through interaction with solvent molecules.The excited singlet state can be deactived radiatively to the ground state or can undergo nonradiative intersystem crossing from the singlet state S1to the triplet state T1.The triplet state T1can be deactivated radiatively to the ground state,by the spinforbidden transition.This results in molecular phosphorescence.Alternatively,the complex may undergo a nonradiative transition from the triplet state to an excited state of the lanthanide ion.After this indirect excitation by energy transfer,the lanthanide ion may undergo a radiative transition to a lower 4f state by characteristic line-like photoluminescence or may be deactivated by nonradiative processes
稀土配合物的发光特点
由于稀土配合物具有特殊的发光机理,因此,其荧光与罗丹明荧光素等常见的有机染料分子相比具有以下不同的特点[33]:1)稀土配合物的荧光发射波长与中心的稀土离子有关,而与配体的具体结构关系不大。配体的作用是吸收激发光的能量并将能量转移给稀土离子。因此,同一种稀土离子无论与何种配体络合,荧光发射峰的形状和发射波长是基本不变的;2)稀土配合物荧光的Stokes位移 (最大吸收峰与最大发射峰之间的波长差)比较大,一般在200 nm以上。该特点有利于进行波长的分辨,同时也有利于避免因激发光而导致的散射光对荧光测定的干扰;3)稀土配合物的荧光发射峰较窄,半峰宽一般在10~15 nm左右,这一特点有利于提高分析测定的灵敏度和选择性;4)由于稀土配合物所产生的荧光是延迟荧光,其荧光寿命比较长 (约1 ms),是通常生物背景荧光寿命的105~106倍。利用这种长寿命的荧光,可进行时间分辨荧光显微成像测定和荧光寿命成像,从而有效避免背景荧光的干扰,提高测定灵敏度。
细胞内小分子物质的成像分析
细胞内的小分子,包括各种活性氧分子 (单线态氧1O2、过氧化氢H2O2、超氧负离子自由基O2-等)和金属离子 (如Zn2+、Cu2+、Mg2+和Ca2+等),调控着细胞的代谢与功能,因此在细胞内起着非常重要的作用[34]。实现活体细胞内各种生物活性小分子和离子的实时在线动态检测,对生命科学研究与发展具有重要的价值。
Song等[35,36]分别以蒽环和甲基蒽作为单线态氧的选择性识别基团,以三吡啶的羧酸衍生物为配体设计了两种基于铕的配合物探针 (ATTA-Eu3+和MTTA-Eu3+),并将MTTA-Eu3+探针成功用于HeLa细胞内单线态氧的成像。在此基础上,该研究组又将原来的三吡啶配体改为两个吡唑连接一个吡啶,设计了铽的探针 (PATA-Tb3+),同样利用蒽环来识别单线态氧[37]。该研究组还设计了铽/铕共掺杂型的时间分辨荧光探针 〔Eu3+/Tb3+(DTTA)〕,并用于细胞内过氧亚硝酸根识别及成像测定[38]。该探针基于同一激发条件下两种稀土粒子各自发射不同颜色荧光的特点 (铽离子为蓝色/铕离子为红色),以及过氧亚硝酸根对铽离子荧光的选择性淬灭,通过探针的颜色变化 (由蓝变红)指示细胞中的过氧亚硝酸根浓度。
Zn2+是生物体内必需的金属离子,它的新陈代谢紊乱会引起诸多疾病。因此,细胞内Zn2+的检测也是人们研究的热点。Ye等[39]设计了以铽离子为中心离子的稀土配合物,合成了针对Zn2+的探针 (BBATA-Tb3+),同样应用于HeLa细胞内Zn2+的成像分析。与之类似,Hanaoka等[40]设计了一种以稀土铕离子为中心离子、二乙基三胺五乙酸 (DTPA)为配体的稀土配合物,并在此基础上接枝Zn2+螯合基团双 (2-吡啶甲基)胺来制备Zn2+探针 (Eu-7),并将其用于HeLa细胞内Zn2+的成像分析 (图2)。随后,该研究组又设计了一种新型的铕、铽共掺杂的时间分辨荧光成像体系以提高检测灵敏度,并利用此成像系统成功实现了探针Eu-7在HeLa细胞内针对Zn2+的时间分辨荧光成像[41]。该成像体系一方面利用稀土铕荧光寿命长的特点有效消除细胞内背景荧光的干扰,另一方面,在同一激发光下可以实现铕、铽两种稀土配合物的双色成像,为实现细胞内小分子物质的实时原位动态测定提供了新的途径。

图2 HeLa细胞内Zn2+浓度的时间分辨荧光成像结果[40]测试所用激发光谱在(360±40)nm,发射光谱在(617±37)nm,间隔时间为30 s。时间分辨荧光成像由时间分辨长寿命发光显微镜系统(TRLLM)完成,弛豫时间为 70 μs,光路开启时间为808 μs。将HeLa细胞用HBSS清洗两次,随后分散在HBSS缓冲液中。将[Eu-7]溶解于HBSS缓冲液中,使用Eppendorf注射系统 (Transjector 5246)注射到HeLa细胞中。(A)0 min的明场照片;(B)0 min的时间分辨荧光照片;(C)5 min的时间分辨荧光照片 (向体系中加入5 μmol/L 吡啶硫酮以及 50 μmol/L ZnSO43 min 后);(D)10 min 的时间分辨荧光照片 (向体系中加入100 μmol/L TPEN 7.5 min后);(E)(B~D)所对应的发光强度变化曲线Fig.2 Bright-field transmission and luminescence images of Zn2+in [Eu-7]-injected HeLa cells in HBSS buffer[40] The luminescence at(617±37)nm,excited at(360±40)nm,was measured at 30 s intervals.The cells were then washed with HBSS buffer and injected with[Eu-7]solution with an Eppendorf injection system(Transjector 5246). (A) Bright-field transmission image(0 min);(B)Luminescence image of(A)(0 min);(C)Luminescence image(5 min) following an addition of50 μmol/L pyrithione (zinc ionophore) and 150 μmol/L ZnSO4to themedium at3 min;(D)Luminescence image (10 min) following an addition of 150 μmol/L TPEN to the medium at 7.5 min.(E)Luminescence images(B~D)correspond to the luminescence intensity data,which shows the average intensity of the corresponding area or cell area(1,extracellular region;2,intracellular region of the injected cell;3,4,intracellular regions of noninjected cells)
生物大分子的成像分析
稀土配合物荧光探针除了用于细胞内小分子的成像分析,在生物大分子的测定分析方面应用也非常广泛。Vaisanen等[42]以铕的螯合物作为荧光标记物,采用时间分辨荧光成像方法实现了对单个前列腺特异抗原分子的可视化检测。Connally等[43]报道了利用时间分辨荧光显微镜成像技术检测浓缩水样中的病源微生物Cryptosporidium和Giardia。他们首先将BHHST-Eu3+配合物分别标记上抗Cryptosporidium单抗和羊抗鼠二次抗体,然后分别与浓缩水样中的Cryptosporidium和经单抗预处理过的Giardia共同孵育,最后进行时间分辨荧光成像检测。结果显示,水样中杂质的强背景荧光被完全消除,检测信噪比提高了10倍。Wu[44]和Jiang[45]等对BHHST-Eu3+化合物进行了改进,使所得到的时间分辨荧光探针可以在可见光波段激发,从而减少了激发光源的高能量对样品的潜在伤害,拓展了该类探针的适用范围,并成功地用于水样中Giardia lamblia、Cryptosporidium muris及Cryptosporidium parvium的成像测定。
细胞标记成像
作为细胞内的成像探针,必须满足以下条件:1)良好的水溶性;2)在生理条件下具有良好的化学稳定性;3)良好的膜穿透性和较低的细胞毒性;4)有较低的激发能量和较高的荧光量子产率。
Yu等[46]设计了一种以1-氮杂硫代呫吨酮为配体的铕离子稀土配合物,成功地对NIH-3T3(小鼠成纤维细胞)的活细胞和固定后的细胞进行了荧光显微成像,通过细胞存活实验,对探针的毒性进行了验证。共定位实验也证明了该探针对细胞核的选择性。在此探针基础上,他们又通过改变配体上的取代基设计了一种pH荧光探针,并应用于NIH-3T3细胞的荧光成像[47]。
由于双光子荧光显微成像所具有的低能量激发、避免光漂白、降低组织自发荧光及暗场成像等诸多特点,除了具有单一稀土元素的配合物探针在活细胞内成像的应用,具有双光子荧光性质的稀土配合物探针也在逐步应用到细胞的成像分析中[48,49]。Picot等[50]以带有聚乙烯基乙二醇链的烷氧基苯乙炔修饰的吡啶二羧酸 (配体L)合成了双光子激发的水溶性铕配合物[Na]3[Eu(L)3],并将其应用于人膀胱癌T24细胞的双光子激发显微成像。从细胞图片可明显看出配合物分布在细胞核的周围,其分布同内质网的分布相似。这一研究为设计能够实时动态检测细胞内不同物质的探针提供了强有力的支持。最近,Lam等[51]合成了可用于三光子显微成像的铽配合物探针[TbL(NO3)3](其中L为带有甲氧基苯胺的配体),并将其成功用于A549细胞 (人肺癌细胞)、HONE1细胞 (人鼻咽癌细胞)及HeLa细胞的成像分析(图 3)。

图3 人类肺癌细胞A549(A)和人类宫颈癌细胞HeLa(B)的三光子共聚焦荧光显微照片[51]测试前将上述细胞浸润在Tb3+配合物溶液(含有20 μg/mL培养基)中1 h;测试的激发光波长为800 nm,图中显示的为Tb3+在480 nm的绿色荧光Fig.3 Three-photon confocalfluorescent microscopy images of human lung carcinoma A549(A)and human cervical carcinoma HeLa cells (B)[51] The cellswere exposed to the terbium complexes for 1 h before the imaging experiment(20 μg/mL in thegrowth medium,λex=800 nm,filter band-pass for emission 480~615 nm),showing the Tb3+emission above 480 nm(green)
稀土掺杂的上转换材料在荧光成像领域的应用
稀土上转换荧光纳米粒子
稀土上转换荧光辐射是指利用掺杂于固体晶格的稀土离子,将两个或两个以上的低能量 (长波长)光子叠加并转变为一个高能量 (短波长)光子的过程[52]。该类材料通常由基质和激活剂组成。基质一般是稀土化合物或碱土金属化合物组成的绝缘体,激活剂一般是微量掺杂的一种或多种稀土离子。通常所说的上转换荧光指的是在红外光激发下能发出波长在可见和紫外区域的光子的荧光辐射。
稀土上转换纳米粒子是一种具有典型的高转换效率的多光子荧光探针,同时具备了稀土离子上转换发光的特性和纳米尺度对生物体低损伤的特性。它的激发光源一般在红外区域,有效地避免了紫外激发对细胞或组织长时间照射造成伤害的问题[53]。另外,大部分生物分子对红外光几乎没有吸收,因而利用它可以实现深层生物组织的无背景高灵敏度探测[54]。与先进的双光子量子点相比,上转换荧光纳米粒子具有更高的荧光发射效率,如NaYF4:Yb3+/Er3+上转换纳米粒子比目前最好的双光子量子点的效率要高107倍[55]。同时,与双光子量子点不同,利用商用便宜的连续发光二极管红外激光器,就可以实现强的上转换发光。这一优点极大地推动了上转换纳米粒子的广泛应用。此外,上转换纳米粒子发射的谱带很窄,其半峰宽可以跟量子点相比,且通过掺杂不同的稀土离子,可以像量子点一样实现多色发射 (图4)。

图4 上转换纳米粒子发光(如箭头所示)照片 〔DMSO为溶剂,1 wt%,使用激发波长为 974 nm(10270 cm-1)、功率为5.9 kW/cm的激光作为激发源〕[55](A)NaYF4:20%Yb3+/2%Er3+样品的上转换荧光照片;(B,C)上述样品分别在红色和绿色滤光片下的发光照片;(D)NaYF4:20%Yb3+/2%Tm3+样品的上转换荧光照片Fig.4 Photographs ofthe UC luminescence in 1 wt% colloidal solutions of nanocrystals in dimethyl sulfoxide(DMSO)excited at 10270 cm-1with a laser powerintensity of5.9 kW/cm[55] (A) TotalUC luminescence of the NaYF4:Yb/Er(20/2 mol%)sample;(B,C) The same luminescence through red and green color filters,respectively;(D)Total UC luminescence of the NaYF4:Yb/Tm(20/2 mol%)sample
稀土上转换荧光纳米粒子在细胞与组织成像中的应用
荧光成像由于其时间和空间分辨率较高,已经成为临床应用和生物研究中非常重要的技术[56]。传统的荧光成像都是基于紫外光激发,但是长时间的紫外光照射会对DNA造成伤害或引起细胞死亡,同时生物组织本身在紫外激发下会产生明显的自身荧光而导致检测灵敏度降低[57]。上转换荧光纳米材料采用长波长激发,发射出短波长辐射,对组织伤害小,产生的自发荧光弱,而且可以渗入到组织内较深的部位[58]。另外,就上转换荧光纳米材料自身而言,其晶体基质中掺杂的稀土元素的毒性也较低[59,60]。上转换纳米材料的优异特性,使其在细胞与活体标记方面的应用逐渐引起人们的关注。
Zijlmans等[61]采用有机染料和亚微米量级上转换荧光颗粒,对前列腺组织切片进行了标记,并对比了染色后的图像。对比实验结果表明,上转换荧光颗粒标记前列腺组织的图像没有生物组织的背景荧光干扰,很容易辨别组织的分布及形状,而有机染料标记的组织有很强的自体荧光。Wang等[62]将溶剂热法合成的NaYF4:Yb3+/Er3+纳米粒子经表面修饰后应用于HeLa细胞的免疫标记与成像。原理是:修饰后纳米粒子表面的氨基在活化剂的作用下与CEAS抗体结合,利用CEAS抗体与细胞表面抗原的免疫反应就可实现对HeLa细胞的标记与成像。实验中详细考察了纳米粒子对细胞的毒性作用,发现孵育12 h后细胞的状态仍然很好,而且随着孵育时间的延长,标记效果也更好。
稀土上转换荧光纳米粒子在活体成像中的应用
Lim等[63]利用所合成的Y2O3:Yb3+/Er3+纳米粒子成功地进行了线虫的标记,标记后的线虫在荧光显微镜下体内发出明显的绿色荧光 (图5)。同时,线虫的扫描电镜表征也证明了线虫内部纳米粒子的存在。

图5 C.elegans线虫双光子成像结果[63] 所用仪器为含有20×物镜(Nikon,Melville,NY)和增强型 CCD相机 (Princeton Instruments,Trenton,NJ)的荧光倒置显微镜。线虫的表面荧光成像中使用了20 W红外LED激光阵列以及定制的荧光滤光镜 (Chroma technology,Rockingham,VT)。绿色为上转换纳米粒子发光,红色为背景光。线虫在饥饿处理 0 h(A)、4 h(B)和24 h(C)后,形态并未出现显著性差异Fig.5 Falsecolor two-photon imagesofC.elegansat 980 nm excitation with red representing the bright field and green for the phosphor emission[63] Imaging of the C. elegans by upconversion luminescence with IR excitation was performed using a inverted microscope with a 20×,0.4 NA microscope objective(Nikon,Melville,NY),coupled to an intensified CCD camera(Princeton Instruments,Trenton,NJ).The worms were imaged by a custom-made fluorescence filter set(Chroma technology,Rockingham,VT),and a 20-W infrared LED laser array.The worms were deprived of food over a period of 24 h,showing little or no change at 0 h(A),4 h(B),and 24 h(C)
Chatterjee等[64]首次将上转换纳米粒子应用于动物深处组织的荧光成像 (图6)。该研究组利用聚乙烯亚胺 (polyethyleneimine,PEI)在NaYF4:Yb3+/Er3+纳米粒子表面修饰氨基。合成好的PEI-NaYF4:Yb3+/Er3+纳米粒子首先应用于HT29细胞株 (人类结肠癌)和OVCAR3细胞株(卵巢癌)的标记,并同时进行细胞存活率试验。在证明该纳米粒子具有化学稳定性好、生物毒性低等优点后,将其注入小鼠体内成像,并同时以量子点作为对比。结果表明,上转换纳米材料的荧光强度与穿透力都优于量子点。
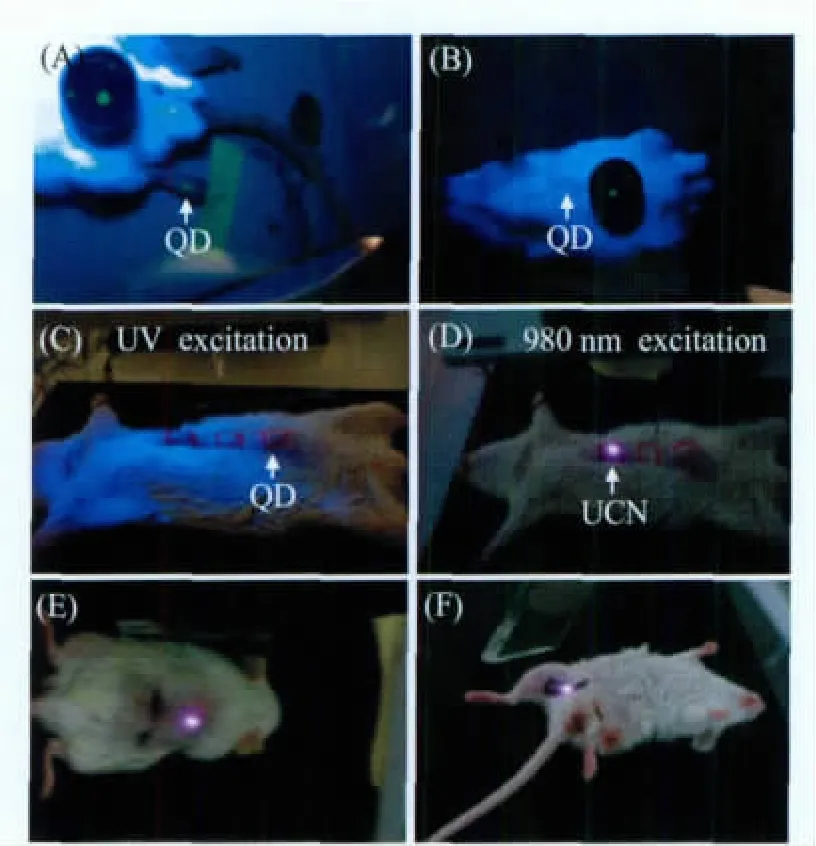
图6 NaYF4:Yb/Er上转换纳米粒子(UCN)与量子点(QD)小鼠成像结果[64]分别向麻醉过的Wistar大鼠腹股沟、背部和腹部的皮下注射100 ml的PEI/NaYF4:Yb/Er(4.4 mg/mL)和QD溶液。用980 nm的VA-II型全固态半导体 (DPSS)激光器 (当前设置1.0 A)作为激发源,于暗室内观察发光情况,并使用CCD数码相机 (Sony)成像 (使用滤热器消除近红外散射)。通过注射针刺入深度估计注射深度。足部浅表皮肤荧光成像结果:透过(A),未透过(B);QD(C)与UCN(D)腹部荧光透射结果;UCN小鼠背部(E)与腿部(F)深层组织成像结果Fig.6 In vivo UCN and QD imaging of rat[64] Wistar rats were anaesthetized and fur was clipped at the groin,back,and abdomen;100 ml of PEI/NaYF4:Yb/Er nanoparticles(4.4 mg/mL) and QD was injected subcutaneously at these regions in different animals.Luminescence was observed in a darkened room by excitation with a 980 nm VA-II DPSS laser(current set 1.0 A)and recorded using CCD based digital camera(Sony)with heat filters to eliminate NIR scatter.The depth of injection was estimated from needle penetration.The rat which injected with quantum dots shows fluorescence through the translucent skin of the foot(A)and,but not through the thicker back skin(B)or abdomen(C).NaYF4:Yb/Er nanoparticles injected below abdominalskin (D), thigh muscles(E), orback skin (F) show luminescence.Quantum dots on a black disk in(A,B)are used as the control
Jalil等[65]合成了粒径为30 nm左右的不同稀土掺杂的NaYF4纳米粒子,并在纳米粒子表面没有接枝选择性基团的情况下,将其直接应用于细胞和活体的实验。实验结果表明,细胞成像具有很高的信噪比,活体生物成像深度可达1 cm。
Kumar等[66]在有机相中合成了以NaYF4为基质,Eu3+、Er3+、Yb3+、Gd3+为共掺杂剂,兼具上转换荧光和顺磁共振成像能力的纳米粒子,将其表面进行肿瘤特异性抗体功能化后应用于癌细胞成像实验。此探针不仅对癌细胞具有很高的特异性识别能力,而且具有很好的细胞相容性。
长余辉发光材料在荧光成像和传感中的应用
长余辉发光是一种光致发光现象,是指在激发光停止照射后物质仍能够持续发光的现象。长余辉发光材料不含有毒重金属元素,可以在检测和成像前激发,在免激发条件下实现生物传感和成像,因而有效避免了原位激发产生的背景干扰。尽管长余辉发光材料拥有量子点所不具备的优点,但直至最近才有将长余辉材料应用于生物传感和成像的报道。Chermont等[67]利用溶胶-凝胶方法高温合成了具有近红外荧光的硅酸盐长余辉纳米材料,并将其应用于小鼠体内成像 (图7)。该方法成功地避免了传统荧光分析方法中激发光源对生物体的潜在伤害,首次实现了生物体内的“免激发”荧光成像。最近,我们课题组合成了聚乙烯亚胺包覆的Eu和Dy掺杂Ca1.86Mg0.14ZnSi2O7长余辉发光纳米材料,并与甲胎蛋白(alfa-fetoprotein,AFP)抗体功能化的金纳米粒子复合构成有效的能量共振转移体系。该纳米复合物可以在免激发的条件下高灵敏和高选择性地检测血清中的AFP,并可视化监测肝癌细胞生长过程中释放的AFP[68]。
限制长余辉发光材料在生物传感和成像中应用的主要因素有:1)传统的合成方法对反应条件要求较高。无论高温固相法、溶胶-凝胶法还是共沉淀方法,都需要高于1000℃的高温煅烧,且需要弱还原气氛。这对设备的要求较高,增加合成成本。2)材料的分散性较差。由于材料是硅酸盐基质的,特别是高温煅烧的产品普遍颗粒较大、交联度高,因而造成长余辉材料在水中的分散性较差,限制了其在生物体系中的应用。3)表面功能化难度较大。传统合成方法得到的硅酸盐材料表面几乎没有官能团,因此进一步表面修饰以及高选择性、高效率的生物活性分子 (如抗体、酶等)的接枝比较困难。4)对目标物的响应较差。由于长余辉材料本身的化学稳定性较高,其荧光强度不易受到其他化学物质的影响,这在降低了样品中共存物对荧光干扰的同时,造成其对分析物浓度的变化不敏感,影响其在荧光传感领域的应用。因此,研究简单、快速地制备硅酸盐长余辉材料的方法,通过制备和后修饰等方法增加材料的生物相容性,以及通过荧光共振能量转移等手段提高材料对分析物的选择性响应,是这类材料在生物分析和成像领域发展的必由之路。
结论与展望
综上所述,稀土化合物荧光探针由于具有荧光寿命长、发射峰半峰宽窄和Stokes位移大等发光性质,得到了越来越广泛的应用。特别是纳米技术与材料科学的发展,有效地弥补了传统稀土发光材料自身所存在的不足,为其在荧光检测与成像领域的应用打下了基础。
随着荧光标记领域研究的日益深入,如何提高稀土发光材料的生物相容性及对标记物的敏感性与特异性,同时充分利用稀土发光材料自身所特有的化学稳定性及荧光的高效性等多方面的特点,将是今后努力的方向。尽管在应用中存在着这些难点,稀土发光材料作为一类新的荧光标记物,将会对细胞生物学、光学成像及医学领域产生深远的影响。与先进光学成像技术的结合,将使得实时、动态监测细胞内和生物活体内的分子活动成为可能,为揭示生命活动规律及研究疾病的发生、诊断、治疗提供新技术和新方法,促进医学和生命科学的发展。
1. Klostranec JM,Chan WCW.Quantum dots in bioloigical and biomedical research: Recentprogress and present challenges.Adv Mater,2006,18(15):1953~1964
2. Smith AM,Gao X.Multicolor quantum dots for molecular diagnostic of cancer.Expert Rev Mol Diagn,2006,6(2):231~244
3. MedintzIL, UyedaHT, Goldman ER, Mattoussi H.Quantum dotbioconjugates forimaging, labelling and sensing.Nat Mater,2005,4(6):435~446
4. Tang B,Huang H.Highly sensitiveand selectivenearinfrared probe for zinc and its application to macrophage cells.Chem Comm,2006,34:3609~3611
5. Kim S,Lim YT.Near-infrared fluorescent type II quantum dots for sentinel lymph node mapping. Nat Biotechnol,2004,22(1):93~97
6. Chan WH,Shao NH,Lu PZ.CdSe quantum dots induce apoptosis in human neuroblastoma cells via mitochondrialdependent pathways and inhibition of survival signals.Toxic Lett,2006,167(3):191~200
7. Kirchner C,Liedl T,Kudera S,Pellegrino T,Munoz JA,Gaub HE.Cytotoxicity of colloidal CdSeand CdSe/ZnS nanoparticles.Nano Lett,2005,5(2):331~338
8. Escribano P,Julián-López B,Planelles-Aragó J,Cordoncillo E,VianaB,Sanchez C.Photonic and nanobiophotonic properties of luminescent lanthanide-doped hybrid organicinorganic materials.J Mater Chem,2008,18(1):23~40
9. Bünzli J-CG,Comby S,Chauvin AS,Vandevyver CDB.New opportunities for lanthanide luminescence.Biomaterials,2007,25(3):714~729
10.Hemmil I,MukkalaVM. Time-resolution influorometry technologies, labels, and applications in bioanalytical assays.Crit Rev Clin Lab Sci,2001,38(6):441~519
11.Butcher H,Kennette W,Collins O,Demoor J,Koropatnick JA. Sensitive time-resolved fluorescent immunoassay for metallothionein protein. J ImmunolMethods, 2003,272(1-2):247~256
12.Charbonnière LJ,Hildebrandt N,Ziessel RF,Löhmannsröben HG. Lanthanides to quantum dots resonance energy transfer in time-resolved fluoro-immunoassays and luminescence microscopy.J Am Chem Soc,2006,128(39):12800~12809
13.Kimura H,Mukaida M,Watanabe M,Hashino K,Nishioka T,TominoY,YoshidaKI,MatsumotoK.Quantitative evaluation of time-resolved fluorescence microscopy using a new europium label: Application to immunofluorescence imaging of nitrotyrosine in kidneys.Anal Biochem,2008,372(1):119~121
14.Montalti M,Prodi L,Zaccheroni N,Charbonnière LJ,Douce L, Ziessel RA. Luminescent anion sensor based on a europium hybrid complex.J Am Chem Soc,2001,123(50):12694~12695
15.Yamada T,Shinoda S,Tsukube H.Anion sensing with luminescentlanthanide complexes of tris(2-pyridylmethyl)amines:Pronounced effects of lanthanide center and ligand chirality on anion selectivity and sensitivity.Chem Commun,2002,11:1218~1219
16.Gunnlaugsson T,Leonard JP.H+,Na+and K+modulated lanthanide luminescent switching of Tb(III) based cyclen aromatic diaza-crown etherconjugates in water. Chem Commun,2003,19:2424~2425
17.Li C,Law GL,Wong WT.Luminescent Tb3+complex with pendant crown ether showing dual-component recognition of H+and K+at multiplepH windows.Org Lett,2004,6(26):4841~4844
18. ZiesselR, Charbonnière LJ. Lanthanide probes for luminescence microscopy and anion sensing. J Alloy Compd,2004,374(1-2):283~288
19.Thibon A,Pierre VA.Highly selective luminescent sensor for the time-gated detection of potassium. JAm Chem Soc,2009,131(2):434~435
20.Wu M,Lin ZH,Schäferling M,Dürkop A,Wolfbeis OS.Fluorescence imaging of the activity of glucose oxidase using a hydrogen-peroxide-sensitive europium probe.Anal Biochem,2005,340(1):66~73
21.Terai T,Kikuchi K,Iwasawa SY,Kawabe T,Hirata Y,Urano Y,Nagano T.Modulation of luminescence intensity of lanthanide complexes by photoinduced electron transfer and its application to a long-lived protease Probe.J Am Chem Soc,2006,128(21):6938~6946
22.Schäferling M,Wolfbeis OS.Europium tetracycline as a luminescent probe for nucleoside phosphates and its application to the determination of kinase activity. Chem Eur J,2007,13(15):4342~4349
23.Schrenkhammer P,Rosnizeck IC,Duerkop A,Wolfbeis OS,Schäferling M.Time-resolved fluorescence-based assay for the determination of alkaline phosphatase activity and application to the screening of its inhibitors. J Biomol Screen,2008,13(1):9~16
24.Duerkop A,Aleksandrova D,Scripinets Y,Yegorova A,Vityukova E. Sensitive terbium probes forluminescent determination of both alkaline phosphatase and codeine phosphate.Ann N Y Acad Sci,2008,1130:172~178
25.BobbaG,FriasJC,Parker D.Highly emissive,ninecoordinate enantiopure lanthanide complexesincorporating tetraazatriphenylenes as probes for DNA.Chem Commun,2002,8:890~891
26.Johansson MK,Cook RM,Xu J,Raymond KN.Time gating improves sensitivity in energy transfer assayswith terbium chelate/dark quencher oligonucleotide probes.J Am Chem Soc,2004,126(50):16451~16455
27. Yegorova A, KarasyovA, Duerkop A, UkrainetsI,Antonovich V.New luminescent terbium complex for the determination of DNA.Spectrochimica Acta Part A:Molecul Biomolecul Spectro,2005,61(1-2):109~116
28.Nishioka T,Yuan JL,Yamamoto YJ,Sumitomo K,Wang Z,Hashino K,Hosoya C,Ikawa K,Wang GL,Matsumoto K. New luminescenteuropium (III) chelates forDNA labeling.Inorg Chem,2006,45(10):4088~4096
29.Hashino K,IkawaK,Ito M,HosoyaC,NishiokaT,Makiuchi M,Matsumoto K.Application of a fluorescent lanthanide chelate label on a solid supportdevice for detecting DNA variation with ligation-based assay. Anal Biochem,2007,364(1):89~91
30.Laitala V,Ylikoski A,Raussi HM,Ollikka P,Hemmilä I.Time-resolved detection probe forhomogeneous nucleic acid analysesin one-step format.Anal Biochem,2007,361(1):126~131
31. BünzliJCG. Lanthanide luminescence forbiomedical analyses and imaging. Chem Rev, 2010, 110(5):2729~2755
32. SoiniE, Lövgren T, Reimer CB. Time-resolved fluorescence of lanthanide probes and applications in biotechnology. Critic Rev AnalChem, 1987, 18(2):1547~6510
33. Hemmilä I, Laitala V. Progress in lanthanides as luminescent probes.J Fluoresc,2005,15(4):529~542
34.Scurlock RD,Wang B,Ogilby PR,Sheats JR,Clough RL.Singlet oxygen as a reactive intermediate in the photodegradation of an electroluminescent polymer.J Am Chem Soc,1995,117(41):10194~10202
35.Song B,Wang GL,Tan MQ,Yuan JL.A europium(III)complex as an efficient singlet oxygen luminescence probe.J Am Chem Soc,2006,128(41):13442~13450
36. Song B, Wang GL, Yuan JL. A new europium chelate-based phosphorescence probe specific for singlet oxygen.Chem Commun,2005,28:3553~3555
37.Tan MQ,Song B,Wang GL,Yuan JL.A new terbium(III)chelate as an efficient singlet oxygen fluorescence probe.Free Radical Bio Med,2006,40(9):1644~1653
38.Song CH,Ye ZQ,Wang GL,Yuan JL,Guan YF.A lanthanide complex-based ratiometric luminescent probe specific for peroxynitrite. Chem Eur J, 2010, 16(22):6464~6472
39.Ye ZQ,Wang GL,Chen JX,Fu XY,Zhang WZ,Yuan JL.Development of a novel terbium chelate-based luminescent chemosensor for time-resolved luminescence detection of intracellular Zn2+ions.Biosens Bioelectron,2010,26(3):1043~1048
40.Hanaoka K,Kikuchi K,Kojima H,Urano Y,Nagano T.Development of a zinc ion-selective luminescent lanthanide chemosensor for biological applications.J Am Chem Soc,2004,126(39):12470~12476
41. Hanaoka K, KikuchiK, KobayashiS, Nagano T.Time-resolved long-lived luminescence imaging method employing luminescent lanthanide probes with a new microscopy system.JAm Chem Soc,2007,129(44):13502~13509
42.Vaisanen V,Harma H,Lilja H,Bjartell A.Time-resolved fluorescence imaging for quantitative histochemistry using lanthanide chelates in nanoparticles and conjugated to monoclonalantibodies. Luminescence, 2000, 15(6):389~397
43.Connally R,Veal D,Piper J.Time-resolved fluorescence microscopy using an improved europium chelateBHHST for the in situ detection ofCryptosporidium and Giardia.Microsc Res Tech,2004,64(4):312~322
44.Wu J,Ye ZQ,Wang GL,Jin DY,Yuan JL,Guan YF,Pipe J.Visible-light-sensitized highly luminescent europium nanoparticles: Preparation and application for time-gated luminescencebioimaging.JMater Chem,2009,19(9):1258~1264
45.Jiang LN,Wu J,Wang GL,Ye ZQ,Zhang WZ,Jin DY,Yuan JL,Piper J.Development of a visible-light-sensitized europium complex for time-resolved fluorometric application.Anal Chem,2010,82(6):2529~2535
46.Yu JH,Parker D,Pal R,Poole RA,Cann MJ.A europium complex thatselectively stains nucleoli of cells. J Am Chem Soc,2006,128(7):2294~2299
47.Pal R,Parker D.A single component ratiometric pH probe with long wavelength excitation ofeuropium emission.Chem Commun,2007,5:474~476
48.Bünzli JCG,Chauvin AS,Vandevyver CDB,Song B,Comby S. Lanthanide bimetallic helicates for in vitro imaging and sensing.Ann N Y Acad Sci,2008,1130:97~105
49.黄池宝,樊江莉,彭孝军,孙世国.双光子荧光探针研究及其应用.化学进展,2007,19(11):1806~1812 Huang CB,Fan JL,Peng XJ,Sun SG.Progress and application of two-photon fluorescent probes.Prog Chem,2007,19(11):1806~1812
50.Picot A,D'Aléo A,Baldeck PL,Grichine A,Duperray A,Andraud C, Maury O. Long-lived two-photon excited luminescence of water-soluble europium complex:Applications in biological imaging using two-photon scanning microscopy.J Am Chem Soc,2008,130(5):1532~1533
51.Law GL,Wong KL,Man CWY,Wong WT,Tsao SW,Lam MHW,Lam PKS.Emissive terbium probe for multiphoton in vitrocell imaging.J Am Chem Soc,2008,130(12):3714~3715
52.Auzel F.Upconversion and anti-stokes processeswith f and d ions in solids.Chem Rev,2004,104(1):139~173
53.Chen GY,Zhang YG,Somesfalean G,Zhang ZG,Sun Q,Wang FP.Two-color upconversion in rare-earth-ion-doped ZrO2nanocrystals. Appl Phys Lett, 2006, 89:163105~163107
54.Sivakumar S,DiamentePR,van Veggel FCJM.Silicacoated Ln3+-doped LaF3nanoparticlesasRobus t down-and upconverting biolabels. Chem EurJ, 2006, 12(22):5878~5884
55.Heer S,Kömpe K,Güdel HU,Haase M.Highly efficient multicolour upconversion emission in transparent colloids of lanthanide-doped NaYF4nanocrystals.Adv Mater,2004,16(23-24):2102~2105
56.Chen GY,Somesfalen G,Zhang ZG,Sun Q,Wang FP.Ultraviolet upconversion fluorescence in rare-earth-ion-doped Y2O3induced by infrared diode laser excitation.Opt Lett,2007,32(1):87~89
57.Altinogˇlu EI,Russin TJ,Kaiser JM,Barth BM,Eklund PC,Kester M, Adair JH. Near-infrared emitting fluorophoredoped calcium phosphate nanoparticles forin vivoimaging of human breastcancer. ACS Nano, 2008, 2(10):2075~2084
58.Vetrone F,Boyer JC,Capobianco JA,Speghini A,Bettinelli M. Concentration-dependentnear-infrared to visible upconversion in nanocrystalline and bulk Y2O3:Er3+. Chem Mater,2003,15(14):2737~2743
59.Pires AM,Serraa OA,Heer S,Güdel HU.Low-temperature upconversion spectroscopy of nanosized Y2O3Er,Yb Phosphor.J Appl Phys,2005,98(6):063529
60.Pires AM,Serraa OA,DavolosMR.Morphological and luminescent studies on nanosized Er,Yb-yttrium oxide upconverterprepared from differentprecursors. J Lumin,2005,113(3-4):174~182
61.Zijlmans HJMAA,Bonnet J,Burton J,Kardos K,Vail T,Niedbala RS, Tanke HJ. Detection of cell and tissue surface antigens using up-converting phosphors: A new reporter technology.Anal Biochem,1999,267(1):30~36
62.Wang M,Wang M,Mi CC,Wang WX,Liu CH,Wu YF,Xu ZR,Mao CB,Xu SK.Immunolabeling and NIR-excited fluorescent imaging of HeLa cellsby using NaYF4:Yb,Er upconversion nanoparticles. ACS Nano, 2009, 3(6):1580~1586
63.Lim SF,Riehn R,Ryu WS,Khanarian N,Tung CK,Tank D,Austin RH.In vivoand scanning electron microscopy imaging of upconverting nanophosphorsin Caenorhabditis elegans.Nano Lett,2006,6(2):169~174
64. Chatterjee DK, JalilRA, Zhang Y. Upconversion fluorescence imaging ofcells and small animals using lanthanide doped nanocrystals.Biomaterials,2008,29(7):937~943
65.Jalil RA,Zhang Y.Biocompatibility of silica coated NaYF4upconversion fluorescent nanocrystals.Biomaterials,2008,29(30):4122~4128
66.Kumar R,Nyk M,Ohulchanskyy TY,Flask CA,Prasad PN.Combined optical and MR bioimaging using rare Earth ion doped NaYF4nanocrystals.Adv Funct Mater,2009,19(6):853~859
67.Chermont QM,Chanéac C,Seguin J,Pellél F,Maîtrejean S,Jolivet J-P,Gourier D,BessodesM,Scherman D.Nanoprobes with near-infrared persistent luminescence for in vivoimaging.Proc Natl Acad Sci USA,2007,104(22):9266~9271.
68.Wu BY,Wang HF,Chen JT,Yan XP.Fluorescence resonance energy transfer inhibition for α-fetoprotein excreted during cancercellgrowth using functionalized persistent luminescencenanoparticles.JAm Chem Soc,2011,133(4):686~688
This work was supported by a grant from the"973'Program(2011CB707703)
Lanthanide Luminescence for Bioimaging
WU Boyue,YAN Xiuping
Research Center for Analytical Sciences,College of Chemistry,Nankai University,Tianjin 300071,China
Jan 30,2011 Accepted:Mar 14,2011
YAN Xiuping,Tel:+86(22)23504605,Fax:+86(22)23506075,E-mail:xiupingyan@gmail.com
Rare earth luminescent materials have long-life fluorescent emission,small full-width half-maximum(FWHM),and large Stokes shift,thereby have been receiving great attention in diverse applications,including fluorescence immunoassay,anion recognition,protein activity determination,nucleic acid detection.In this paper,the applications of rare earth complexes,lanthanide-doped upconversion nanoparticles,and persistent luminescence nanoparticles in bioimaging are reviewed,the main problems of the rare earth luminescent materials,particularly long persistent phosphors in fluorescent imaging are also discussed.
Lanthanide luminescence;Fluorescent imaging;Lanthanide complex;Upconversion luminescence;Persistent luminescence nanoaprticles
2011-01-30;接受日期:2011-03-14
“973”计划项目(2011CB707703)
严秀平,电话:(022)23506075,E-mail:xiupingyan@gmail.com
Q-334
10.3724/SP.J.1260.2011.00289
