N-酰化低聚壳聚糖衍生物还原能力的研究
2011-10-09银旭红康永峰邵则淮翁文荣
孙 涛,银旭红,康永峰,邵则淮,翁文荣
上海海洋大学食品学院,上海 201306
N-酰化低聚壳聚糖衍生物还原能力的研究
孙 涛*,银旭红,康永峰,邵则淮,翁文荣
上海海洋大学食品学院,上海 201306
对低聚壳聚糖进行N-酰化改性,制得取代度相同的N-马来酰低聚壳聚糖 (NMCOS),N-琥珀酰低聚壳聚糖 (NSCOS),N-邻苯二甲酰低聚壳聚糖 (NPCOS),其中 NMCOS1、NSCOS1、NPCOS1的取代度均为 0.25;NMCOS2、NSCOS2、NPCOS2的取代度均为 0.49。考察了 6种N-酰化低聚壳聚糖衍生物的还原能力。结果表明:当取代度相同时,N-邻苯二甲酰低聚壳聚糖的还原能力最强,其次是N-马来酰低聚壳聚糖,N-琥珀酰低聚壳聚糖的还原能力最差。这可能是由取代基的性质不同所致。
低聚壳聚糖;N-酰化;取代度;还原能力
Abstract:N-maleoyl chitosan oligosaccharide(NMCOS),N-succinyl chitosan oligosaccharide(NSCOS)andN-phthaloyl chitosan oligosaccharide(NPCOS)with the same substituting degree were prepared byN-acylation of chitosan oligosaccharide.The substituting degrees of NMCOS1,NSCOS1 and NPCOS1 were 0.25.The substituting degrees of NMCOS2,NSCOS2,and NPCOS2 were 0.49.Their power reducing were evaluated and the results showed the order of the power reducing of theN-acyl chitosan oligosaccharide with the same substituting degrees isNPCOS>NMCOS>NSCOS.Thatmay be related to the properties of the substituting groups.
Key words:chitosan oligosaccharide;N-acyl;substituting degree;power reducing
1 实验部分
1.1 仪器与材料
低聚壳聚糖 (浙江金壳生物化学有限公司,凝胶色谱测定其分子量为 5000 Da,脱乙酰度为95%);其余试剂均为分析纯,购自上海化学试剂公司;抗氧化测试所需溶液由二次蒸馏水配制。磁力搅拌器,pH计,分光光度计,电导率仪,EQUNOX55傅立叶红外-拉曼光谱仪,Waters 515型凝胶色谱仪。
1.2 N-酰化低聚壳聚糖的制备
1.2.1 N-马来 (邻苯二甲)酰低聚壳聚糖的制备
称取两份 5.0 g低聚壳聚糖分别加入 100.0 mL蒸馏水溶解,搅拌溶解,分别称取 1.0和 1.5 g的马来酸酐 (0.5 g和 2.5 g邻苯二甲酸酐),用 20.0 mL丙酮溶解,然后缓慢加入反应器,在室温下搅拌反应15 h,然后用丙酮沉淀,过滤,产物用丙酮反复洗涤,最后在 60℃烘干,得到 NMCOS1和 NMCOS2(NPCOS1和 NPCOS2)[5]。
低聚壳聚糖是甲壳素 /壳聚糖的降解产物,它能溶于水。低聚壳聚糖分子结构上有大量的氨基和羟基,具有优良的抗氧化活性[1,2]。同时它也可以进行多种化学改性。酰化改性是低聚壳聚糖的一种重要改性方式,既可以在羟基位上反应 (O-酰化)生成酯,也可以在氨基上反应 (N-酰化)生成酰胺。由于氨基的反应活性比羟基强,酰化反应易发生N-酰化反应[3]。N-取代基结构和取代度对N-酰基低聚壳聚糖的性能有重要的的影响,但是有关他们之间关系的研究,尚未见很多报道。
还原能力是评定抗氧剂活性的重要指标[4]。本文制备了取代度相同的N-琥珀酰,N-马来酰和N-邻苯二甲酰低聚壳聚糖,研究了取代基团对还原能力的影响。本研究为低聚壳聚糖化学改性的进一步研究提理论基础。
1.2.2 N-琥珀酰低聚壳聚糖制备
参照文献并稍做改进,称取两份 5.0 g低聚壳聚糖分别溶于 100 mL水中,然后转移到一个细颈瓶中,分别称取 1.0和 2.5 g琥珀酸酐溶解于 50 mL丙酮中,在室温下,30 min中内缓慢加到细颈瓶中,然后在 40℃温度下反应 4 h,反应完毕后,冷却至室温,用过量的丙酮沉淀,过滤,产物用丙酮反复洗涤,最后产物在 40℃真空干燥 24 h,得到白色的N-琥珀酰低聚壳聚糖 NSCOS1和 NSCOS2[6]。
1.3 结构表征
1.3.1 红外光谱
红外光谱在 EQUNOX55傅立叶红外-拉曼光谱仪上进行,采用 KBr压片法制样,测定波数范围为500~4000 cm-1,分辨率为 0.8 cm-1。
1.3.2 分子量的测定
凝胶色谱法测定N-酰化低聚壳聚糖衍生物的平均分子量大小。测试条件如下:柱子:TOSOH B IOSEP TSK-Gel G4000S WXL(7.8×300 mm,Made in Japan);流动相:0.2 M醋酸钠和醋酸缓冲溶液,pH=4.8;色谱仪:Waters 515型凝胶色谱仪,检测器:Waters 2410示差折光检测器 (美国 Waters公司);进样量:50μL;柱温:40℃;标准品:葡聚糖,平均分子量分别是 413000(Da),188000(Da),76900(Da),43200(Da),10500(Da)。
1.3.3 取代度的测定[7]
准确称量样品 0.1000 g置 500 mL烧杯内,准确加入 0.1038 mol/L HCl标准溶液 20.00 mL溶解样品,再加入去离子水 200 mL稀释、混匀,用0.4685 mol/L NaOH标准溶液返滴,测定电导率值。做电导率-氢氧化钠体积关系图,添加趋势线,求其回归方程,按下式计算N-酰化低聚壳聚糖的取代度:X=C1V1-C2V2;161X+203Y+262Z=m;(X+Z)/(X+Y+Z)=DD;Z/(X+Y+Z)=DS。其中C1,C2分别为 HCl和 NaOH标准溶液的浓度 (mol/L);V1为移取 HCl的体积,V2为滴定至第一个转折点处消耗 NaOH的体积;X为N-酰化壳聚糖中脱乙酰但未取代单元 (相对分子质量 161)的数量;Y为未脱乙酰单元 (相对分子量为 203)的数量;Z为酰化单元 (琥珀酰化,马来酰化,邻苯二甲酰化的相对分子质量分别是 262,260,310);m为样品质量(mg),DD为壳聚糖的脱乙酰度;DS为N-酰化低聚壳聚糖的取代度。
1.4 还原能力的测定
还原能力根据文献[8]测定并稍做改进。取 2.0 mL不同浓度的样品,加入 pH=6.60的 0.2 mol/L磷酸缓冲液 1%铁氰化钾溶液各 2.5 mL,混匀,50℃水浴 20 min后迅速冷却,加入 2.5 mL 10%三氯乙酸溶液,混匀后在 3000 r/min下离心 10 min,取上清液 2.0 mL,加入 2.5 mL去离子水和 0.5 mL 0.1%的三氯化铁溶液,静置十分钟后在 700 nm处测定吸光度。吸光度越高,表明还原能力越强。
2 结果与讨论
2.1 结构表征
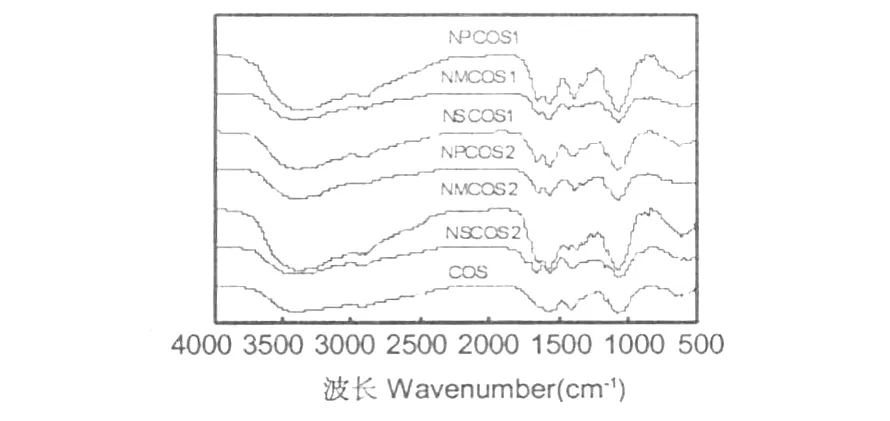
图1 COS及其N-酰化衍生物的红外光谱Fig.1 FTIR spectra of COS and itsN-acyl derivatives
图1 是低聚壳聚糖及其N-酰化衍生物的红外图。由图上可以看出,低聚壳聚糖及其N-酰化衍生物都在 1155,1073,1030,894 cm-1附近都有强吸收峰。这组较强峰是判定低聚壳聚糖及其衍生物存在的特征吸收峰[9]。
NMCOS中 1640 cm-1为烯烃的 VC=C振动峰;1707 cm-1附近出现为不饱和羧基因共轭作用的 C=O振动吸收峰;860 cm-1附近为双键中 C-H面外振动吸收峰,在低聚壳聚糖未见此峰,这些峰证实了NMCOS中马来酸基的存在[6]。在 NPCOS中,1640 cm-1为烯烃的 VC=C振动峰;在 750 cm-1附近的吸收峰为邻二取代苯的δAr-H面外弯曲振动峰这些峰证明了邻苯二甲酸基的存在[10]。在 NSCOS中,1400~1200 cm-1的吸收峰是琥珀酸碳结构的振动峰,这证明了 NSCOS中琥珀酸基的存在[11,12]。NMCOS、NPCOS和 NSCOS在 1560 cm-1附近的仲酰胺的δNH振动峰在衍生物中明显增大,同时在 1320 cm-1附近出现 VC-N伸缩振动峰,并且在 1073和1023 cm-1处的 C3仲羟基和 C6伯羟基的 C-O的伸缩振动吸收峰与壳聚糖相比没有明显变化,这均证明反应发生在氨基上[13]。
凝胶色谱法测得 NPCOS1、NMCOS1和 NSCOS1
的分子量分别为 5829、5733和 5772,NPCOS2、NMCOS2、NSCOS2的分子量分别为 6939、6310和6437。电导滴定法测定取代度 NPCOS1、NMCOS1、NSCOS1的取代度均为 0.25,NPCOS2、NMCOS2、NSCOS2的取代度均为 0.49。
2.2 还原能力


还原能力与抗氧化能力之间有着密切的关系[14]。图 2是取代度为 0.25的 NPCOS1、NMCSO1和 NSCOS1的还原能力曲线图。由图可知,随着样品浓度的升高,还原能力逐渐增强。当浓度为 0.4 mmol/L时 ,NPCOS1、NMCOS1和 NSCOS1的吸光值分别是 0.52、0.48和 0.43。NPCOS1、NMCSO1和NSCOS1的还原能力大小顺序依次为 NPCOS1>NMCOS1>NSCOS1。图 3是取代度为 0.49的NPCOS2、NMCOS2和 NSCOS2还原能力曲线图。当浓度为 0.4 mmol/L时,NPCOS2、NMCOS2和 NSCOS2的吸光值分别是 0.57、0.49和 0.44,与取代度为 0.25时一样,NPCOS2、NMCOS2和 NSCOS2的还原能力大小为 NPCOS2>NMCOS2>NSCOS2。随着取代度的升高,NPCOS的还原能力始终最强,其次是 NMCOS,NSCOS的还原能力最差。
抗氧化物质通过提供电子阻断 Fe2+向 Fe3+转变,表现出一定的还原能力。低聚壳聚糖主要是由单元分子结构上的氨基和羟基提供电子阻断 Fe2+向 Fe3+转变。当低聚壳聚糖发生N-酰化后,其部分氨基被取代基取代。取代度相同,羟基和残余氨基数目相同。他们还原能力的差异可能是由取代基不同所致。
NPCOS、NMCOS和 NSCOS是在壳聚糖上的氨基位上分别引进-COC6H4COO–、-COCH=CHCOO–和-COCH2CH2COO–,这三种取代基团都是吸电子基团,它们能降低聚壳聚糖分子结构的电子云密度,使分子内、分子间生成氢键的几率降低,从而增强氨基和羟基的活性,供氢能力增强,有利于还原能力。三种取代基的吸电子能力大小顺序依次为:-COC6H4COO–>-COCH = CHCOO–> -COCH2CH2COO–,故他们的还原能力大小为NPCOS >NMCOS >NSCOS。
3 结论
本文通过合成相同取代度的N-马来酰低聚壳聚糖、N-琥珀酰低聚壳聚糖和N-邻苯二甲酰低聚壳聚糖,并通过考察其还原能力,研究了取代基团对低聚壳聚糖还原能力的影响。结果表明,取代度相同时,N-邻苯二甲酰低聚壳聚糖的还原能力始终最强,其次是N-马来酰低聚壳聚糖,再次是N-琥珀酰低聚壳聚糖,这是由于取代基的性质不同所致,吸电子效应邻苯酰基 >马来酰基 >琥珀酰基。本实验对低聚壳聚糖的选择性功能化提供了新的思路。
1 Liu HT,LiWM,Xu G,et al.Chitosan oligosaccharides attenuate hydrogen peroxide-induced stress injury in human umbilical vein endothelial cells.Pharm Res,2009,59:167-175.
2 RaoMS,Chander R,Sharma A.Synergistic effect of chitooligosaccharides and lysozyme for meat preservation.Food Sci Technol,2008,41:1995-2001.
3 Zhang C,PingQN,Zhang HJ,et al.Synthesis and characterization of water-solubleO-succinyl-chitosan.Eur Polym J,2003,39:1629-1634.
4 Meir S,Meir J,Kanner B,et al.Dete rmination and involvement of aqueous reducing compounds in oxidative defence systems of various senescing leaves.J Agric Food Chem,1995,43:1813-1815.
5 Wang ZY(王周玉),Jiang ZJ(蒋珍菊),Li FS(李富生),et al.Synthesis and characterization ofwater-solubleN-acyl chitosan.J Sichuan Univ Sci Tech(四川工业学院学报),2004,23:73-75.
6 Zhu AP,Chen T,Yuan LH.Synthesis and characterization ofN-succinyl-chitosan and its self-assembly of nanospheres.Carbohydr polym,2006,66:274-279.
7 Huo XY(霍秀颖),ZhangXH(张小华),WuQ(吴清).Determination of substitution degree ofN-succinyl-chitosan by conductometric titration.J Beijing Univ Tradit Chin Med(北京医药大学学报),2007,30:700-702.
8 Yen GC,Chen HY.Antioxidant activity of various tea extracts in relation to their ant imutagenicity.J Agric Food Chem,1995,43:27-32.
9 WangAQ(王爱勤).Chitin Chemistry(甲克素化学).Beijing:Science Press,2007:60-62.
10 Yi Y(易喻 ),Yang H(杨好 ),Ying GQ(应国清 ),et al.Synthesis and properties ofN-phthaloyl-chitosan.Chem IndusEng Pro(化工进展),2006,5:542-545.
11 SuiWP,Wang YH,Dong SL,et al.Preparation and properties of an amphiphilic derivative of succinyl-chitosan.Colloids and Surfaces A:Physicochem Eng Aspects,2008,316:171-175.
12 WangQ(汪 琴 ),Wang AQ(王 爱 勤 ).Study on synthesis and propertiesofN-succinyl-chitosan.Mod Food Sci Tech(功能高分子学报),2004,17:51-54.
13 Hirano S,Ohe Y,Ono H.SelectiveN-acylation of chitosan.Carbohydr Res,1976,47:315-320.
14 Duh PD,Du PC,Yen GC.Action of methanolic extract of mung bean bulls as inhibitors of lipid peroxidation and noN-lipid oxidative damage.Food Chem Toxic,1999,37:1055-1061.
Power Reducing ofN-acyl Chitosan O ligosaccharide
SUN Tao*,Y IN Xu-hong,KANG Yong-feng,SHAO Ze-huai,WENGWen-rong
College of Food Science,Shanghai Ocean University,Shanghai 201306
Q58;R284.3;TS202.3
A
1001-6880(2011)01-0098-04
2009-06-15 接受日期:2009-09-02
上海市教育委员会科研项目 (07ZZ134);上海市教委重点学科建设项目专项基金(J50704)
*通讯作者 Tel:86-21-61900363;E-mail:taosun@shou.edu.cn
