红谷霉素对金黄色葡萄球菌抑菌机制的研究
2011-10-09薛秀园涂国全
涂 璇,薛秀园,涂国全
江西农业大学生物科学与工程学院,南昌 330045
红谷霉素对金黄色葡萄球菌抑菌机制的研究
涂 璇,薛秀园,涂国全*
江西农业大学生物科学与工程学院,南昌 330045
红谷霉素是一种抗细菌的新型抗生素。为探讨红谷霉素对金黄色葡萄球菌的抑菌机制,本文采用浓度为 EC50和 EC90的红谷霉素对试验菌株进行处理,并设空白对照,测定供试菌株的胞外多糖、细胞膜渗透性和生物大分子 (DNA、RNA、蛋白质和胞外酶活性)。结果显示:红谷霉素对金黄色葡萄球菌的抑制作用首先表现在对核酸合成的抑制,由于核酸的合成受阻,引起菌体内的蛋白质和其它的生物大分子的合成受阻,细菌细胞膜通透性改变。透视电镜照片显示:红谷霉素处理后金黄色葡萄球菌菌体内部的原生质体明显变稀。
红谷霉素;金黄色葡萄球菌;抑菌机制
Abstract:Honggumycin is a kind of new antibiotic.UsingStaphalococcus aureusas the experimental bacterial,the antibacterialmechanis m of Honggumycin was investigated.The experimental bacterialwas treated with Honggumycin at the concentration of EC50and EC90,with no Honggumycin as blank control.And the EPS,plas malemma transparence,and biomolecular(DNA,RNA,and protein)were determined.The results showed that the antibacterial activity of Honggumycin toS.aureuswas presented in inhibiting the synthesis of nuclei acid.The synthesis of protein and other biomolecular were restrained due to the inhibition of nuclei acid synthesis,and the plas malemma permeability was changed.Electron microscope photograph showed the protoplast ofS.aureushad become thin after treatingwith Honggumycin.
Key words:Honggumycin;Staphalococcus aureus;antibacterialmechanis m
江西农业大学生物科学与工程学院应用微生物研究室在以棉花枯萎病菌为靶目标开展农抗生产菌的分离筛选研究中,从土壤中分离筛选到一株链霉菌,命名为链霉菌 702。其产生的生物活性物质对棉花枯萎病菌有较强的抑菌活性,进一步测定它的抗菌谱,发现其所产生生物活性物质既能抑制革兰氏阳性细菌,又能抑制革兰氏阴性细菌,同时还能抑制霉菌和酵母菌[1]。毒理实验表明其为无毒物质,而且通过对链霉菌 702生物活性物质的稳定性研究测定表明其对热和紫外线稳定,在 pH3~12条件下稳定[2]。这些初步研究结果已显示了其作为防腐剂的广阔前景。链霉菌 702所产抗细菌组分经紫外、红外、质谱、核磁共振和 X衍射等测定,结果表明该活性组分与放线菌素 X2同质,为国内首次发现,命名为红谷霉素。本论文在总结前人工作的基础上,以金黄色葡萄球菌为试验菌株,探索红谷霉素对 G+金黄色葡萄球菌的营养体的抗菌作用性质。通过红谷霉素对金黄色葡萄球菌的抗菌活性和毒力测定,探索红谷霉素的抑菌能力,为红谷霉素的应用提供基础数据资料。
1 材料和方法
1.1 材料
1.1.1 红谷霉素纯品 (含量 99.47%)
由江西农业大学生物工程院提供。
1.1.2 抑菌测定指示菌
金黄色葡萄球菌(Staphalococcus aureus)
1.1.3 培养基[3]
①指示菌斜面培养基:牛肉膏蛋白胨培养基;②指示平板培养基:GPP培养基。
1.2 方法
1.2.1 红谷霉素对金黄色葡萄球菌DNA作用影响的测定
1.2.1.1 DNA标准曲线的测定
取 6支试管,按表 1添加试剂。混匀后于 60℃恒温水浴保温 60 min,冷却后以 0号管作对照,于595 nm处测定A595,以DNA浓度为横坐标,光吸收值为纵坐标,绘制标准曲线,见表 1。
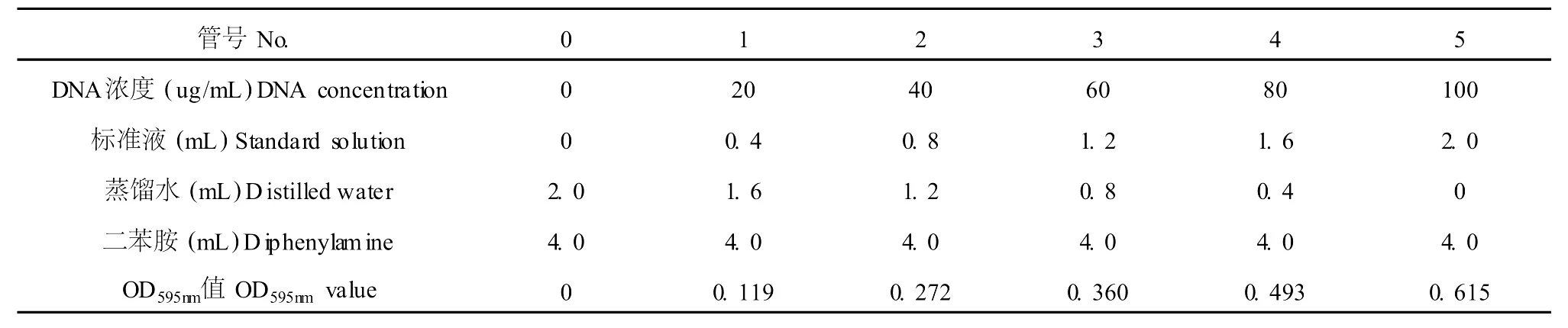
表1 DNA标准曲线的测定Table 1 The determination ofDNA specification curve
1.2.1.2 供试样品中的DNA含量测定
DNA的含量测定采用改良的二苯胺法。将供试菌在 GPP培养液中振荡培养至对数生长期,再分为 3瓶,处理红谷霉素,使菌液红谷霉素的最终浓度为 EC90、EC50、对照加无菌水,30℃ 120 r/min继续培养;分别于加药前、加药后 1、3、6 h取样。然后采用有机溶剂抽提法分离提取样品中 DNA,将上层的水相和下层的有机溶剂层分开保存。取上层水相按DNA标准曲线测定方法进行DNA含量的测定。
1.2.2 红谷霉素对金黄色葡萄球菌 RNA作用影响的测定
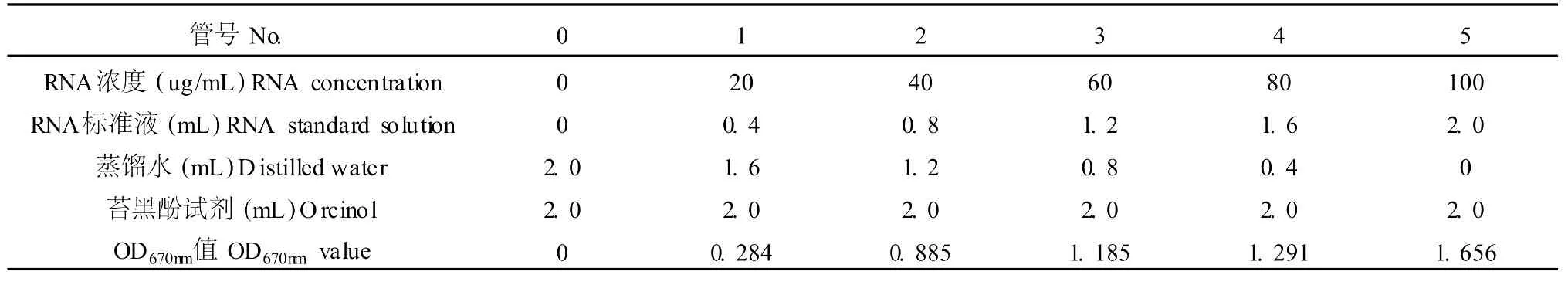
表2 RNA标准曲线的测定Table 2 The determination of RNA specification curve
1.2.2.2 供试样品中 RNA含量的测定
RNA含量测定采用改良苔黑酚法。将供试菌在 GPP培养液中振荡培养至对数生长期,再分为 3瓶,处理红谷霉素,使菌液红谷霉素的最终浓度为EC90、EC50、对照加无菌水,30 ℃,120 r/min继续培养;分别于加药前、加药后 1、3、6 h取样。然后采用热酚法提取样品中 RNA,再按 RNA标准曲线测定方法进行测定。
1.2.3 红谷霉素对金黄色葡萄球菌蛋白质作用影响的测定
1.2.3.1 蛋白质标准曲线的测定
取 6支试管,按表 3添加试剂。混匀后放置 2 min后,在 595 nm下比色,绘制标准曲线,见表 3。
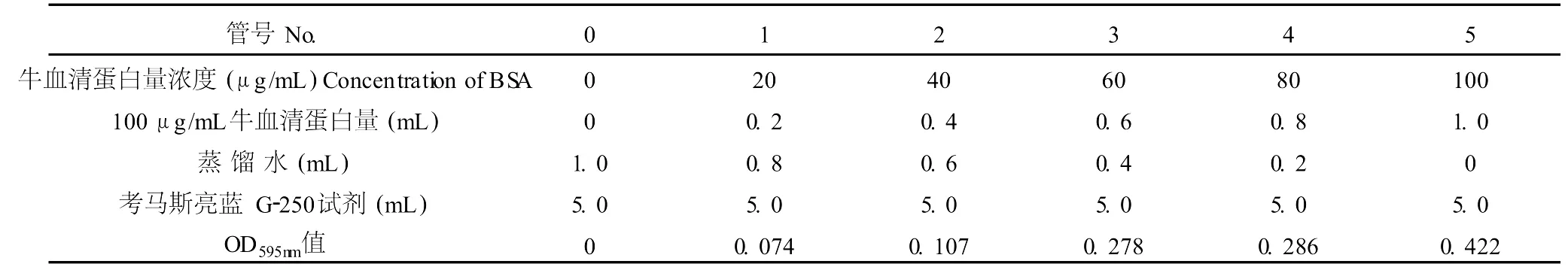
表3 蛋白质标准曲线的测定Table 3 The deter mination of protein from zero to a hundredμg/mL specification curve
1.2.2.1 RNA标准曲线的测定
取试管 6支,按表 2添加试剂。混匀后置 100℃恒温水浴保温 45 min,以 0号管为对照,于 670 nm处测定光吸收值 A670,以 RNA浓度为横坐标,光吸收值为纵坐标作图,绘制标准曲线,见表 2。
1.2.3.2 供试样品中蛋白质含量的测定
蛋白质测定采用考马斯亮蓝法。将供试菌在GPP培养液中振荡培养至对数生长期,再分为 3瓶,处理红谷霉素,使菌液红谷霉素的最终浓度为EC90、EC50、对照加无菌水,30 ℃,120 r/min继续培养;分别于加药前、加药后 1、3、6 h取样。然后采用有机溶剂抽提法分离提取样品中蛋白质,再按蛋白质标准曲线测定方法进行测定。
1.2.4 红谷霉素对供试菌体胞外多糖 (EPS)作用影响的测定[4]
将 0.1 mL菌体悬浮液分别均匀涂布于含红谷霉素低于有效抑制中浓度 EC50系列浓度的 GPP平板上,28~30℃培养 2 d,收集菌落,用定量的无菌水洗下 EPS,离心上清液用粘度计算其粘度,菌体烘干后称量,计算相对粘度值 (每毫升上清液粘度 /每毫克菌体干重),并比较红谷霉素对菌体 EPS生物合成和菌体生长速度速率的影响。
1.2.5 红谷霉素对菌体细胞膜渗透性作用影响的测定
将供试菌培养至对数生长中期,离心收集菌体,用 1%NaCl溶液洗涤离心,重复 2次,再将菌体悬浮于 1%NaCl溶液中,加红谷霉素,使最终浓度为供试细菌的 EC50处理,置于 30℃条件下,分别于 0、3、6、12 h,取样离心,收集上清液,用紫外分光光度计测 220~380 nm间的吸收峰型及 260 nm吸收物含量变化。
1.2.6 红谷霉素对菌体作用前后菌体形态的变化的测定
挑取在平板上分离较好的单个菌落接种于 GPP液体培养基中,于 37℃过夜培养,进行扩大培养。再转接于新鲜的液体培养基中培养至对数生长期,加入稀释好的红谷霉素,使培养液中红谷霉素的浓度为 10倍杀菌浓度,分别取加药前和加药后的 3 h的菌液,离心收集菌体。
收集处理前后的菌体,用 0.1 mol/L的磷酸缓冲液洗涤菌体两次,弃缓冲液,加入 2.5%戊二醛固定液,混匀菌体,于 4℃固定过夜;离心收集菌体,加入溶解后冷却至 50℃左右的 1.5%的琼脂糖,用牙签轻轻将沉淀挑起来,确保菌体全部包埋进琼脂糖中。待凝固后,用刀片切去多余的部分,把有样品的留下,切成小长条,重新放入固定液中。
用 0.1 mol/L的磷酸缓冲液冲洗样品 6次,每次 20 min;然后用 1%锇酸 4℃冰箱中固定 2 h,再用 0.1 mol/L的磷酸缓冲液冲洗样品 6次,每次 10 min;再经 50%、70%、80%、90%、100%(含 CuSO4)的酒精依次脱水,每次 10 min;再用环氧丙烷、环氧丙烷 +硫酸铜各处理 10 min;环氧丙烷:环氧树脂 3∶1,处理 1 h;环氧丙烷 ∶环氧树脂 1∶1,处理 2 h;环氧丙烷∶环氧树脂 1∶3,处理 30 min;环氧树脂保存过夜。
最后用 Epon818树脂包埋、超薄切片、染色。制好的样品在透射电镜下观察并记录结果、拍照。
1.2.7 红谷霉素对细菌产胞外酶作用影响的测定
胞外酶活性测定采用酶液琼脂扩散法进行[5]。基本方法是:在 GPP培养基中加入相应底物,灭菌后待培养基冷却至 50℃左右后加入不同浓度的红谷霉素 1 mL,摇匀倒平板,然后点滴稀释好的菌体悬液 0.1 mL,涂布均匀,30℃培养 3 d,向培养皿中加入相应酶的显色剂显现酶水解圈。据水解圈与菌落直径的比值,了解各红谷霉素浓度条件下菌株胞外酶的活性。
淀粉酶:底物为 0.25%可溶性淀粉,显色剂为Lugol’s碘液 (I21g,KI2g,H2O 300 mL)。
蛋白酶:底物为 1%明胶,显色剂为饱和硫酸铵。
脂酶:底物为 1%的吐温 20,不用显色剂。
2 结果和分析
2.1 红谷霉素对金黄色葡萄球菌DNA的作用影响的测定结果
2.1.1 DNA标准曲线
根据表 1测定 DNA标准曲线结果,如图 1所示。
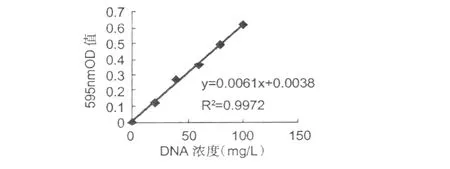
图1 DNA标曲Fig.1 Standard curve ofDNA
2.1.2 红谷霉素对金黄色葡萄球菌DNA的作用影响的测定结果
红谷霉素对金黄色葡萄球菌 DNA的作用影响的测定结果,如图 2所示。

图2 金黄色葡萄球菌 DNA含量变化Fig.2 The change ofS.aureuDNA
从图 2可以看出,在红谷霉素对供试菌体的DNA有强烈地抑制作用。随着红谷霉素浓度的增加和作用时间的延长,细菌的 DNA含量在迅速地减少。
2.2 红谷霉素对金黄色葡萄球菌DNA的作用影响的测定结果
2.2.1 RNA标准曲线测定结果
根据表 2测定 RNA标准曲线结果,如图 3所示。
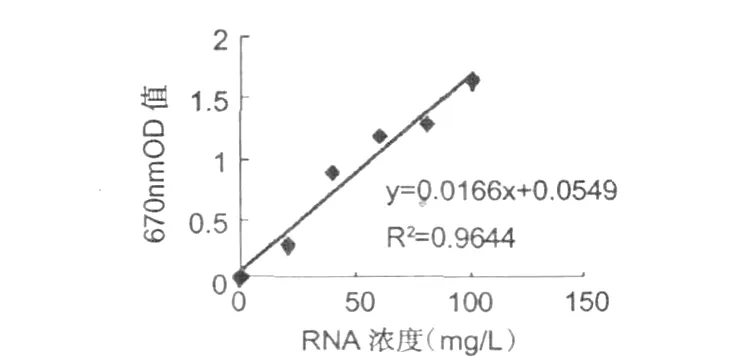
图3 RNA标曲Fig.3 Standard curve of RNA
2.2.2 红谷霉素对金黄色葡萄球菌DNA的作用影响的测定结果
红谷霉素对金黄色葡萄球菌 DNA的作用影响的测定结果,如图 4所示。

图4 金黄色葡萄球菌 RNA含量变化Fig.4 The change ofS.aureuRNA
从图 4可以看出在红谷霉素对供试菌体的RNA有强烈地抑制作用。随着红谷霉素浓度的增加和作用时间的延长,细菌的 RNA含量在迅速的减少。
2.3 红谷霉素对金黄色葡萄球菌蛋白质的作用影响的测定结果
2.3.1 蛋白质标准曲线的测定结果
根据表 3测定蛋白质标准曲线结果,如图 5所示。

图5 蛋白质标曲Fig.5 Standard curve of protein
2.3.2 红谷霉素对金黄色葡萄球菌蛋白质的作用影响的测定结果
红谷霉素对金黄色葡萄球菌蛋白质的作用影响的测定结果,见图 6所示。
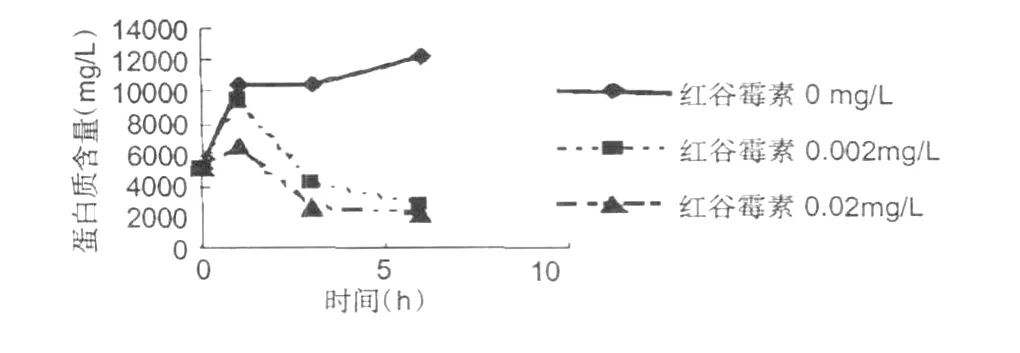
图6 金黄色葡萄球菌蛋白质含量变化Fig.6 The change ofS.aureuprotein
从图 6可以看出,红谷霉素对供试菌体的蛋白质有强烈地抑制作用。随着红谷霉素浓度的增加和作用时间的延长,细菌的蛋白质含量在迅速的减少。
2.4 红谷霉素对金黄色葡萄球菌胞外多糖 (EPS)作用的测定结果
根据红谷霉素在 0、0.0025、0.005、0.01 mg/L和 0.02 mg/L五个浓度下对葡萄球菌作用 48 h后的相对粘度值 (每毫升上清液粘度/每毫克菌体干重),并将各相对粘度值与红谷霉素浓度作图,结果如图 7所示。
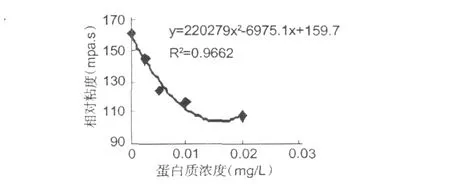
图7 红谷霉素浓度与金葡菌菌体粘度关系Fig.7 The relate of Honggumycin chroma andS.aureuviscosi
从图 7的结果可以看出,随着红谷霉素浓度的增加,金黄色葡萄球菌的胞外多糖含量相应的减少,说明红谷霉素对细菌胞外多糖的产生会有抑制作用。
2.5 红谷霉素对菌体细胞膜渗透性的作用的测定结果
加入红谷霉素 EC50浓度作用于金黄色葡萄球菌,置于 30℃条件下培养,分别在培养 0、3、6、12 h,取样离心取上清液,用紫外分光光度计测吸收物含量变化,结果分别见图 8~11。
从图 8~11可以看出,经红谷霉素处理过的金黄色葡萄球菌随处理时间的增加,吸光度越大,说明胞外生物大分子含量增加。因此,可推断红谷霉素作用细胞膜的蛋白质合成,导致细菌细胞膜上膜蛋白含量的减少,从而造成细胞膜通透性增加。
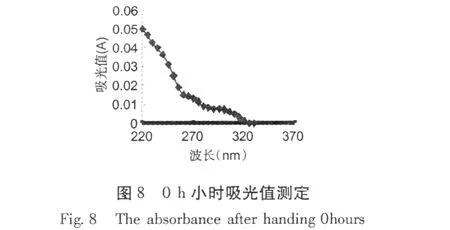



图11 12 h吸光值测定Fig.11 The absorbance after handing 12 hours
2.6 红谷霉素对金黄色葡萄球菌作用前后体形态变化的测定结果
红谷霉素对金黄色葡萄球菌作用前后菌体形态变化的透射电镜照片见图 12、13。

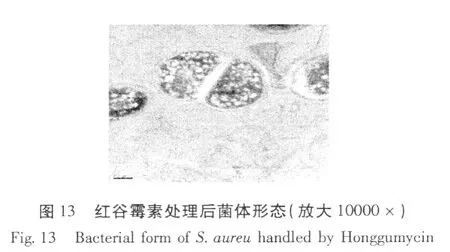
从图 12、13的结果可以看出,用红谷霉素处理后的细菌,其内部原生质体与对照相比明显的变稀。红谷霉素作用后菌体形态的变化进一步说明红谷霉素对金黄葡萄球菌的抑菌机制是抑制菌体生物大分子 DNA、RNA和蛋白质的合成。
2.7 红谷霉素对金黄色葡萄球菌胞外酶作用影响的测定结果
红谷霉素处理前后金黄色葡萄球菌产胞外酶能力的比较结果如表 4所示:

表4 红谷霉素对金黄色葡萄球菌的胞外酶产生的影响Table 4 The activity of extracellullar enzymes ofS.aureu
从表 4可以看出,在培养基中加入红谷霉素后,细菌的胞外淀粉酶、蛋白酶和脂酶产量有明显的降低,这进一步说明红谷霉素对细菌蛋白质的合成有强烈的抑制作用。
3 讨论
3.1 红谷霉素对金黄色葡萄球菌的 DNA、RNA、蛋白质、胞外多糖和胞外淀粉酶、蛋白酶、脂酶的合成有强烈地抑制作用。随着红谷霉素浓度的增加和作用时间的延长,细菌的 DNA、RNA、蛋白质、胞外多糖和胞外淀粉酶、蛋白酶、脂酶含量在迅速地减少。说明红谷霉素对金黄色葡萄球菌的作用机制是首先抑制细胞内 DNA、RNA的合成,从而导致细胞内外蛋白质的减少和细胞膜的渗透性增大。
3.2 红谷霉素处理前后金黄色葡萄球菌菌体形态的透射电镜照片表现出明显的变化,这从菌体的形态学上进一步佐证了红谷霉素对金黄色葡萄球菌的作用机制。
3.3 在以红谷霉素为试验材料,分别以 G+菌,腊质芽孢杆菌、巨大芽孢杆菌和 G-菌,大肠杆菌和小麦青枯病为供试菌进行抑制机制的研究,获得了与金黄色葡萄球菌同样的试验结果,进一步说明红谷霉素对细菌的作用机制是抑制细菌细胞内 DNA和RNA的合成,从而导致影响细胞内外蛋白质的合成。本试验获得的红谷霉素对金黄色葡萄球菌的作用机制有待于分子生物学上进一步试验和验证。
1 Li KT,Li XH,Liu SH,et al.A prel iminary study on the effects of bio-antiseptic 702 on anti-bacteria,anti-moulds and anti-yeasts.Acta Agric Univ Jiangxiensis,2002,24:599-602.
2 Cai HJ,Wen Y,Tu GQ.Measure of the stability of the bioactive compound produced byStreptom yces702.Acta AgricUniv Jiangxiensis,2003,25:929-933.
3 Shen P,Fan XR,Li G W,et al.Microbiology Experments.Beijing:Higher Education Press,1999,18:214-223.
4 Huang YL,Hu ML. Improvement on cell membrane permeability experiment.J Zhanjiang No rm al Coll,2005,26:119-122.
5 Dingle J,RE ID WW,Solomons GL.The enzymic de gradation of pection and otherpolysaccharides.J Sci Food Agric,1953,4:149-155.
Antibacterial Mechanism of Honggumycin toStaphylococcus aureus
TU Xuan,XUE Xiu-yuan,TU Guo-quan*
B iological Science&Engineering College,Jiangxi Agricultural University,Nanchang 330045,China
Q939;R446.5
A
1001-6880(2011)01-0153-06
2009-09-04 接受日期:2009-11-30
江西省自然科学基金项目(0630013)
*通讯作者 E-mail:tuguoquan@263.net
