从盾叶薯蓣组培苗中高压酸解制备薯蓣皂苷元
2011-10-09阴春晖李培琴赵江林单体江何桂玲周立刚
阴春晖,李培琴,赵江林,单体江,何桂玲,周立刚
中国农业大学农学与生物技术学院,北京 100193
从盾叶薯蓣组培苗中高压酸解制备薯蓣皂苷元
阴春晖,李培琴,赵江林,单体江,何桂玲,周立刚*
中国农业大学农学与生物技术学院,北京 100193
采用正交试验法对盾叶薯蓣 (D ioscorea zingiberensis)组培苗中薯蓣皂苷元的高压酸解制备工艺进行了研究。以薯蓣皂苷元的含量作为评价指标,选用正交表 L16(45),以样品用量、硫酸浓度、提取时间为因素,设计了3因素 4水平的正交试验。结果表明:高压酸解提取薯蓣皂苷元的最佳工艺条件为:样品用量 25 mg、硫酸浓度0.5 mol/L、提取时间 2 h,在此条件下提取物中薯蓣皂苷元的平均含量为 9.12 mg/g。
盾叶薯蓣;薯蓣皂苷元;高压酸解;正交试验
Abstract:Acidolysis preparation of diosgenin at high pressure from the cultured plantlets ofD ioscorea zingiberensiswas studied byL16(45)orthogonal experiments.The effects of sample quantity,concentration of sulfuric acid,and extraction time were investigated.The results showed that diosgenin content of the plantlets reached 9.12 mg/g under the optimum extraction condition thatwas 25 mg of sample,0.5 mol/L of sulfuric acid,and 2 h of extraction t ime.
Key words:D ioscorea zingiberensis;diosgenin;acidolysis preparation at high pressure;orthogonal experiments
盾叶薯蓣 (D ioscorea zingiberensisC.H.W right)分类学上属于单子叶百合目 (Liliales)薯蓣科 (Dioscoreaceae)薯蓣属[1],以根状茎入药,主要活性成分为薯蓣皂苷元 (俗称皂素),含量为 1.1%~16.2%,居世界薯蓣属植物之冠[2]。薯蓣皂苷元是合成皮质激素、性激素和蛋白同化激素等甾体类药物的重要原料,因此被称为医药界的“药用黄金”[3]。
薯蓣皂苷元在植物中很少以游离态形式存在,一般以苷元与糖基形成皂苷的形式存在,人们一般是从植物组织中提取分离出含有薯蓣皂甙元或类似结构的皂苷,然后转化成薯蓣皂苷元。迄今为止,提取薯蓣皂苷元的方法主要有:酸水解法[4]、索氏提取法[5]、近临界水解法[6]、回流提取法[7]、直接与自然发酵法[8,9]、水解原位萃取法[10]、酶解法[11]、超声提取[12]、超临界流体萃取[4]等。高压酸解制备薯蓣皂苷元的方法是在常压酸解的基础上发展起来的,一般是在 0.1~0.2MPa压力条件下进行酸水解,能有效地提取组织内的薯蓣皂苷元[13,14]。
薯蓣皂苷元经济价值高,市场需求大,由于资源的采挖过度,自然存量急剧减少[15]。为了保护日益枯竭的薯蓣资源和满足市场对薯蓣皂苷元的需求,我们可以利用生物技术方法 (试管微繁殖和细胞大量培养)生产薯蓣皂苷元[3,16]。通过细胞和组织培养技术大规模培养盾叶薯蓣,既可保存种质资源,又能快速繁殖优良品种[16]。在诸多的研究 (如代谢调控)中,薯蓣皂苷元的提取与含量分析是非常重要的环节,工作量大,因此有必要建立一种快速、微量提取薯蓣皂苷元的方法。本研究采用高压 (1.05 kg/cm2、121℃)酸水解的方法,提取盾叶薯蓣组培苗中的薯蓣皂苷元,为高效率分析盾叶薯蓣培养物(包括组培苗)中的薯蓣皂苷元含量,以及将来大规模生产组培苗或培养细胞获得薯蓣皂苷元提供依据。
1 材料与方法
1.1 植物材料
盾叶薯蓣 (D ioscorea zingiberensis)组培苗由武汉大学李家儒教授赠送。将盾叶薯蓣组培苗置于光照培养箱中,培养条件为:25℃,每天连续光照 12 h,光强为 2000 lx,MS基本培养基 (未添加激素),每28 d继代培养 1次。根据本研究小组前期结果[17],确定培养 28 d为组培苗合成薯蓣皂苷元的收获期。
1.2 仪器与试剂
微量电子天平 (AL104型,Mettler Toledo仪器上海有限公司);数控超声波清洗器 (KQ5200DE型,昆山市超声仪器有限公司);光照培养箱 (RXZ智能人工气候箱,宁波江南仪器厂);立式压力蒸汽灭菌器(LS-B55L型,江阴滨江医疗设备厂);紫外可见分光光度计 (TU-1810型,北京普析通用仪器有限责任公司);薯蓣皂苷元的标准品 (纯度 98%,由武汉大学李家儒教授提供);浓硫酸、高氯酸、香草醛、冰醋酸、石油醚、无水硫酸钠、氢氧化钠、无水乙醇为北京化学试剂公司产品,均为分析纯。
1.3 薯蓣皂苷元提取物的制备
选择生长均一的盾叶薯蓣组培苗,60℃干燥后研磨成粉,根据正交试验设计方案 (表 1),准确称取不同重量的盾叶薯蓣组培苗粉末于试管中,加入 5 mL 95%乙醇和 5 mL不同浓度的 H2SO4,室温放置1 d后超声提取 2 h,然后在 121℃高压 (1.05 kg/cm2≈ 0.10 MPa)下酸解不同时间,除去样品残渣,用 45 mL石油醚分 3次进行萃取,合并提取液,先后用 1 mol/L NaOH和蒸馏水洗涤 2次,收集石油醚层,用无水Na2SO4去水,真空浓缩至干,得到薯蓣皂苷元提取物,采用分光光度法测定提取物中薯蓣皂苷元的含量。
1.4 高压酸解工艺设计
对影响薯蓣皂苷元提取率的 3个主要因素:样品用量 (A)、硫酸浓度 (B)、提取时间 (C)进行考察。按 L16(45)正交表 (表 1)进行实验,每个处理设 3个重复,以薯蓣皂苷元含量作为考察指标,探讨最佳提取工艺条件。

表1 正交设计试验因素和水平Table 1 Factors and levels of the orthogonal exper iment
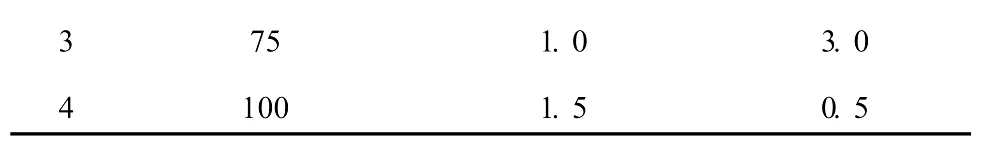
3 75 1.0 3.0 4 100 1.5 0.5
1.5 薯蓣皂苷元的含量分析
精确称取 5 mg薯蓣皂苷元标准品于 5 mL容量瓶中,用石油醚溶解并定容至刻度线,配成 1 mg/mL标准母液。依次取 0、30、40、50、60、70、80和 90μL薯蓣皂苷元母液于刻度试管中,挥干溶剂,先后加入0.1 mL 5%香草醛-醋酸液和 0.4 mL高氯酸,于 70℃水浴上不断振摇,保温 30 min,取出后置于冰水终止反应,加冰醋酸至 5 mL刻度线,摇匀备用,室温放置 10 min,在 400~700 nm区间扫描得最大吸收波长为 451 nm。以 5 mL反应体积中薯蓣皂苷元的浓度 (μg/mL)为横坐标 (X),451nm吸光值为纵坐标(Y),建立线性回归方程:Y=0.0368X-0.0028,R=0.9951,根据方程计算样品中薯蓣皂苷元含量。
1.6 统计分析
对所得数据进行显著性差异分析,得出各处理之间的显著性差异关系。采用 SAS软件,显著性差异水平为 0.01。
2 结果与分析
2.1 正交试验
正交优选高压酸解提取薯蓣皂苷元的工艺研究结果见表 2,通过 SAS分析,2号方案 (A1B2C2)中薯蓣皂苷元产量极显著地高于其余 15个实验方案,3个重复的薯蓣皂苷元含量分别为:8.91 mg/g、9.39 mg/g和 9.08 mg/g,平均含量达到 9.13 mg/g。综合来看,2号方案 (A1B2C2:样品用量 25 mg、硫酸浓度 0.5 mol/L、提取时间 2 h)为最佳实验方案。
从极差分析 R值的大小可以看出各因素对薯蓣皂苷元含量的影响作用大小次序为:A>C>B>E>D,表明样品用量是对高压酸解提取薯蓣皂苷元含量影响最大的因素,其次为提取时间,再次为硫酸浓度。误差列 D和 E的 R值均小于 3个因素,说明3个因素没有交互作用或三者的交互作用对薯蓣皂苷元含量 (或称提取产量)影响不明显。
2.2 方差分析
为了验证各因素对高压酸解提取薯蓣皂苷元得率 (含量)影响的差异及其造成这种影响的原因,我们对高压酸解正交试验进行了多因素方差分析和 F检验 (结果见表 3),可以看出:本实验所考察的 3个因素的 F值均大于 F0.01,表明这 3个因素对薯蓣皂苷元得率的影响均达到极显著水平。
由于 F值的大小表示着效应的大小,在本实验所考察的 3个因素中,对薯蓣皂苷元含量的影响作用大小次序为:A>C>B,与极差分析结果保持一致。通过对 3个因素各水平间的薯蓣皂苷元含量进行差异显著性检验,结果表明A1B2C2组合为最佳的高压酸解组合,在此条件下的薯蓣皂苷元含量最高。

表2 正交试验设计及结果Table 2 Orthogonal experimental design and results

表3 正交试验方差分析Table 3 Analysis of variance of the orthogonal exper iments
2.3 验证试验
按以上最佳提取条件 (A1B2C2组合),重复进行了 4次试验,所得提取物中薯蓣皂苷元的平均含量为 9.12 mg/g,重现性较好。
3 讨论
在常规酸水解和回流提取方法中,所需的硫酸量是很大的,并且一次回流提取只能处理 1个样品。比如采用二步索氏提取法[5],先用甲醇回流 4 h,再用浓度为 2.5 mol/L的硫酸水解 6 h,最后用汽油回流 2 h,整个实验过程耗时长,对于进行多个处理的实验既费时又费力。通过 L16(45)正交试验,我们可以确定高压酸解提取薯蓣皂苷元的最佳提取条件为:样品用量 25 mg、硫酸浓度 0.5 mol/L、提取时间2 h,在此条件下薯蓣皂苷元的平均含量是 9.12 mg/g。高压酸解提取方法不仅缩短了提取时间,降低了硫酸的使用量,并且一次可对多个样品进行处理,提高了工作效率。本研究通过对高压酸解制备薯蓣皂苷元的工艺进行优化,为今后从盾叶薯蓣培养物中有效制备薯蓣皂苷元和高通量分析样品中薯蓣皂苷元的含量创造了条件。
1 Huang YH(黄亚辉),Sheng XB(盛孝邦 ).Progress and prospect on botanical research ofD ioscorea zingiberensis.Chin J Chin MaterMed(中国中药杂志),2005,30:1805-1808.
2 Ding ZZ(丁志遵),Tang SR(唐世蓉),Qin HZ(秦慧贞).Medicinal Plants for Producing Steroid Ho rmones(甾体激素药源植物).Beijing:Science Press,1983.95.
3 Li JC(李军超),Li XM(李向民),Guo XS(郭晓思),et al.Advances in study ofD ioscoreazingiberensis.Acta Bot Borea1-Occident Sin(西北植物学报),2003,23:1842-1848.
4 Wang FZ(王凤芝),Liu J(刘娟 ).Different extractmethods of diosgenin.Helongjiang Med Pha rm(黑龙江医药科学),2006,29:22-23.
5 Hua HJ(华怀杰 ),Zhong SA(钟世安 ),Wang Y W(王炎伟),et al.A new technology for extracting diosgenin fromD ioscorea zingibersis.Nat Prod ResDev(天然产物研究与开发),2007,19:306-308.
6 Zhu X(朱宪 ),Wang Z W(王振武),Guo XY(郭晓亚 ).Technology of diosgenin production by dioscin hydrolysis in subcriticalwater.J Chem Eng Chin Univ(高校化学工程学报),2007,21:122-125.
7 Han F(韩枫 ),LiWH(李稳宏 ),LiD(李冬 ),et al.Extraction of diosgenin fromD ioscorea zingiberensis.Chin Tradit PatentMed(中成药),2007,29:1765-1768.
8 ZhangWG(张惟广),Ren Y(任雁).Study on the extraction of Chinese yam with direct fermentation.Sichuan Food Ferment(四川食品与发酵),2008,44:31-35.
9 Wang YL(王元兰),Li SF(李水芳 ),Yang Z(杨志).A new technology for extracting diosgenin fromD ioscorea zingiberensis.Econom ic Forest Res,2002,20:67-68.
10 Wang J(王俊),Chen J(陈钧 ),Yang KD(杨克迪 ),et al.Research on etraction of diosgenin by original spot hydrolyzedninhydrin.Chin J Chin MaterMed(中国中药杂志),2003,28:934-936.
11 Zhang LM(张黎明 ),Zhang LY(张露亿 ),Du LX(杜连祥).Technology for extracting diosgenin from seeds ofTrigonella foenum-graecumthrough enzymatic hydrolysis.T CSAE(农业工程学报),2005,21:161-164.
12 ZhangLM(张黎明),Xu W(徐玮).Research on ultrasonic cracking glycoside bond of dioscin fromD ioscorea nipponicaMakino.Nat Prod Res Dev(天然产物研究与开发),2007,19:286-289.
13 Jiang ZQ(蒋中权),Wang YH(王元华),Zhou C(周超).Hydrolysis technology for diosgenin preparation fromD ioscorea zingiberensis(一种利用黄姜加工皂素的水解工艺).CN200510018646.3,2005-4-27.
14 Zhu Y,Ni J,HuangW.Process optimization for the production of diosgenin withTrichode rma reesei.B ioprocess B iosyst Eng,2010,33:647-655.
15 Yuan SJ(袁 绍杰 ),Liang YL(梁艳丽 ),Zhao QS(赵 庆生),et al.The research progress of theD ioscorea zingiberensisW right.Southwest China J Agr Sci(西南农业学报),2004,17(S):355-358.
16 Zhou L,Wu J.Development and application of medicinal plant tissue cultures for production of drugs and herbal medicinals in China.Nat Prod Rep,2006,23:789-810.
17 Zhang RF(张瑞芬),Li PQ(李培琴),Zhao JL(赵江林),et al.Endophytic fungi fromD ioscorea zingiberensisand their effects on the growth and diosgenin production of the host plant cultures.Nat Prod Res Dev(天然产物研究与开发),2010,22:11-15.
Acidolysis Preparation of Diosgen in at High Pressure from the Cultured Plantlets of Dioscorea zingiberensis
Y IN Chun-hui,LI Pei-qin,ZHAO Jiang-lin,SHAN Ti-jiang,HE Gui-ling,ZHOU Li-gang*
College of Agronomy and B iotechnology,China AgriculturalUniversity,Beijing 100193,China
R931.71;Q949.9
A
1001-6880(2011)01-0114-04
2010-07-05 接受日期:2010-09-09
北京市自然科学基金 (6092015);国家自然科学基金(30871662,31071710)
*通讯作者 Tel:86-10-62731199;E-mail:lgzhou@cau.edu.cn
