植物液泡膜阳离子/H+反向转运蛋白结构和功能研究进展
2011-09-29张玉秀彭晓静柴团耀张春玲刘金光
张玉秀,彭晓静,柴团耀,张春玲,刘金光
1 中国矿业大学 (北京) 化学与环境工程学院,北京 100083
2 中国科学院研究生院 生命科学学院,北京 100049
3 河北维尔康制药有限公司,石家庄 050031
植物液泡膜阳离子/H+反向转运蛋白结构和功能研究进展
张玉秀1,彭晓静1,柴团耀2,张春玲3,刘金光1
1 中国矿业大学 (北京) 化学与环境工程学院,北京 100083
2 中国科学院研究生院 生命科学学院,北京 100049
3 河北维尔康制药有限公司,石家庄 050031
阳离子转运蛋白在调节细胞质阳离子浓度过程中发挥关键作用。液泡是一个储存多种离子的重要细胞器,阳离子 (Ca2+)/H+反向转运蛋白CAXs定位在液泡膜上,主要参与Ca2+向液泡的转运,也参与其他阳离子的转运。近年来,植物中分离鉴定了多个CAX基因,植物CAXs主要有4个功能域:NRR通过自抑制机制调节Ca2+转运活性,CaD和C功能域分别赋予CAXs的Ca2+和Mn2+专一性转运活性,D功能域可调节细胞质pH。拟南芥AtCAXs参与植物的生长发育和胁迫适应过程,AtCAX3主要在盐胁迫下转运Ca2+,AtCAX2和AtCAX4在重金属胁迫下参与重金属离子 (Cd2+、Zn2+和Mn2+) 的转运和解毒过程,表明CAXs基因在强化植物营养和提高植物修复潜力方面有重要作用。以下主要综述植物CAXs的分类、结构及功能方面的研究进展。
CAXs,结构,功能,重金属
Abstract:Cation transporters play important roles in modulating the concentration of intracellular metal ions. The vacuole is an important storage organelle for many ions. Cation (Ca2+)/H+antiporters (CAXs) located at vacuolar membrane are mainly involved in the Ca2+flux into the vacuole, and appear to be capable of transporting various divalent cations to some degree.Several CAX genes have been isolated and characterized from various plants in recent years. Four domains of plant CAXs have been identified: NRR regulates Ca2+transport by a mechanism of N-terminal autoinhibition; Ca domain and C domain confer Ca2+and Mn2+specificity among CAX transporters, respectively; D domain plays a part in the regulation of cytosolic pH. AtCAXs identified in Arabidopsis thaliana are involved in the growth, development and stress adaption of plant. AtCAX3 is the mainly Ca2+/H+transporter in response to salt stress; AtCAX2 and AtCAX4 participate in transportation and detoxicification of heavy metal ions (Cd2+, Zn2+, and Mn2+) in cells under heavy metal stress, and impact root/shoot Cd partitioning in plant. These suggest that CAX genes may be useful for nutritional enhancement of plants, and for increasing phytoremediation potential. Here, the classification, structure and function of CAXs in plants are reviewed.
Keywords:CAXs, structure, function, heavy metal
Ca2+是细胞结构组分,又是多种酶的辅助因子和许多细胞代谢过程的信使分子。细胞质中的 Ca2+是植物生理代谢的枢纽,其浓度的变化参与调节植物生长和对环境的适应性过程。Ca2+缺乏导致植株叶片坏疽,产量降低,甚至死亡;相反,Ca2+浓度过高,胞内Ca2+平衡破坏,引起Ca2+中毒,磷代谢受到干扰。植物细胞内存在精细的 Ca2+浓度调节机制,既能使细胞质中游离Ca2+浓度迅速升高以响应环境变化,又能使其维持基础条件下的低浓度,这种精细的调节机制主要是通过体内 Ca2+转运系统实现的。Ca2+转运系统包括Ca2+通道、Ca2+-ATPase (Ca泵) 和 Ca2+/H+反向转运蛋白 (Cation (Ca2+)/H+antiporter) 等,Cation (Ca2+)/H+反向转运蛋白又称为阳离子交换器 (Cation (Ca2+)/H+exchanger,CAXs)。液泡是细胞存储 Ca2+的主要细胞器,Ca2+的Ca2+-ATPase和具有高效转运能力的 Ca2+/H+反向转运蛋白均定位在液泡膜上,通过水解ATP供能可将细胞质 Ca2+转运到液泡中,从而可部分地调控细胞质的 Ca2+水平[1]。
酿酒酵母 Saccharomyces cerevisiae的 Ca2+/H+反向转运蛋白 (VCX1) 属于 CAX家族,负责向液泡转运Ca2+;酵母突变株K667液泡缺失Ca2+-ATPase(PMC1) 和VCX1,因此表现Ca2+转运缺陷,对Ca2+敏感性增强,不能在高浓度Ca2+(≥100 mmol/L) 培养基中生长[2]。模式植物拟南芥Arabidopsis thaliana的AtCAX1和AtCAX2可抑制酵母突变株K667的Ca2+转运缺陷,是首次被鉴定的植物CAX家族蛋白[3]。CAX广泛存在于古生菌、细菌和真核生物[4]。植物CAXs定位于液泡膜,由质子泵H+-ATPase或H+焦磷酸酶 (Pyrophosphatase) 形成的pH梯度驱动将细胞质中的多种金属阳离子输入到液泡中,使胞质的金属离子维持在合适的浓度范围[3,5]。目前,已鉴定了多种植物CAX基因,如拟南芥AtCAX1-6、水稻Oryza sativa的OsCAX1-4、绿豆Vigna radiate的VCAX1、玉米Zea may的ZmHCX1和ZmCAX2、大豆Glycine max的GmCAX1和绿藻Chlamydomonas reinhardtii的 CrCAX1-2等,多数研究主要集中在AtCAX1-4。植物 CAXs除具有 Ca2+反向转运活性外,还能转运其他金属离子,如 AtCAX2可转运Mn2+和 Cd2+,CrCAX1 和 AtCAX4 能转运 Cd2+等[6-8]。过量表达 CAXs可提高植株的 Ca2+、Cd2+或 Mn2+等金属离子耐受性和累积能力[2,9-10]。
土壤重金属污染,尤其是Cd、Mn和Pb污染问题日益严重,重金属不仅能毒害植物,导致生理代谢紊乱,产量和品质降低[1,11],而且能通过食物链的富集作用威胁人类的健康。重金属累积植物可通过吸收和累积重金属清除土壤中的重金属离子,其中重金属转运蛋白在重金属离子的吸收、转运和解毒方面发挥重要作用。CAXs可转运重金属 Mn和Cd[7-8],为提高植物的重金属耐受性、增强土壤重金属污染的植物修复能力和强化食物营养元素带来了曙光。近年来,植物 CAXs的结构、功能和金属离子转运特性等研究取得了很大进展。本文主要综述了植物 CAXs的分类、结构、功能及其在重金属累积植物中作用的研究进展。
1 植物CAXs的分类和在细胞组织中的分布
1.1 植物CAXs的分类
生物体中有多个CAX,为了研究其结构与功能的关系,根据 CAXs的序列和结构相似性对其进行归类分析。利用来源于细菌、真菌、植物、低等脊椎动物 (鱼和两栖动物) 的138个全长的CAX序列构建进化树,分析表明CAXs可分为3个类型,其中 I型 CAXs包括植物以及部分真菌和细菌的CAXs,I型CAXs又可分为8个亚型 (A-G)。虽然不同进化分枝的保守氨基酸重复序列 (c-repeat) 略有不同,但 A亚型 CAXs的第 4跨膜功能域(Transmembrane domain 4,TM4) 后面均含有高亲水氨基酸区域,其中含有多个带正电荷的氨基酸残基,与TM6和TM7之间的酸性氨基酸基序不同[12]。我们在GenBank中搜索了来源于水稻、拟南芥、玉米、绿豆、绿藻以及酵母等的17个CAXs的氨基酸序列,ClustalX2分析显示 (图 1),CAXs分为4个进化分支,酵母VCX1和绿藻CrCAX分别为独立的F亚型和C亚型,高等植物拟南芥、水稻、玉米和绿豆等CAXs形成另外两大进化分支:A亚型和B亚型,其中拟南芥 (AtCAX1、AtCAX3和AtCAX4)、水稻(OsCAX1a、OsCAX1b 和 OsCAX1c)、绿豆 (VCAX1)和玉米 (ZmHCX1) 属于 A亚型;而拟南芥AtCAX2、AtCAX5和 AtCAX6与水稻 OsCAX2、OsCAX3和OsCAX4属于B亚型,与Shigaki等[12]的分类结果相似。在A亚型CAXs中,双子叶植物绿豆VCAX1与拟南芥AtCAX1的序列一致性为68%;禾本科单子叶植物玉米ZmHCX1与水稻 OsCAX1b序列一致性为 77%;而单子叶植物 OsCAX1a、OsCAX1b、OsCAX1c和 ZmHCX1与双子叶植物AtCAX1的序列一致性分别为63%、62%、57%和64%,表明双子叶植物和单子叶植物的 CAXs差异性较大。A亚型中的AtCAX1主要参与Ca2+转运,而AtCAX3和AtCAX4分别参与盐胁迫和Cd2+转运的。在 B亚型 CAXs中,AtCAX5和 AtCAX6与AtCAX2的一致性分别为87%和82%,OsCAX2、OsCAX3和OsCAX4与AtCAX2的序列一致性均高达 70%。拟南芥 AtCAX2的 CAF氨基酸残基赋予其Mn2+转运特性,而AtCAX5和AtCAX6也均含有CAF残基,推测二者可能也参与Mn2+转运[13],所以这3个CAX同归为B亚型。尽管水稻OsCAX2、OsCAX3和OsCAX4与AtCAX2的氨基酸序列一致性较高,但其转运特性未见报道。绿藻CrCAX1和CrCAX2与酵母Ca2+转运VCX1的序列一致性分别为43%和42%,然而CrCAX1同时具有Ca2+和Na+转运作用[6]。从进化树分析得知 CAXs是一种进化上保守的蛋白质,主要参与 Ca2+转运,同时也可转运其他多种金属阳离子。
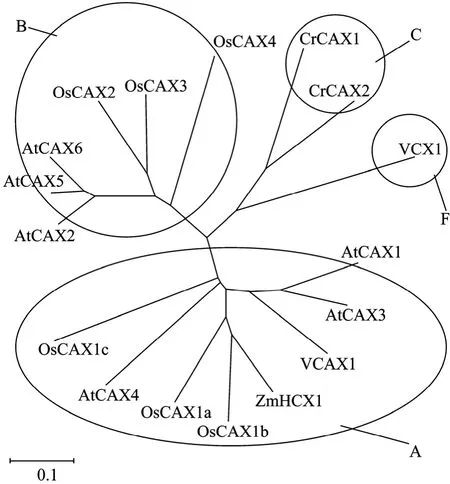
图1 植物CAXs的分类Fig. 1 Classification of CAXs in plants.
1.2 CAXs在植物组织器官中的表达和定位
AtCAX1是细胞内 Ca2+水平的重要调节器[1]。AtCAX1-GUS (β-glucoronidase) 融 合 表 达 显 示AtCAX1主要在叶片、花组织、以及子叶和幼叶的维管细胞中表达,在根、茎表达较少;全长的AtCAX1(Long AtCAX) 和缺失 N-端调节区 (N-terminal regulatory region,NRR) 36个氨基酸 (aa) 的AtCAX1(short AtCAX,sAtCAX) 在50 mmol/L CaCl2时均可抑制酵母突变株 K667对 Ca2+的敏感性[14],且表达sAtCAX1的转基因烟草液泡的Ca2+/H+反向转运活性增加[1]。红细胞凝集素 (Hemagglutinin,HA) 标记的全长的 AtCAX1 (HA-AtCAX1) 和 NRR缺失的sAtCAX1 (HA-sAtCAX1) 在酵母中异源表达,蛋白质印迹 (Western blotting) 分析表明 AtCAX1和sAtCAX1均定位在酵母的液泡膜上[15]。免疫分析也进一步证实HA-sAtCAX1和AtCAX1均定位于拟南芥和烟草的液泡膜,排除了AtCAX1位于内质网和叶绿体的可能性[16]。绿藻 CrCAX1-GFP (Green fluorescent protein,GFP) 和 sCrCAX1-GFP融合表达显示CrCAX1定位于液泡膜上[6]。表明 CAX1定位于液泡膜上,具有向液泡转运Ca2+作用,且NRR不影响其定位。
Northern杂交表明在拟南芥所有组织中的AtCAX2 mRNA水平均低于AtCAX1[9]。AtCAX2-GUS融合表达表明AtCAX2主要在10 d苗龄拟南芥的叶片维管组织、顶端分生组织、根部维管组织及根尖表达;在30 d的幼苗中,AtCAX2主要在叶柄、叶片维管组织、叶片水孔 (Leaf hydathodes) 及花组织中表达[7]。蛋白质印迹分析显示 AtCAX2定位于野生型拟南芥的液泡膜[9]。AtCAX3与AtCAX1的序列一致性为 78%,然而,AtCAX3主要在根部表达,尤其是根尖,而在叶片及茎组织中很少,幼花芽和花中也观察到 AtCAX3的表达[14],表明 AtCAX1和AtCAX3表达的组织部位特异性不同。免疫印迹分析显示HA-AtCAX3在拟南芥和烟草的液泡膜表达,而不是定位在内质网中[14],与AtCAX1在细胞中的定位序列一致。AtCAX4与AtCAX1、AtCAX2和AtCAX3的一致性分别为 53%、42%和 54%,AtCAX4的mRNA水平很低,在所有组织中都检测不到,但幼苗经 Mn2+、Na+或 Ni+处理后其 mRNA水平提高。蛋白质印迹结果显示 HA-AtCAX4定位于酵母液泡膜;烟草悬浮细胞免疫显色结果显示与 HA抗体和二级抗体德克萨斯红 (Texas red) 结合的HA-AtCAX4在液泡膜上生成红色荧光信号,表明AtCAX4也定位于液泡膜[8]。
2 CAXs的结构和功能域
CAXs是跨膜蛋白 (图 2),酵母和植物 CAXs有11个TM,N-端位于细胞质,C-端位于液泡中。TM6和TM7之间的一个酸性氨基酸基序将CAX分成大约相等的两部分;TM3与TM4、TM8与TM9之间均含有与离子转运专一性有关的两个保守氨基酸重复序列 (c-1和c-2)[12,17]。CAXs有4个典型的功能域 (图 2):N-末端自抑制区域 NRR、Ca2+功能域 (CaD)、C功能域和D功能域,并确定了起作用的关键氨基酸。NRR调控CAXs的Ca2+/H+反向转运活性,且只有在 N-端的依赖调节区域 (Regulationdependent region,RDR) 存在时才能抑制 AtCAX1的Ca2+转运活性[15,18-19],CaD决定CAXs的 Ca2+转运能力[20],C功能域与AtCAX2的Mn2+专一性转运相关[13],D功能域调节胞质的pH[21]。
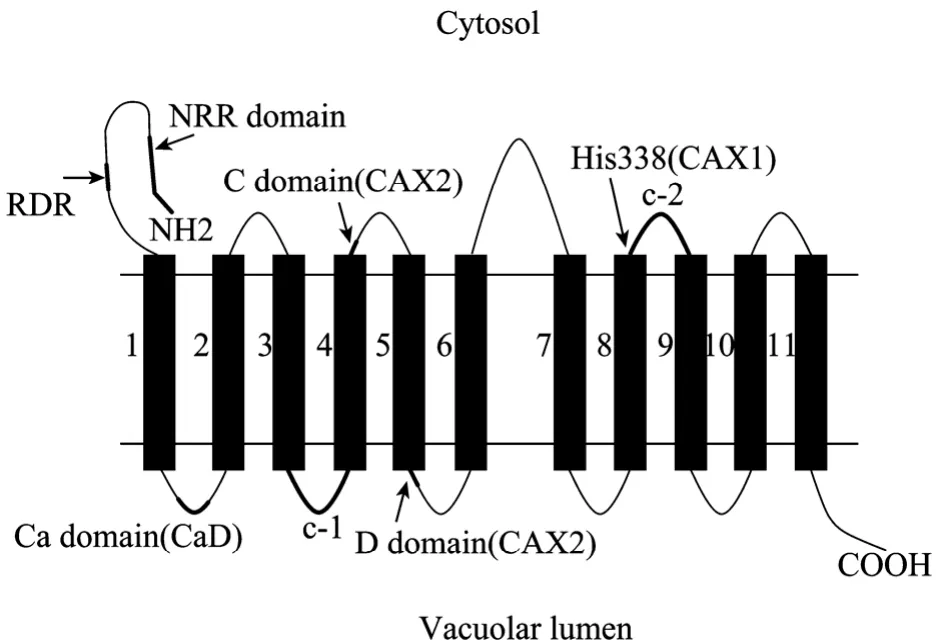
图2 CAXs的拓扑结构Fig. 2 Topology model of CAXs.
2.1 NRR功能域
AtCAX1的 NRR功能域调节其 Ca2+/H+反向转运活性。表达序列标签 (Expressed sequence tag,EST) 分析表明AtCAX1的N-端比VCX1多36 aa,命名为N1-36或NRR (图2)。AtCAX1在液泡膜的定位与NRR无关[6,14-15]。sAtCAX1可抑制酵母突变株 K667对高浓度 Ca2+的敏感性,而全长 AtCAX1无此功能,说明 NRR可通过 N-末端自抑制机制调节AtCAX1的Ca2+/H+反向转运活性[15]。
合成肽AtCAX1-NRR与AtCAX1的NRR序列一致,可专一性地抑制sAtCAX1的Ca2+/H+反向转运活性,却不能抑制 sAtCAX2、VCX1和sAtCAX3-9的Ca2+/H+反向转运活性,说明NRR功能域的抑制作用具有专一性。将sAtCAX1的前1/4区域 (37-149 aa,A区域) 融入到sAtCAX3的阅读框中,获得sAtCAX3-A融合肽,其Ca2+/H+反向转运活性可被AtCAX1-NRR抑制;含有CaD (9 aa,位于A区域的后半段) 的sAtCAX1反向转运活性可被AtCAX1-NRR抑制;然而,AtCAX1的CaD分别与sAtCAX3和 sAtCAX2融合得到 sAtCAX3-9和sAtCAX2-9融合肽,其反向转运活性不受AtCAX1-NRR影响,说明与 NRR相互作用的区域位于A区域的前半段,而非CaD。将sAtCAX1的A区域进一步分成A1 (37-73 aa) 和A2 (74-149 aa) 两个区域,AtCAX1-NRR不能抑制融合肽sAtCAX3-A2 (sAtCAX1的A2取代sAtCAX3相应的区域) 和 sAtCAX1-A1 (sAtCAX3的 A1取代sAtCAX1相应的区域) 的Ca2+反向转运活性,表明A1区域是AtCAX1-NRR抑制AtCAX1反向转运活性的关键区域[18]。
AtCAX1中的NRR与RDR相互作用可调节其Ca2+转运活性 (图 3)。氨基酸序列比对分析表明AtCAX1的A1有V50I51和Y56K57G58L59K60D61F62(7 aa) 2个异质性区域,其序列与AtCAX3的A1区域不同。将sAtCAX3-9 (含有AtCAX1 CaD的9 aa)和sAtCAX1-A1的L50V51定点突变为AtCAX1的A1的 V50I51后,两种突变蛋白均可转运 Ca2+,但其反向转运活性不受 AtCAX1-NRR的影响。将sAtCAX3-9和sAtCAX1-A1的C56K57T58L59K60N61I62定点突变为AtCAX1的A1中的Y56K57G58L59K60D61F62序列,突变的 sAtCAX3-9-7aa和 sAtCAX1-A1-7aa均有Ca2+转运活性,且能被AtCAX1-NRR抑制,说明A1的7 aa序列是NRR抑制AtCAX1反向转运活性的关键氨基酸。AtCAX1的7 aa序列被AtCAX3的取代后 (AtCAX1-7aa),可以抑制酵母突变株K667的 Ca2+敏感性,但其活性低于 sAtCAX1;sAtCAX1的 7 aa序列被 AtCAX3的 7 aa取代后(sAtCAX1-7 aa),其抑制酵母突变株K667的Ca2+敏感性与sAtCAX1的活性一致,但其反向转运活性不受AtCAX1-NRR的影响。这些结果表明RDR的7 aa残基 Y56K57G58L59K60D61F62是 AtCAX1自抑制发生所必需的,即只有 RDR存在时,AtCAX1-NRR才能抑制 Ca2+的转运。酵母双杂交系统 (Yeast two-hybrid assay) 分析显示 (图3) NRR的5个氨基酸残基 Ser25、Arg26、Arg29、Arg32和 Thr33在与 RDR相互作用中发挥重要作用。当受刺激时,AtCAX1的NRR构象发生变化,可阻止NRR与RDR的相互作用,从而激活AtCAX1的反向转运活性;NRR缺失时 (sAtCAX1),蛋白质从 Met37开始翻译,不能与RDR相互作用,致使反向转运蛋白sAtCAX1一直处于活化状态[18]。
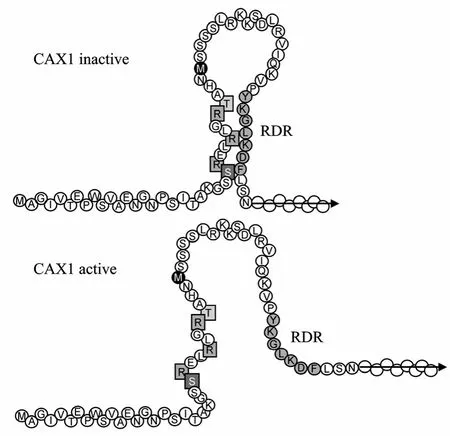
图3 NRR调节AtCAX1的模型[18]Fig. 3 Model of CAX1 regulation by the NRR[18].
NRR的磷酸化参与调节AtCAX1的Ca2+反向转运活性。AtCAX1的NRR有5个可能的磷酸化位点,如 Thr6、Ser10、Ser24、Ser25和 Thr33,这些氨基酸的定点突变可以抑制其磷酸化作用,导致AtCAX1失活。将这5个氨基酸分别定点突变为Ala (A),突变株分析表明只有T33A (Thr定点突变为Ala) 突变的AtCAX1可以强烈抑制酵母突变株K667的Ca2+敏感性,说明Thr33的磷酸化可降低K667突变株对Ca2+敏感性。进一步将Thr33定点突变为Asp (T33D) (模拟连续磷酸化) 以及T33S和T33E,这些突变均可使酵母菌株 K667在高浓度 Ca2+环境中生长,表明Thr33在自抑制作用中主要受其结构的影响,而非磷酸化作用。S25A突变仅能微弱地抑制K667酵母的Ca2+敏感性,S25T则不能;但模拟连续磷酸化的S25D突变体与sAtCAX1一致,可以有效抑制酵母突变株K667的Ca2+敏感性。S10D和S24D的突变都不能抑制酵母突变株 K667的 Ca2+转运缺陷。因此,AtCAX1的Ser25磷酸化可激活其Ca2+转运活性。不带电荷的Ala取代Arg残基时,AtCAX1被激活,因此,带正电荷的Arg残基也参与自抑制机制[18]。
信号分子 CXIP4 (CAX interacting proteins 4)是拟南芥细胞核蛋白,可调节 AtCAX1的 Ca2+/H+反向转运活性。CXIP4与AtCAX1的NRR结合,可阻止 AtCAX1自抑制作用,从而激活 AtCAX1的Ca2+/H+反向转运活性。CXIP4基因只存在于植物中,编码一个由332 aa组成的分子量约为37.8 kDa的多肽,CXIP4富含Arg (15.1%)、Lys (11.1%)、Glu(11.7%) 和 Ser (15.4%)。MotifScan显示 CXIP4的N-端有一个锌指基序 (CCHC),C-端有一富含 Arg的区域,在酵母中可激活AtCAX1的Ca2+/H+反向转运活性。研究表明CXIP4或AtCAX1在酵母突变株K667中单一表达均不能抑制其液泡Ca2+转运缺陷,然而,CXIP4+AtCAX1共表达时酵母突变株K667可在 200 mmol/L CaCl2的培养基中生长,其 Ca2+/H+反向转运活性是 sAtCAX1突变株的 10%,表明CXIP4可激活 AtCAX1的 Ca2+/H+反向转运活性。CXIP4只能激活 AtCAX1的 Ca2+转运活性,而对AtCAX2、AtCAX3和 AtCAX4无作用,然而,CXIP4能激活含有AtCAX1-NRR的AtCAXs融合体的 Ca2+转运活性,说明 CXIP4与 AtCAX1的相互作用位点位于 NRR功能域。sAtCAX3-A1 N-端的A1区域来源于 AtCAX1,但 sAtCAX3-A1+CXIP4与 AtCAX1+CXIP4抑制酵母突变株的 Ca2+敏感性的能力不同;保持有自抑制能力的、NRR突变的AtCAX1和CXIP4共表达时,一些突变可抑制酵母突变株的 Ca2+敏感性,另一些突变则不能,表明AtCAX1的NRR有多个区域参与CXIP4的激活作用[22]。
氨基酸序列分析显示 NRR普遍存在于 CAXs中,VCAX1、AtCAX2、AtCAX3、AtCAX4以及CrCAX1都含有相似的 NRR序列[6,19],CrCAX1仅能轻微地抑制酵母突变株 K667的 Ca2+敏感性,然而,在 200 mmol/L CaCl2浓度下,sCrCAX1与sAtCAX1一样能有效抑制酵母突变株K667的Ca2+敏感性[6]。AtCAX1和AtCAX3的NRR的氨基酸序列 (36 aa) 有 24个完全相同,但 AtCAX3和sAtCAX3都不能抑制酵母突变株 K667对高浓度Ca2+的敏感性。AtCAX4也不能抑制酵母突变株K667的Ca2+敏感性,然而,N-端融合体HA-AtCAX4与sAtCAX1一样,可有效地抑制酵母突变株K667液泡的 Ca2+转运缺陷。sAtCAX4或融入 AtCAX1 CaD序列的AtCAX4均可轻微地抑制酵母突变株转运Ca2+的缺陷;融入AtCAX1 CaD的sAtCAX4与sAtCAX1活性一样,能有效抑制酵母突变株Ca2+转运缺陷,表明CAXs可能是通过改变N-端构象调节Ca2+转运活性[8]。
CAXs的 NRR精确的调节机制存在差异。AtCAX2的N-端有2个Met残基。N-端缺失前42 aa的sAtCAX2可抑制酵母突变株K667的Ca2+和Mn2+敏感性,N-端缺失前16 aa的sAtCAX2与AtCAX2一样,不能抑制酵母突变株K667的Mn2+和Ca2+敏感性;而N-端不完整的AtCAX1可抑制酵母突变株K667的 Ca2+敏感性[15]。AtCAX3的 NRR 序列与AtCAX1高度一致,但其调节功能与后者存在差异。在50 mmol/L CaCl2培养基中,表达sAtCAX3的酵母突变株与空载体对照株系的生长状况相似,表达AtCAX3的酵母突变株的生长虽然较差,但优于对照株系。AtCAX3的NRR定点突变后能抑制sAtCAX1的Ca2+转运活性。AtCAX3的NRR与sAtCAX1构建的融合体3N:sAtCAX1可抑制酵母突变株的Ca2+敏感性,将 A17N18V19定点突变为 P17S18I19(3N-3:sAtCAX1),仍可抑制酵母突变株的 Ca2+敏感性;将His30突变为Leu (3N-1:sAtCAX1) 则不能抑制酵母突变株的 Ca2+敏感性。绿豆 VCAX1也有一个长的疏水的N-末端,其NRR与AtCAX1的相似性较低,在31 aa中只有18个相同。VCAX1虽没有sAtCAX1作用显著,但也可以抑制酵母突变株K667的 Ca2+敏感性,敲除 N-端前 31 aa的 VCAX1(sVCAX1) 与 sAtCAX1一样,能有效地抑制 K667的Ca2+敏感性,其活性比全长VCAX1提高了70%。与AtCAX1相比,VCAX1的NRR的C端有3个异质性区域:Pro16之后缺失 SITA,V18L19T20和M23R24H25序列分别取代了 AtCAX1的 G18S19S20和L23R24L25序列。只有将VCAX1 中NRR的M23R24H25定点突变为 L23R24L25时,VCAX1的 NRR和sAtCAX1融合肽VN:sAtCAX1才不能抑制酵母突变株 K667的 Ca2+敏感性。3N:sAtCAX1和VN:sAtCAX1的定点突变研究表明AtCAX1的Leu30在其自抑制中发挥重要作用。AtCAX1-L30H (Leu30突变为His) 和 sAtCAX1同样能有效抑制酵母突变株的Ca2+敏感性。每一种Ca2+转运蛋白的调节功能域均有特定的作用方式,功能域间的微小差异都会影响其抑制活性,VCAX1和AtCAX1的Ca2+转运活性差异可能是由于N-端自抑制区域结合的紧密性不同引起的[19]。
2.2 Ca功能域 (CaD)
AtCAX3与AtCAX1有78%的一致性。AtCAX3和sAtCAX3均不能抑制酵母突变株K667对高浓度Ca2+的敏感性。构建的 sAtCAX1和 sAtCAX3融合体呈现不同的 Ca2+转运特性:sAtCAX3-A融合体(sAtCAX1的 N-端融入 sAtCAX3) 在酵母中可转运Ca2+;sAtCAX1-A 融合体 (sAtCAX3的 N-端融入sAtCAX1) 不能抑制酵母突变株的 Ca2+敏感性;sAtCAX1-β/sAtCAX1-γ 或 sAtCAX1-δ 融 合 体(sAtCAX3的中央或C-端序列融入sAtCAX1) 的Ca2+转运活性与sAtCAX1没有差异;相反,sAtCAX3-β/sAtCAX3-γ或 sAtCAX3-δ融合体 (sAtCAX1 的中央或 C-端融入 sAtCAX3) 不能抑制酵母突变株 K667液泡的Ca2+转运缺陷,表明N-端区域决定sAtCAX的Ca2+转运活性差异。将sAtCAX1的N-端分成α1(37-73 aa,即 A1) 和 α2 (74-149 aa,即 A2) 两部分,sAtCAXA3-A2 (sAtCAX1的 A2融入 sAtCAX3) 融合体可抑制酵母突变株 K667的 Ca2+敏感性;而sAtCAX3-A1 (sAtCAX1的A1融入sAtCAX3) 融合体在含 Ca2+的培养基中生长多天之后才有微弱的抑制酵母突变株的 Ca2+敏感性作用,因此,sAtCAX1的 A2区决定了 sAtCAX1和 sAtCAX3 的 Ca2+转运的绝大部分活性差异[20]。
AtCAX1 A2区域的 9 aa (87-95 aa) 在不同CAXs中变化较大。sAtCAX3-9融合体 (AtCAX1 A2区域的9 aa融入sAtCAX3) 只能转运Ca2+,其转运能力是sAtCAX1的36.5%,而sAtCAX1既可转运Ca2+,也能转运 Cd2+。sAtCAX2-9 (9 aa融入sAtCAX2) 的Ca2+运转活性是sAtCAX2的2倍,而Cd2+和Mn2+转运能力不变,进一步证实9 aa,即CaD对Ca2+转运的选择专一性[20]。
融入AtCAX1 CaD前3个氨基酸 (87-89 aa) 的sAtCAX3 (sAtCAX3-3) 可抑制酵母突变株K667液泡Ca2+转运缺陷,但活性变化没有sAtCAX3-9显著,在含Ca2+的培养基中生长2 d后才能观察到明显菌落;而融入sAtCAX1 中CaD的中间3个 (90-92 aa)或后3个氨基酸 (93-95 aa) 的sAtCAX3不能抑制酵母突变株的Ca2+转运缺陷,表明CaD的前3个氨基酸赋予 sAtCAX3的 Ca2+转运能力。融合表达sAtCAX3-3或sAtCAX3-6 (sAtCAX1中 CaD的前6个氨基酸分别融入sAtCAX3中) 的酵母Ca2+吸收能力是表达 sAtCAX3-9酵母的 60%,sAtCAX3-3和sAtCAX3-6的Ca2+转运能力没有差异。进一步改变sAtCAX3 CaD的前 3个和后 3个氨基酸,sAtCAX3-3X3 (sAtCAX3 CaD的前3个及后3个氨基酸与sAtCAX1的CaD相应的氨基酸序列一致) 不能抑制酵母突变株 K667液泡的 Ca2+转运缺陷,表明sAtCAX1的CaD中间3个氨基酸也是Ca2+转运必不可少的。sAtCAX3中CaD的单个或多个氨基酸突变不能赋予AtCAX3高水平的Ca2+转运能力,推测CaD中的氨基酸可能通过形成特定的结构单元发挥作用[20]。
AtCAX1中CaD的前3个氨基酸 (87-89 aa) 决定sAtCAX3的Ca2+转运能力。将sAtCAX3的87-89 aa定点突变为sAtCAX1相应的氨基酸 (L87I、A88C和 N89T),L87I赋予 sAtCAX3 (sAtCAX3-I) 的 Ca2+转运能力最强,是 sAtCAX1的 7.1%。虽然sAtCAX3-I抑制酵母K667的Ca2+敏感性能力明显不如sAtCAX3-9,但在Ca2+培养基生长2 d后可明显看到的突变株K667菌落,推测Ile可能与sAtCAX3跨膜功能域中特定的氨基酸侧链相互作用,协助Ca2+或H+配位。当sAtCAX3的L87突变为特定的脂肪族或中性氨基酸时,如 sAtCAX3-L87F、sAtCAX3-L87C、sAtCAX3-L87V和sAtCAX3-L87G,仍可使酵母突变株 K667在 Ca2+培养基中生长,且抑制酵母突变株的Ca2+敏感性能力与sAtCAX3-I突变株相等或降低;而突变为 sAtCAX3-L87A、sAtCAX3-L87S和sAtCAX3-L87E无Ca2+转运活性。尽管难以从以上研究中推断CaD的作用模式,但可肯定 L87不能自抑制,Ile也不是专一性转运活性所必须的。推测赋予sAtCAX3 Ca2+转运能力的CaD可能形成一种特定的三维结构,而抑制 sAtCAX3的CaD序列形成与之不同的结构[20]。
CaD以亲水环的形式将 TM1和TM2分开 (如图 2),但其调节 Ca2+转运的机制还不清楚。Ca2+结合或转运位点常常是酸性氨基酸,但CaD中没有酸性氨基酸,因此,CaD可能不直接与Ca2+结合,而是通过限制跨膜功能域的运动,使 Ca2+进入或被阻挡在“孔”外[20,23]。
2.3 C功能域
AtCAX2有较广泛的阳离子底物,AtCAX2转基
因烟草幼苗中Ca2+、Cd2+和Mn2+的累积增加,尤其是 Mn2+耐受性增强[9]。AtCAX2可抑制酵母突变株的 Mn2+转运缺陷,是 CAX家族中鉴定的唯一可以转运Mn2+的反向转运蛋白[9]。AtCAX1、AtCAX2、AtCAX3和 AtCAX4的氨基酸序列比对分析表明AtCAX2和AtCAX1有5个由9-15 aa组成的相似性很低的区域:A,AtCAX1的65-73 aa,起始于TM1;B,AtCAX1的150-160 aa,位于在TM3和TM4之间;C,AtCAX1的 175-184 aa,位于 TM4;D,AtCAX1的219-233 aa,位于TM5和TM6之间;E,AtCAX1的257-265 aa,位于TM6和酸性基序之间。AtCAX1、AtCAX3、AtCAX4和 VCAX1的 A、B、C以及 E区域差异不大,但D区域和AtCAX1的CaD相应的9 aa序列在不同CAX中相差很大。AtCAX1的A、B、C、D或E区域以及CaD分别融入AtCAX2中,AtCAX2-A、AtCAX2-B、AtCAX2-C、AtCAX2-D、AtCAX2-E以及AtCAX2-9融合蛋白都缺失NRR,AtCAX2和这些 AtCAX2融合体均能使酵母突变株K667在 200 mmol/L CaCl2培养基中生长;在250 mmol/L CaCl2的培养基中,表达 AtCAX2、AtCAX2-9、AtCAX2-C、AtCAX2-D 或 AtCAX2-E的酵母突变株生长状况相似,而表达AtCAX2-A或AtCAX2-B的酵母突变株生长减少;AtCAX1、AtCAX2-A、AtCAX2-B或AtCAX2-C在10 mmol/L MnCl2的培养基中,完全不能抑制酵母突变株的Mn2+敏感性,甚至在5 mmol/L MnCl2的培养基中仍没有作用;AtCAX2-A和AtCAX2-B的Ca2+/H+反向转运活性显著低于 AtCAX2,分别降低了 57.4%和33.4%;AtCAX2-C 的 Ca2+转运活性与 AtCAX2没有显著差异,但无Mn2+转运活性,出现Mn2+耐受性专一性缺陷;45Ca2+和54Mn2+同位素标记表明在含Ca2+和 Mn2+的培养基中,只有 AtCAX2能转运54Mn2+,AtCAX1和 AtCAX2-C不能;过量 Mn2+抑制 AtCAX2转运45Ca2+,而对AtCAX1和 AtCAX2-C无影响,表明AtCAX2的C功能域与Mn2+/H+反向转运活性有关[13]。
AtCAX2的C功能域 (6 aa) 可分成相等的C1和C2两部分 (3 aa),其序列与AtCAX1对应的氨基酸序列不同。AtCAX2-C2 (AtCAX1的 IAN取代AtCAX2的 LVF) 融合体与 AtCAX2一样,能有效抑制酵母突变株K667的Mn2+和Ca2+敏感性,特异性转运活性没有降低;AtCAX2-C1 (AtCAX1的TSL取代AtCAX2的CAF) 与AtCAX2-C一样,可抑制酵母突变株的Ca2+敏感性,Ca2+/H+反向转运活性也无差异,但在Mn2+培养基中不能生长,AtCAX2-C1无Mn2+/H+反向转运活性,因此,推测CAF残基赋予了AtCAX2 的Mn2+转运特性。AtCAX5、AtCAX6和ZmCAX2的C1区域都存在CAF残基,表明这些CAXs均可能转运Mn2+[13]。酵母VCX1 的C2区域是LCF残基,转运活性可能与AtCAX2更相似[13]。
2.4 保守序列c-1和c-2
CAXs有 11个跨膜区域,OsCAX1a暴露在细胞质中的 N-端有 59 aa组成的亲水序列,TM6和TM7之间有一个酸性基序;拟南芥和酵母 CAXs中也有相似的特征。缺失 NRR的 OsCAX1a(OsCAX1a27△) 具有Ca2+和Mn2+转运活性。OsCAX1a与 9个其他植物和酵母的 CAXs序列比对表明CAXs存在2个由36 aa组成的高度保守区域c-1 (GNX2EXIX4AX8VX4LGSXLSNXLXV) 和c-2 (GNAAEHX6AX5DX2LGX3GSX2QX3FX),二者有14个氨基酸相同,7个氨基酸在两个重复序列中都是保守的,相一致的序列为GNX2EX21GSX8[17]。
c-1位于 TM3和 TM4之间,c-2位于 TM8和TM9之间 (图2)。c-1和c-2的氨基酸定点突变结果显示:S155、S158、N159、G325、K339、T354和 S151与离子选择性有关;Gly128、Asn129、Glu132、Lys144、Lys149、Gly154、Asn326、Glu329、His330、Lys341、Gly351、Ser352和Gln355是OsCAX1a转运Ca2+和Mn2+必需的。将OsCAX1a27△的8个Cys定点突变为Ser (Cys缺失突变体),其仍然保持OsCAX1a-27△的功能结构,故可通过Cys点突变研究其结构。进一步在c-1及其边界区域定点突变引入19个Cys,其中12个突变株 (S105C、L113C、T118C、A130C、A136C、I145C、V148C、S150C、S158C、S170C、A178C和S187C) 在50 mmol/L Ca2+的液体培养基中生长虽有差异,但均可在200 mmol/L CaCl2的琼脂平板培养基中生长;而其余 7个突变株 (A139C、K142C、G143C、E146C、V147C、L153C 和 S155C) 缺失Ca2+的耐受性,表明c-1中的7个氨基酸 (A139、K142、G143、E146、V147、L153和 S155) 是酵母中 Ca2+转运或形成特定的结构必需的。同样,在c-2的25个Cys突变株中,14个突变株 (S317C、I335C、A337C、K339C、N340C、K341C、L342C、D343C、I344C、T345C、S352C、A353C、Q374C 和 D378C) 缺失Ca2+转运活性,表明这 14 个氨基酸 (S317、I335、A337、K339、N340、K341、L342、D343、I344、T345、S352、A353、Q374和D378) 可能与OsCAX1a的活性或形成四级结构有关[17]。
巯 基 试 剂 4-乙 酰 氨 基 -4’-2,2’-二 磺 酸 (4-acetamido-4’-maleimidylstilbene-2,2’-dis-ulfonic acid,AMS) 不能透过液泡膜,只能与面向细胞质一侧的Cys反应,而BM (3-(N-maleimidylpropionyl)-biocytin)可以穿透液泡膜与亲水区的Cys反应。用BM处理c-1和c-2突变株的液泡膜泡,只有S158C、S170C、S314C、A331C、L338C、S357C和S364C突变株没有被BM标记;若先与AMS反应,再与BM反应,则 c-1的 4个突变株 (T118C、I145T、A178C和S187C) 和c-2的4个突变株 (S308C、A333C、A349C和 T354C) 没有被 BM 标记,表明这 8个氨基酸(T118、I145、A178、S187、S308、A333、A349和 T354) 暴露在细胞质;而c-1的6个氨基酸 (S105、L113、A130、A136、V148和S150) 及 c-2的2个氨基酸 (G300和 G325)仍然可被BM标记,表明其暴露在液泡腔 (如图 4)。c-1中的4个保守氨基酸残基Glu132、Gly154、Ser155和 Asn159与 c-2的 4个保守氨基酸残基 Ala337、Asp343、Gly351和 Ser352也同样存在于动物 Na+/Ca2+转运蛋白NCX1、NCX2和CalX的保守序列α-1和α-2中。推测植物c-1和c-2可能与α-1和α-2一样,形成反向的跨膜的凹形环,c-1环从液泡腔一侧穿过膜,c-2环从细胞质一侧穿过液泡膜,在胞质一侧区域形成“离子过滤”结构,是Ca2+、Mn2+和H+的通道[17]。
2.5 D功能域
在质膜、液泡膜 H+-ATPase产生的电化学质子梯度驱动下,液泡膜 CAXs将细胞质中过量的Ca2+、Mn2+和 Cd2+等金属阳离子转运到液泡中,降低其对植物细胞的毒害。CAX的 Ca2+/H+反向转运活性受细胞质pH调节,sAtCAX2活性的最适pH较AtCAX1低。在 AtCAX2融合体 (sAtCAX2-A、sAtCAX2-B、sAtCAX2-C、sAtCAX2-D 和sAtCAX2-E)中,只有 AtCAX2-D (AtCAX1的 219-233 aa序列LKNGEASAAVLSDMQ替换了AtCAX2的221-231 aa序列THSEVHAGSSE) 改变了依赖pH的Ca2+/H+反向转运活性,其细胞质的 pH显著提高,与sAtCAX1依赖的pH值基本相同,表明sAtCAX2的D功能域在sAtCAX2依赖的pH的调节机制中发挥重要作用。sAtCAX2的D功能域 (221-231 aa) 是位于 TMD5、TMD6之间的一个亲水区域,而sAtCAX1相应的区域没有与之相同的氨基酸[5]。
His残基是氨基酸中结合H+、感知pH的完美候选者,AtCAX2的 D功能域有两个 His222和 His226残基,sAtCAX1的相应区域没有His。sAtCAX2中带正电荷的 His残基突变为不带电荷的非极性 Ala时,sAtCAX2-H222A、sAtCAX2-H226A和sAtCAX2-H222A/H226A酵母突变株与AtCAX2的酵母突变株相比,sAtCAX2-H226A能轻微地抑制突变株的Ca2+和 Mn2+敏感性,sAtCAX2-H222A或 sAtCAX2-H222A/H226A的酵母突变株均不能在含 Ca2+或Mn2+的培养基中生长,反向转运活性缺失,表明His222在sAtCAX2的阳离子/H+反向转运机制中有重要作用。进一步将 His222定点突变为带负电荷的酸性Asp (D) 和带正电荷的碱性Lys (K),由于Lys与 His222相似,所以,AtCAX2-H222K抑制酵母突变株的 Ca2+和 Mn2+敏感性能力与 sAtCAX2一致,而 sAtCAX2-H222D则无抑制能力。sAtCAX2-H222A 的 Ca2+/H+反向转运活性低于 sAtCAX2,sAtCAX2-H222K与 sAtCAX2的转运活性相当,sAtCAX2-H222D无转运活性,表明His222是Ca2+反向转运活性必需的。sAtCAX1、sAtCAX2、sAtCAX2-H222K和sAtCAX2-H222A的Ca2+/H+反向转运活性依赖的胞质pH值分析表明,sAtCAX2和sAtCAX2-H222A依赖的 pH值没有明显差异,sAtCAX1、sAtCAX2和sAtCAX2-H222K依赖的pH值显著不同。碱性条件下,sAtCAX2-H222K的 Ca2+/H+反向转运活稍高于 sAtCAX2,接近于 sAtCAX1,表明His222在感知和结合 H+中发挥作用,但不影响sAtCAX2的离子转运专一性[5]。
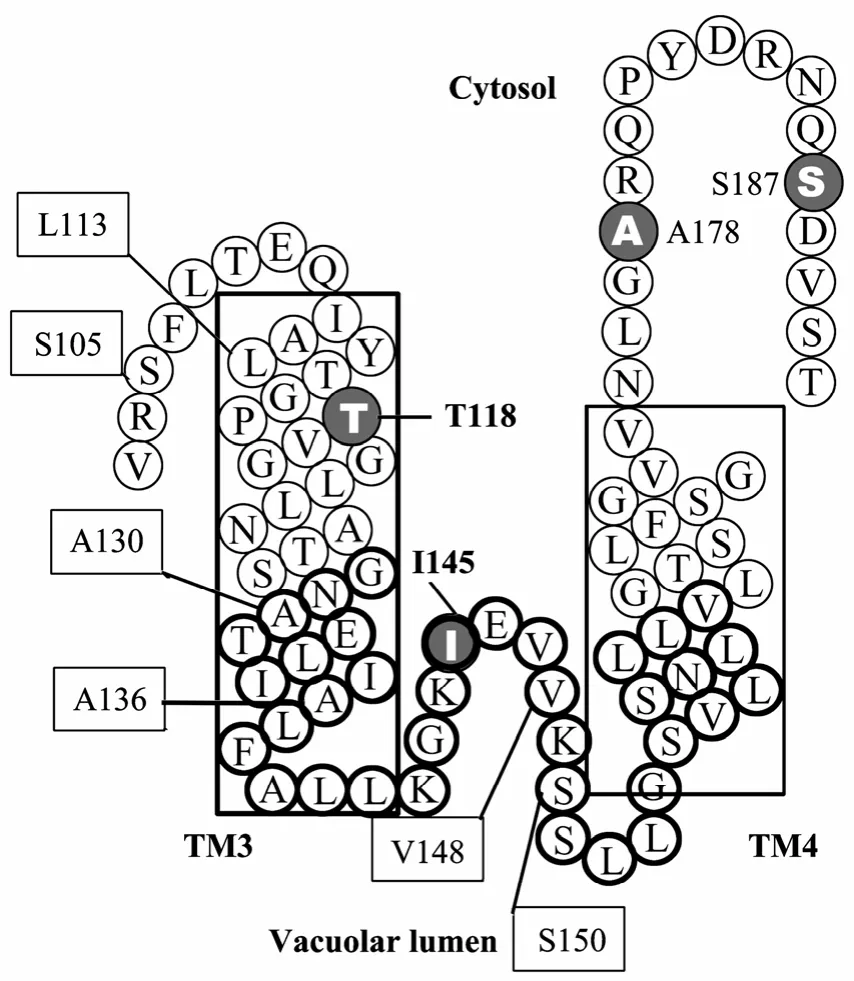
图4 c-1及其边界的拓扑模型[17]Fig. 4 Topological model of repeat c-1 and its borders[17]. The residues that are accessible from the cytosol are indicated by gray circles (Thr118, Ile145, Ala178, and Ser187) and those that are not accessible from the cytosol are boxed (Ser105, Leu113, Ala130,Ala136, Val148, and Ser150). Residues in repeat c-1 are boldly circled.
并非所有的CAXs的TMD5和TMD6之间的区域都有His222,如AtCAX1,但AtCAX1其他跨膜区域有 7 个 His (H35、H210、H259、H338、H412、H443和H446)。由于 His可以在分子内和分子间形成氢键,改变蛋白质的构象,影响蛋白质对离子的选择、转运作用。将这 7个 His分别定点突变为 Ala,只有H338A突变体无 Ca2+转运能力。AtCAX1的 His338在各种 CAXs中都是保守的,可能与离子的选择性有关。对 His338进行多种突变,只有 3个突变体(H338K、H338N和H338Q) 能轻微的抑制酵母突变株K667的Ca2+敏感性,如H338N突变株的Ca2+转运活性是sAtCAX1的25%;然而,H338N定点突变株AtCAX1-H338N的Cd2+、Zn2+转运能力提高,Km值降低,Vmax值不变或稍有变化,表明 His338是影响sAtCAX1转运动力学和离子专一性的关键氨基酸,这一结果为通过定点突变提高CAXs的 Cd2+转运能力提供理论依据[21]。
3 CAXs的功能
AtCAX1、AtCAX2因可抑制酵母突变株 K667液泡的 Ca2+转运缺陷而在植物中最先被鉴定[3]。AtCAX1是低亲和性、高容量的 Ca2+转运蛋白,其基因的表达受Ca2+的诱导,对维持植物体内Ca2+平衡有重要作用[16];AtCAX2有较广泛的底物,除Ca2+,还参与 Mn2+、Cd2+和 Zn2+的转运,是惟一能转运Mn2+的CAX[9];AtCAX3的表达受盐胁迫诱导,是盐胁迫下主要的 Ca2+/H+反向转运蛋白[24];AtCAX4不能抑制酵母突变株K667的Ca2+敏感性,但可抑制表达IRT1的酵母突变株的Cd2+敏感性[8],表明不同CAXs作用不同。CAX的表达或缺失不仅能引起植物表型变化[1-2],也能改变植物对离子的耐受性和累积能力[9-10]。
3.1 CAXs参与植物的生长发育
CAX1是植物主要的Ca2+/H+反向转运蛋白[16]。在200 mmol/L CaCl2处理下,sCrCAX1与sAtCAX1一样,可有效抑制酵母突变株K667的Ca2+敏感性[6]。在普通培养基中,拟南芥 cax1插入失活突变株cax1-1、cax1-2根发育受抑制,幼苗主根长约减少了11%,侧根数分别减少了25%、10%,侧根长分别减少了 50%、20%。sAtCAX1在 cax1-1植株中表达时根生长抑制表型消失[16]。表达sAtCAX1的转基因烟草根中Ca2+含量是对照植株的2倍,叶片中Ca2+含量提高30%,转基因烟草植株中每毫克sAtCAX1蛋白累积14 nmol Ca2+,而对照植株每毫克sAtCAX1蛋白仅累积7 nmol Ca2+;转基因植株根部液泡每毫克sAtCAX1蛋白累积16 nmol Ca2+,对照植株为14 nmol[1]。sAtCAX1转基因烟草植株在缺乏Ca2+的培养基中生长时,由于sAtCAX1将Ca2+主要储存在液泡中,胞质Ca2+浓度过低,需要Ca2+的部位得不到补充,因此,烟草植株出现 Ca2+缺乏症状,如叶片坏疽、萎蔫,根生物量减少,生产力下降;若在培养基中添加Ca2+,可延迟或缓解Ca2+缺乏症状,甚至可使叶片的表型恢复正常[1]。过量表达sAtCAX1的转基因番茄 (TCX1) 植株液泡的Ca2+转运活性增加,叶片坏疽,并且因胞质 Ca2+缺乏引起的果顶软腐病几率升高。但由于大量 Ca2+累积在液泡中,TCX1果实坚实度降低延缓,货架期延长。收获40 d后,TCX1果实仍能保持其结构的完整性,而对照果实则显著皱缩;即使在腐烂期30 d后,TCX1果实的坚实度仍是对照的2倍[2]。
AtCAX2虽可抑制酵母突变株 K667液泡 Ca2+转运缺陷,但其转运Ca2+能力低于AtCAX1[5,9]。拟南芥 AtCAX2敲除突变株cax2-1和cax2-2的萌发、生长和开花时间、及根、茎、叶和花的形态与野生植株没有明显差异。在过量 Ca2+、Mn2+、Cd2+、Zn2+、Na+、Mg2+或 K+胁迫下 (不含 Ca2+),cax2 植株的表型与野生型一致[7],表明 AtCAX2的 Ca2+转运活性较低,敲除后对植物生长影响不大。异源表达AtCAX2的转基因烟草中的Ca2+累积量与AtCAX1转基因植株相当,但 AtCAX2转基因烟草植株的生长与野生型一样健壮,Ca2+缺乏症状较轻[9]。拟南芥AtCAX3敲除突变株cax3对盐、Li+和低pH敏感性提高,液泡Ca2+反向转运活性和H+-ATPase活性在盐胁迫下降低,说明 AtCAX3是盐胁迫下主要的Ca2+转运蛋白[24]。AtCAX4也主要转运 Ca2+,cax1敲除突变株液泡膜的 Ca2+/H+反向转运能力与野生植株相比降低了61%,在CaMV 35S启动子驱动下表达AtCAX4的cax1-1植株液泡Ca2+/H+反向转运能力与野生植株相比仅降低了33%[11],说明AtCAX4具有较高的 Ca2+转运活性。AtCAX4可抑制酵母突变株对 Ca2+的超敏感表型,高浓度的 Cd2+、Na+或K+能抑制sAtCAX1和sAtCAX4-9 (含有AtCAX1的CaD) 突变体的Ca2+转运活性,而HA-AtCAX4不受影响,表明AtCAX4的Ca2+转运专一性比sAtCAX1更强[2];AtCAX4在番茄中的过量表达可适度的提高其 Ca2+水平,没有出现生长副作用,果实货架期延长[2]。表明过量表达 AtCAX4可以强化植物的 Ca2+营养,从而为延长农产品的货架期提供了一条可选择的途径。
3.2 CAXs参与二价阳离子转运与解毒
AtCAX2可提高酵母突变株 K667和野生型的Mn2+耐受性,在维持植物胞质Mn2+平衡中有重要作用[7]。表达 AtCAX2的转基因烟草根组织中 Ca2+和Mn2+含量增加1倍,茎中含量增加了15%和20%;而根中Cd2+累积量是对照的3倍,茎中Cd2+含量增加了15%[9],说明AtCAX2可参与Cd2+的转运和解毒。AtCAX4主要在根尖、侧根原基中表达,AtCAX4转运的底物主要是Ca2+,但Cd2+存在时可有效转运Cd2+。AtCAX4敲除突变株cax4-1和RNAi突变体在含Mn2+或Cd2+培养基中萌发生长时,其幼苗植株较野生型小,主根长度、侧根数目显著减少,侧根的发育几乎完全被破坏,表明Cd2+严重影响cax4-1的生长。与生长在2 µmol/L Cd2+培养基中的野生型植株相比,cax4-1的侧根减少了70%。cax4-1和RNAi突变体植株子叶变黄、叶绿体数量显著减少,HA-AtCAX4在这两种突变体中的表达可抑制其 Cd敏感表型[11]。表明在重金属 Cd胁迫下 AtCAX4是根生长和发育必需的。
增强液泡CAX的表达可提高植物根细胞液泡转运二价阳离子 (Cd2+、Ca2+、Zn2+和 Mn2+) 的能力[9-10,25]。组成型表达启动子35S分别驱动AtCAX2和 AtCAX4在烟草中表达,烟草根细胞 Cd2+浓度最多分别提高53%和34%;AtCAX4在根部特异性启动子FS3驱动下,根液泡Cd2+和Zn2+的转运能力提高,而Ca2+和Mn2+的转运变化不大,表明两种启动子驱动 AtCAX4的表达均可提高根细胞的重金属浓度。这可能是由于 AtCAX4在根中的特异性表达提高了Cd2+和Zn2+向液泡的转运,或AtCAX4趋于在根组织中起作用,或通过转录后调节使其mRNA更稳定,也可能是 AtCAX4的表达改变了液泡的二价阳离子选择性,更偏向于累积Cd2+和Zn2+,而偏离Ca2+的转运作用[10]。在 3 µmol/L Cd水培条件下,35S:AtCAX2和 FS3:AtCAX4转基因烟草植株生物量分别是对照的2.8倍和1.9倍;地上部Cd的累积量分别是对照的3.4和2.4倍;另外,表达35S:AtCAX2或FS3:AtCAX4的烟草植株分别在150 µmol/L Zn或500 µmol/L Mn胁迫下,地上部Zn累积量为对照的1.9倍和2.2倍,Mn累积量是对照的2.3倍和2.8倍,表明AtCAX2和AtCAX4均可提高植物的生物量和地上部重金属 (Cd2+、Zn2+和Mn2+) 的累积能力。同样,在3 µmol/L Cd胁迫下,与比对照植株相比,FS3:AtCAX4转基因植株根液泡膜泡的 Cd2+/H+反向转运活性提高30%,且根/地上部的Cd浓度比值增加,表明AtCAX4在烟草根中的特异性表达可提高根的 Cd累积能力,减少 Cd向地上部的转运[25]。推测根胞质或液泡中Cd被Cd诱导合成的植物络合素螯合,或根部高浓度的Cd抑制了其向地上部的转运。
进一步研究表明在 Cd胁迫下,转基因烟草35S:AtCAX2或FS3:AtCAX4的地上部/根部Cd含量的比值远低于对照,且转基因植株叶片的Cd累积量比对照减少了15%~25%[26]。生长中期的35S:AtCAX2转基因烟草植株地上部Cd含量与对照植株相比降低了 20%,而根部的 Cd含量提高了20%。对照烟草植株幼穗/35S:AtCAX2-2B根嫁接苗的根部和地上部 Cd含量的比值与转基因植株35S:AtCAX2-2B相似;相反的嫁接烟草植株(35S:AtCAX2-2B幼穗/对照根) 根部和地上部 Cd含量的比值与对照植株相似,表明AtCAX2和AtCAX4在烟草根部的特异性表达可提高Cd在根部的累积,降低其向地上部的转运[26]。从而可以利用CAX基因降低重金属在地上部的累积,为绿色蔬菜和农作物的生产提供一条新的途径。
4 CAXs之间的相互影响
维持胞质阳离子水平是多种金属转运蛋白共同作用的结果。拟南芥 cax1插入失活突变植株中AtCAX3、AtCAX4、ACA4 (Arabidopsis Ca2+-ATPase,isoform 4) 水平显著提高。与野生植株相比,cax1-1植株的AtCAX3、AtCAX4和ACA4的mRNA水平分别提高了4倍、3倍和2倍,以补偿AtCAX1的损失;sAtCAX1在 cax1-1中的表达导致 AtCAX3、AtCAX4和ACA4表达降低。表明AtCAX3和AtCAX4在维持Ca2+平衡中有一定作用,同时也表明了CAXs之间具有相互作用[18]。
转运蛋白相互作用可以扩大其调节范围和功能。AtCAX1和 AtCAX3的物理相互作用是植物生长和获得养分所必需的。AtCAX3不是转运 Ca2+的主要转运蛋白,仅能轻微地抑制酵母突变株的 Ca2+敏感性。AtCAX3和 AtCAX1的反向转运活性差异可能源于V-ATPase产生的pH差异。cax1突变株叶片的Mn2+和Zn2+水平降低;cax1/cax3双突变株叶片的Mn2+和Zn2+水平升高,然而根细胞中Mn2+和Zn2+水平没有显著变化;同时双突变植株中Ca2+和Mg2+的缺乏引起坏疽、叶片萎蔫等现象,这些离子水平的差异可能是质子泵的变化或 CAXs之间相互作用被破坏引起的。AtCAX3主要在根中表达,在叶片中的表达水平低;AtCAX1与之相反,但是在脱落酸处理时,两者都可在叶片保卫细胞中大量表达,这就为研究AtCAX1和AtCAX3以二聚体的形式相互作用提供了条件[14]。
AtCAX1和 AtCAX3同时表达时可形成异二聚体,其离子转运性质与两者单独表达时的二聚体不同。AtCAX1或AtCAX3在酵母突变株的表达只能轻微的抑制其Ca2+敏感性,但是AtCAX1+AtCAX3共表达时可显著抑制酵母突变株在150 mmol/L CaCl2培养基中的 Ca2+敏感性,表明二者相互作用可改变其转运活性。AtCAX1+AtCAX3共表达的酵母突变株耐Li+,而sAtCAX1或sAtCAX3单独表达时均无耐性;其它 CAXs共表达时没有出现相似的结果,如AtCAX2和AtCAX4,表明AtCAX1和AtCAX3可形成具有新转运能力的二聚体。推测 AtCAXs的相互作用可导致构象改变,从而引起酶对底物亲和力改变[14,27]。
酵母分离泛素评价 (Yeast split ubiquitin assay)及 AtCAX1和 AtCAX3的免疫共沉淀研究表明AtCAX1与AtCAX3具有物理相互作用。AtCAX1和AtCAX3在植物细胞中共表达时可形成CAXs异源二聚体,AtCAX1+AtCAX3复合物可能是特定胁迫条件下必需的[27]。
酸性氨基酸基序可将 CAXs蛋白分成轻微相似性的 N-端和 C-端两部分,即 N-sCAX和 C-CAX。N-sCAX1和C-CAX3均独立定位在同一酵母细胞内膜上,且发生物理相互作用。研究发现CAXs的N-端部分调节Ca2+转运活性,而C-端部分决定CAXs的耐盐表型。表达sCAX1的酵母对Ca2+有耐受性,对Na+和Li+敏感,而表达CAX3的酵母对Na+和Li+稍有耐性,但对Ca2+敏感。共表达N-sCAX1+C-CAX1的酵母 K667耐 Na+、Li+和 Ca2+。相反,共表达N-sCAX3+C-CAX3或 N-sCAX1+C-CAX3的酵母K667对 Ca2+敏感,但耐 Na+。在高浓度 Ca2+和 Li+条件下,表达 N-sCAX1+C-CAX1和 N-sCAX1+CCAX3的酵母 Ca2+、Li+和 Na+的累积增加。N-sCAX1+C-CAX1比 N-sCAX1+C-CAX3累积的Ca2+多,而后者累积更多的Li+。这些结果表明异源CAX复合物有较好的可塑性,为设计新型CAX转运蛋白提供了一种全新的方法[28]。
5 展望
CAX广泛存在于细菌、真菌、盘基网柄菌、植物和低等脊椎动物[4]。植物 CAXs可将胞质中过量的Ca2+转运到液泡,调节胞质中Ca2+浓度[2],以保持植物正常的生理代谢。拟南芥有6个CAXs中,现已鉴定的AtCAX1-4表达的组织部位特异性不同[14,7-8],然而,其在小液泡和中央液泡膜的定位是否存在差别未见报道。
AtCAXs反向转运活性和底物特异性取决于 4个功能域:N-端NRR、CaD、C功能域和D功能域。AtCAX1的NRR可与RDR相互作用,导致自抑制作用,使其 Ca2+转运活性丧失;当 NRR缺失时,sAtCAX1可恢复其Ca2+转运活性[15,18],但是,发生自抑制时 CAXs蛋白构象发生哪些变化至今还不清楚。AtCAX1的Ca2+转运活性受NRR结构完整性的调节,N-端缺失不同数目氨基酸残基的 AtCAX1,其 Ca2+转运活性有不同程度的提高;然而,完全缺失 NRR的 AtCAX4只能轻微的抑制酵母突变株的Ca2+敏感性,相反延长 N-端的AtCAX3和 AtCAX4的Ca2+转运活性均提高[2,15]。因此NRR对CAXs反向转运活性的调节机制还需进一步研究。CaD决定CAXs的 Ca2+转运能力[23],然而,其如何调控 Ca2+转运活性尚不清楚。AtCAX2参与植物Mn2+装载和卸载,其中 C功能域是 Mn2+转运必需的,表达AtCAX2的烟草对Mn2+的耐受性稍有增加,但 Cd2+耐受性没有增加[9],因此,进一步研究 C功能域的氨基酸序列,改变其离子转运特性,以提高植物累积重金属的能力;Zn2+可抑制AtCAX2的45Ca2+转运活性,推测C功能域可能也参与Zn2+转运[13]。拓扑结构预测表明 AtCAX2的 D功能域位于 TM5和TM6,推测其面向液泡腔一侧,然而,其可调节胞质的pH,因此,D功能域面向液泡腔一侧的推测可能是错误的。另外,D功能域也许可与面向细胞质一侧的pH感应区发生间接作用,调节胞质的pH[5]。因此,需要进一步分离纯化CAXs,研究其高级结构。
CaD与C功能域都与金属离子转运的专一性有关[13,20],深入研究 CAXs结构可设计专一性的金属离子转运蛋白,将矿质元素转运到蔬菜和水果可食用的部分。AtCAX1和AtCAX4转基因番茄果实中除Ca2+水平提高外,Cu2+、Fe2+和Mg2+等含量也升高,且果实的储存期延长[2]。AtCAX1突变体 AtCAX1-H338N的Cd转运能力增强。表达AtCAX1-H338N的矮牵牛 Petunia hybrida Cd耐受性和累积能力提高。在 50 µmol/L或 100 µmol/L CdCl2中生长 6周,转基因植株较对照植株健壮,Cd累积量是对照的2.5倍,并且形态和发育特征没有受影响[29]。AtCAX2和AtCAX4也有Cd2+/H+反向转运活性,在植物根部表达可减少 Cd2+在地上部的累积[10,26]。一方面,可以通过提高AtCAX2和AtCAX4的表达或基因修饰,降低 Cd2+在植物可食用部分的累积,减少人类对重金属Cd的摄入;另一方面,应用基因工程的技术提高Cd超富集植物中Cd2+向地上部的转运,为Cd污染土壤的植物修复提供技术支持。
REFERENCES
[1] Hirschi KD. Expression of Arabidopsis CAX1 in tobacco:altered calcium homeostasis and increased stress sensitivity. Plant Cell, 1999, 11(11): 2113−2122.
[2] Park S, Cheng NH, Pittman JK, et al. Increased calcium levels and prolonged shelf life in tomatoes expressing Arabidopsis H+/Ca2+transporters. Plant Physiol, 2005,139(3): 1194−1206.
[3] Mei H, Zhao J, Pittman JK, et al. In planta regulation of the Arabidopsis Ca2+/H+antiporter CAX1. J Exp Bot,2007, 58(12): 3419−3427.
[4] Cai XJ, Lytton J. The cation/Ca2+exchanger superfamily:phylogenetic analysis and structural implications. Mol Biol Evol, 2004, 21(9): 1692−1703.
[5] Pittman JK, Shigaki T, Hirschi KD. Evidence of differential pH regulation of the Arabidopsis vacuolar Ca2+/H+antiporters CAX1 and CAX2. FEBS, 2005,579(12): 2648−2656.
[6] Pittman JK, Edmond C, Sunderland PA, et al. A cation-regulated and proton gradient-dependent cation transporter from Chlamydomonas reinhardtii has a role in calcium and sodium homeostasis. J Biol Chem, 2009,284(1): 525−533.
[7] Pittman JK, Shigaki T, Marshall JL, et al. Functional andregulatory analysis of the Arabidopsis thaliana CAX2 cation transporter. Plant Mol Biol, 2004, 56(6): 959−971.
[8] Cheng NH, Pittman JK, Shigaki T, et al. Characterization of CAX4, an Arabidopsis H+/cation antiporter. Plant Physiol, 2002, 128(4): 1245−1254.
[9] Hirschi KD, Korenkov VD, Wilganowski NL, et al.Expression of Arabidopsis CAX2 in tobacco. Altered metal accumulation and increased manganese tolerance. Plant Physiol, 2000, 124(1): 125−133.
[10] Koren’kov V, Park S, Cheng NH, et al. Enhanced Cd2+-selective root-tonoplast-transport in tobaccos expressing Arabidopsis cation exchangers. Planta, 2007,225(2): 403−411.
[11] Mei H, Cheng NH, Zhao J, et al. Root development under metal stress in Arabidopsis thaliana requires the H+/cation antiporter CAX4. New Phytol, 2009, 183(1): 95−105.
[12] Shigaki T, Nakhleh L, Hirschi KD, et al. Identif i cation of three distinct phylogenetic groups of CAX cation/proton antiporters. J Mol Evol, 2006, 63(6): 815−825.
[13] Shigaki T, Pittman JK, Hirschi KD. Manganese specificity determinants in the Arabidopsis metal/H+antiporter CAX2. J Biol Chem, 2003, 278(8): 6610−6617.
[14] Cheng NH, Pittman JK, Shigaki T, et al. Functional association of Arabidopsis CAX1 and CAX3 is required for normal growth and ion homeostasis. Plant Physiol,2005, 138(4): 2048−2060.
[15] Pittman JK, Hirschi KD. Regulation of CAX1, an Arabidopsis Ca2+/H+antiporter. Identification of an N-terminal autoinhibitory domain. Plant Physiol, 2001,127(3): 1020−1029.
[16] Cheng NH, Pittman JK, Barkla BJ, et al. The Arabidopsis cax1 mutant exhibits impaired ion homeostasis,development, and hormonal responses and reveals interplay among vacuolar transporters. Plant Cell, 2003,15(2): 347−364.
[17] Kamiya T, Maeshima M. Residues in internal repeats of the rice cation/H+exchanger are involved in the transport and selection of cations. J Biol Chem, 2003, 279(1):812−819.
[18] Pittman JK, Shigaki T, Cheng NH, et al. Mechanism of N-terminal autoinhibition in the Arabidopsis Ca2+/H+antiporter CAX1. J Biol Chem, 2002, 277(29):26452−26459.
[19] Pittman JK, Sreevidya CS, Shigaki T, et al. Distinct N-terminal regulatory domains of Ca2+/H+antiporters.Plant Physiol, 2002, 130(2): 1054−1062.
[20] Shigaki T, Cheng NH, Pittman JK, et al. Structural determinants of Ca2+transport in the Arabidopsis H+/Ca2+antiporter CAX1. J Biol Chem, 2001, 276(46): 43152−43159.
[21] Shigaki T, Barkla BJ, Miranda-Vergara MC, et al.Identification of a crucial histidine involved in metal transport activity in the Arabidopsis cation/H+exchanger CAX1. J Biol Chem, 2005, 280(34): 30136−30142.
[22] Cheng NH, Liu JZ, Nelson RS, et al. Characterization of CXIP4, a novel Arabidopsis protein that activates the H+/Ca2+antiporter, CAX1. FEBS Lett, 2004, 559(1/3):99−106.
[23] Shigaki T, Sreevidya C, Hirschi KD. Analysis of the Ca2+domain in the Arabidopsis H+/Ca2+antiporters CAX1 and CAX3. Plant Mol Biol, 2002, 50(3): 475−483.
[24] Zhao J, Barkla BJ, Marshall J, et al. The Arabidopsis cax3 mutants display altered salt tolerance, pH sensitivity and reduced plasma membrane H+-ATPase activity. Planta,2007, 227(3): 659−669.
[25] Korenkov V, Hirschi K, Crutchfield JD, et al. Enhancing tonoplast Cd/H antiport activity increases Cd, Zn, and Mn tolerance, and impacts root/shoot Cd partitioning in Nicotiana tabacum L. Planta, 2007, 226(6): 1379−1387.
[26] Korenkov V, King B, Hirschi K, et al. Root-selective expression of AtCAX4 and AtCAX2 results in reduced lamina cadmium in field-grown Nicotiana tabacum L.Plant Biotechnol J, 2009, 7(3): 219−226.
[27] Zhao J, Shigaki T, Mei H, et al. Interaction between Arabidopsis Ca2+/H+exchangers CAX1 and CAX3. J Biol Chem, 2009, 284(7): 4605−4615.
[28] Zhao J, Connorton JM, Guo YQ, et al. Functional studies of split Arabidopsis Ca2+/H+exchangers. J Biol Chem,2009, 284(49): 34075−34083.
[29] Wu QY, Shigaki T, Williams KA, et al. Expression of an Arabidopsis Ca2+/H+antiporter CAX1 variant in petunia enhances cadmium tolerance and accumulation. J Plant Physiol, 2011, 168(2): 167−173.
Structure and function of tonoplast Cation/H+antiporters in plant: a review
Yuxiu Zhang1, Xiaojing Peng1, Tuanyao Chai2, Chunling Zhang3, and Jinguang Liu1
1 School of Chemical and Environmental Engineering, China University of Mining and Technology (Beijng), Beijng 100083, China
2 College of Life Science, Graduate School of Chinese Academy of Sciences, Beijing 100049, China
3 Hebei Welcome Pharmaceutical Corporation Limited, Shijiazhuang 050031, China
Received: July 14, 2010; Accepted: November 9, 2010
Supported by: National Major Special Project on New Varieties Cultivation for Transgenic Organisms (No. 2009ZX08009-130B), Fundamental Research Funds for the Central University (No. 2010YH05).
Corresponding author: Tuanyao Chai. Tel: +86-10-88256343; E-mail: tychai@gucas.ac.cn
国家转基因生物新品种培育重大专项 (No. 2009ZX08009-130B),中央高校基本科研业务费专项资金 (No. 2010YH05) 资助。
