类弹性蛋白多肽的从头设计、非色谱纯化及盐效应
2011-09-29黄凯宗李晶晶李巍葛慧华王文研张光亚
黄凯宗,李晶晶,李巍,葛慧华,王文研,张光亚
华侨大学生物工程与技术系,厦门 361021
类弹性蛋白多肽的从头设计、非色谱纯化及盐效应
黄凯宗,李晶晶,李巍,葛慧华,王文研,张光亚
华侨大学生物工程与技术系,厦门 361021
旨在克隆、表达与纯化类弹性蛋白多肽,并测定类弹性蛋白的相变温度对不同的盐敏感程度。从头设计了类弹性蛋白多肽的序列并人工合成其编码基因片段,克隆至改造后的表达载体pET-22b(+) 中,构建重组表达载体,转化至大肠杆菌BL21(DE3) 中并诱导表达,采用可逆相变循环经高速离心对其进行纯化,并考察了盐类型及浓度对类弹性蛋白相变温度的影响。结果表明:0.4 mmol/L的Na2CO3能使25 µmol/L类弹性蛋白多肽 [KV8F-20] 相变温度降低至19 ℃,此类弹性蛋白多肽序列有望开发成一新型纯化标签,为今后重组蛋白的非色谱分离纯化奠定基础。
类弹性蛋白多肽,非色谱法纯化,可逆相变循环,相变温度,纯化标签
Abstract:Elastin-like polypeptides (ELPs) are temperature sensitive biopolymers composed of a Val-Pro-Gly-Xaa-Gly pentapeptide repeat that derived from a structural motif found in mammalian elastin. It was a promising tag for recombinant protein purification. Here, we de novo designed a novel ELPs gene and cloned it into the modified expression vector pET-22b(+). Then, we transformed the recombinant expression vector pET-22b-ELPs into Escherichia coli BL21(DE3). Upon induction by Isopropyl β-D-Thiogalactoside (IPTG), ELPs was expressed and purified by a non-chromatographic purification method named inverse temperature cycling. The influences of salts types and concentrations on ELPs were also determined. The results showed that the transition temperature of the [KV8F-20] decreased to 19 °C by 0.4 mmol/L Na2CO3. Due to its small molecular weight and sensitivity to salt, the ELPs might be a useful purification tag, which can provide a reliable and simple non-chromatographic method for purification of the recombinant protein by inverse transition cycling.
Keywords:elastin-like polypeptides, non-chromatographic purification, inverse transition cycling, transition temperature,purification tag
蛋白质分子大规模分离纯化是当前生物工程中的关键技术问题,纯化过程所需成本约占总成本的60%~70%,色谱法为目前分离蛋白较成熟的方法。融合标签技术极大地简化了重组蛋白质的纯化过程,它通过融合一段特定的多肽 (如组氨酸标签) 进行融合表达,并通过适当的亲和力或者对配体有高特异性,融合蛋白可以与固相基质上的特异配基结合,从而使重组蛋白质得以纯化[1]。但在实际应用中,亲合色谱法成本很高,不仅需要特殊设备,须对固相基质进行定制,难以放大到工业规模,且纯化效率低[2]。
类弹性蛋白多肽 (Elastin-like polypeptides,ELPs) 是一种具有弹性功能且对环境温度非常敏感的人造基因工程蛋白质聚合物。其结构主要由五肽重复序列单元构成,即 (Val-Pro-Gly-Xaa-Gly,VPGXG),源自于弹性蛋白的疏水区域,其中 Xaa可以是除 Pro以外任一氨基酸。ELPs有一个可逆相变过程,称之为反转变温度 (Inverse temperature transition,ITT),若环境温度低于该相变温度(Transition temperature),该多肽在水溶液中为高度可溶,聚合物链保持无序结构,且相当伸展。相反,当温度高于该温度时,该含水的多肽链结构就瓦解,并开始聚集,形成一个富含 ELPs的聚集物,由于ELPs具有这种特殊性质,已广泛应用于蛋白质纯化与质粒DNA分离[3-8]。本研究设计了一新型ELPs (即ELP[KV8F-20]),人工合成其基因,成功在宿主菌表达并纯化,同时测定其对盐的敏感程度,为下一步纯化重组蛋白提供了理论与实验依据,报道如下。
1 材料与方法
1.1 ELPs的命名
ELP[XiYjZk-n] 代表整个ELPs序列中有n个五肽,五肽中第 4个氨基酸残基组成比例为 X:Y:Z=i:j:k[2]。如ELP[KV8F-20],是一个包含20个 VPGXG五肽单元序列,五肽单元第 4个氨基酸残基组成为K、V、F,且五肽单元第4个残基中含2个 K,16个V,2个F,比例为1:8:1。
1.2 菌株、质粒与培养基
表达宿主菌E. coli BL21 (DE3) 与pUC-19-ELPs及修饰后的pET-22b(+) 为本实验室保存,表达载体pET-22b(+) 为上海捷瑞生物工程有限公司惠赠。的修饰过程为用替换原始 pET-22b(+) 的 NdeⅠ与 EcoRⅠ酶切位点之间的序列。
1.3 主要工具酶及试剂
限制性内切酶PflMⅠ、BglⅠ、NdeⅠ、EcoRⅠ与 SfiⅠ购自上海捷瑞生物工程有限公司,蛋白质Maker SM1861为Fermentas公司产品,SDS-PAGE凝胶配制试剂盒购于碧云天生物技术研究所,聚乙烯亚胺购于Sigma公司,透析袋为美国联合碳化公司产品,其他化学试剂均为分析纯。
1.4 ELPs的原核表达载体构建
本文所涉及到的分子生物学技术,如感受态细胞的制备、转化、质粒的提取和酶切等方法均参考文献[9]。用 PflMⅠ与BglⅠ双酶切pUC-19-ELPs,获得 ELPs片段基因,将此片段基因插入到经 SfiⅠ酶切后 pET-22b(+) 修饰表达载体。重组质粒命名为pET-22b-ELPs,测序鉴定由上海捷瑞生物工程有限公司完成。
1.5 ELP[KV8F-20] 表达与纯化
含有pET-22b-ELPs重组质粒的BL21工程菌按1∶100的接种量接种到含100 µg/mL氨苄青霉素的TB培养基中 (每升TB培养基中含12 g蛋白胨,24 g酵母浸提物,2.31 g磷酸氢二钾,12.54 g磷酸二氢钾,4 mL甘油),37 ℃、250 r/min培养至OD600为0.8时,加入IPTG诱导 (终浓度为1 mmol/L),诱导 3 h,4 ℃、4 000 r/min离心 15 min,收获菌体,用预冷的PBS缓冲液 (137 mmol/L NaCl,2.7 mmol/L KCl,4.2 mmol/L NaH2PO4,1.4 mmol/L KH2PO4,pH为7.3) 重悬菌体,然后置冰浴中超声破碎 (超声2 s,间隔2 s,共4 min)。
ELPs纯化采用ITC (Inverse transition cycling,可逆相变循环),即在大肠杆菌破碎液,向其加入聚乙烯亚胺 (终浓度为0.5%) 以去除核酸;4 ℃、13 000 r/min离心15min,取上清;向上清液中添加 NaCl 至终浓度为 2 mol/L,37 ℃水浴15 min后,13 000 r/min离心15 min,去上清;向沉淀中加入预冷的PBS 溶解沉淀,冰浴15 min后,4 ℃、13 000 r/min离心 15 min;向上清液中再添加NaCl至终浓度为 2 mol/L,37 ℃水浴 15 min后,13 000 r/min离心15 min,去上清;向沉淀中加入预冷的PBS溶解沉淀,冰浴15 min,4 ℃、13 000 r/min离心15 min,收集上清液,以上过程为两轮ITC。ELPs的纯度与分子量通过SDS-PAGE验证。
1.6 ELP[KV8F-20] 的定量
采用紫外分光光计测定Trp在280 nm处的消光系数,建立标准曲线。测定ELP[KV8F-20] 在280 nm的消光系数,并与标准曲线进行比对,从而可以对ELPs浓度进行定量[10]。
1.7 ELP[KV8F-20] 相变温度测定及盐对其相变温度影响的测定
测定ELP[KV8F-20] 相变温度参考文献[2],即:测定 10 ℃~95 ℃ E LPs 的PBS溶液 (ELPs终浓度为25 µmol/L) 在波长为350 nm处的浊度,升温速率为1 ℃/min。
盐对 ELP[KV8F-20] 相变温度影响的测定参考文献[11],即将盐溶解在10 mmol/L的磷酸盐缓冲溶液(pH 6.9),配制各种盐的浓度梯度。将冷冻干燥后的 ELPs溶解于盐浓度中,ELPs的终浓度为25 µmol/L,并测定其在波长为350 nm处不同温度下的浊度。
1.8 相变温度定义
相变温度为OD350最大值的一半时所对应的温度[2]。
2 结果与分析
2.1 PUC-19-ELPs的酶切及ELPs基因片段回收
依据 ELP[KV8F-20]的氨基酸序列 (100个氨基酸),考虑大肠杆菌的密码子使用情况,从头设计其基因序列 (300 bp),将其连入克隆载体pUC-19,经测序列,pUC-19-ELPs质粒构建正确。利用pflMⅠ与 BglⅠ对 ELP[KV8F-20]基因片段回收,回收结果如图1所示,可见线性克隆载体片段与大小为300 bp的基因片段,符合预期大小;再将此基因导入到用SfiⅠ酶切修饰后的pET-22 b(+) 表达载体中[2],构建pET-22 b(+)-ELPs表达载体,使用Nde I与EcoR I对该表达载体进行双酶切鉴定,结果如图2所示,可见线性表达载体片段和大小为 332 bp的基因片段,与预期结果一致;结合测序结果,表明表达载体构建正确。之后,将该pET-22 b(+)-ELPs导入到E. coli BL21 (DE3) 宿主菌中,构建工程菌。
2.2 ELPs的诱导表达与纯化
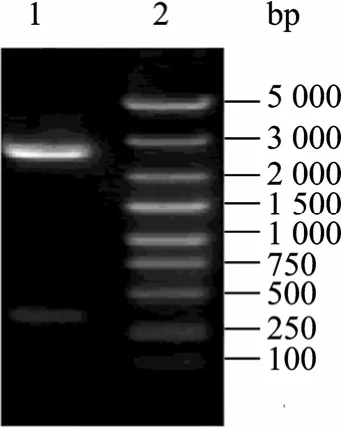
图1 pflM Ι与Bgl Ι酶切回收ELP基因Fig. 1 Recovery ELP gene with digestion by pflM I and Bgl I. 1: pET-22(b)-ELP digested by pflM I and Bgl I; 2: DNA marker.
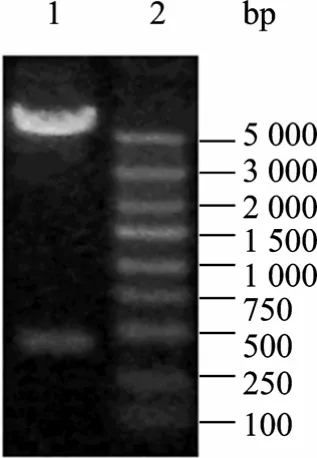
图2 重组pET-22(b)-ELPs的酶切鉴定Fig. 2 Identification of pET-22(b)-ELPs with digestion by Nde I and EcoR I. 1: pET-22(b)-ELPs digested by Nde I and EcoR I; 2: DNA marker.
含有 pET-22b(+)-ELPs重组质粒的 BL21工程菌,经IPTG诱导后,收集菌体,并细胞破碎后,采用ITC纯化,纯化结果表明在11 kDa处有一条带,比 ELP[KV8F-20] 理论分子量大 20%,与相关的ELPs报道吻合[10,12]。
图3结果表明,两轮ITC之后,与细胞破碎液相比,目的蛋白质在纯化的过程中并没有太大损失,因而可认为 ITC可以保证目的蛋白回收率。由图 4可知,经两轮ITC之后,在11 kDa处有单一条带,已达到纯化目的,此外,ITC过程也是一个蛋白浓缩的过程。
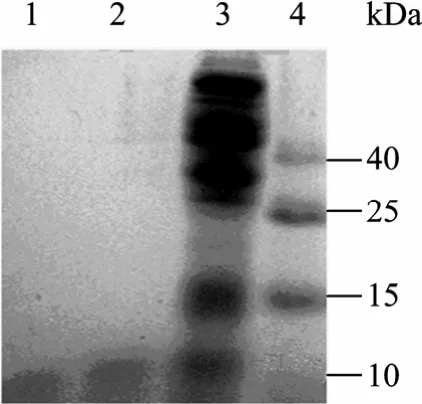
图3 表达纯化的ELPsFig. 3 Expression and purification of the ELPs. 1: the purified ELPs after two rounds ITC; 2: the purified ELPs after one rounds ITC; 3: total proteins after induction; 4: protein marker.
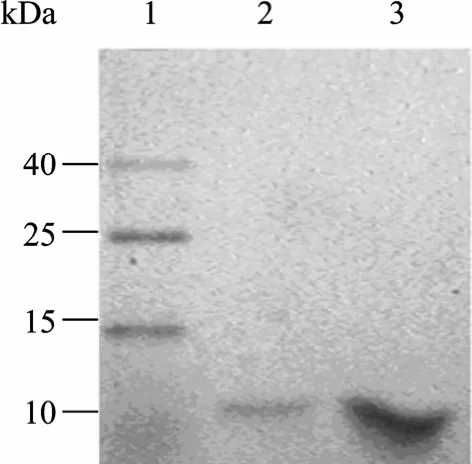
图4 使用足量与少量PBS溶解纯化后ELPs沉淀Fig. 4 ELPs dissolved in adequate and small amount of PBS.1: protein marker; 2: purified ELPs were dissolved in adequate amount of PBS; 3: purified ELPs were dissolved in small amount of PBS.
2.3 ELPs相变温度的测定及盐对其相变温度的影响
由图5可知,在ELPs的相变发生阶段,温度上升2 ℃~3 ℃时,导致ELPs混浊度急剧的增加,关于ELPs相变机理,目前处于争论阶段,有一种观点认为温度升高,会破坏水分子与ELPs之间的水合作用,导致 ELPs溶解度骤变[11]。图 6表明 ELPs的相变温度与 ELPs的浓度呈反比关系,故 ELPs表达量越大,ELPs浓度越高,相变温度越低,越有利于ELPs的纯化。此外,ELPs的相变温度与ELPs五肽重复序列单元中第 4个残基 (Xaa) 的种类、ELPs序列长度、ELPs的分子量相关[13]。

图5 含100 µmol/L的ELP[KV8F-20] PBS溶液的混浊度与温度关系Fig. 5 Turbidity profiles for 100 µmol/L ELP[KV8F-20]concentration in PBS.
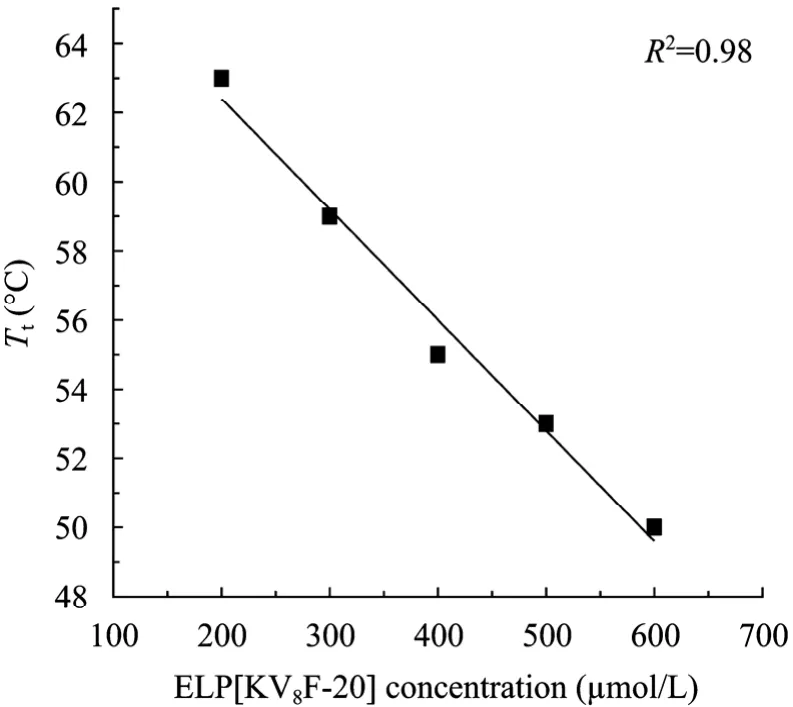
图6 ELP[KV8F-20] Tt与浓度关系Fig. 6 Ttas a function of concentration for ELP[KV8F-20].
测定5种阴离子与3种阳离子对类弹性蛋白相变温度的影响,依据霍夫迈斯特离子序[14](Hofmeister series),阴离子阳离子本研究所考察3种阳离子及5种阴离子影响类弹性蛋白相变温度顺序。图 8结果表明,5种阴离子的钠盐影响类弹性蛋白相变温度顺序均与霍夫迈斯特离子序相符合 (铵盐与钾盐未列出,其影响趋势与钠盐一致)。图7结果表明,3种阳离子的硫酸盐 (碳酸盐、磷酸二氢盐、氯化物、硝酸盐影响 Tt趋势与硫酸盐一致) 对影响类弹性蛋白相变温度顺序却为 NH4+<K+<Na+,造成这种差异,可能是本研究所设计的ELPs中含有苯丙氨酸残基 (F) 与赖氨酸残基 (K)有关,赖氨酸残基的存在会使多肽产生屏蔽效应(Screening effects),而F的存在会产生阳离子-π相互作用[11]。

图7 三种硫酸盐对ELP[KV8F-20] 相变温度的影响Fig. 7 Transition temperature vs salt concentration curves for three sulfatets with ELP[KV8F-20].

图8 五种钠盐对ELP[KV8F-20] 相变温度的影响Fig. 8 Transition temperature vs salt concentration curves for five sodium salts with ELP[KV8F-20].
3 讨论
类弹性蛋白多肽是一种具有弹性功能且对环境非常敏感的生物高分子,利用类弹性蛋白的可逆相变特性,使其在蛋白纯化、作为药物载体、组织工程等方面得到广泛的应用[15]。
与类弹性蛋白进行融合表达的重组蛋白也具有可逆相变特性,因而也可以采用 ITC纯化重组蛋白[16]。采用ITC纯化蛋白有以下几个优势[17]:1)无需与色谱相关的色谱填料及设备,纯化成本大幅度下降,这种纯化方式可以规模化放大 (纯化的蛋白量可以达到千克级别);2) ITC的过程中分离与回收的条件较为温和,只需适当改变温度与离子强度;3) 采用ITC纯化蛋白这种纯化方式速度快,方法简单,只需几次离心步骤;4) ITC是很容易应用于到从不同的细胞发酵培养来纯化蛋白,因为蛋白纯化是制约蛋白质结构/功能研究与药物筛选主要环节;5) ITC中的离心沉淀步骤也是一个蛋白浓缩富集过程,无需干燥;6) 目的蛋白回收率较高,采用ITC纯化,回收率可以达到75%[18]。有研究者认为,这种纯化方式将给重组蛋白的分离纯化带来革命性变化[16]。鉴于ITC纯化蛋白简单且快速性,有理由相信这种蛋白纯化方式比较容易从实验室规模放大到工业规模。
本研究从头设计了一种新型的仅有 20个五肽单元的ELPs序列,通过考察不同盐对其相变温度影响,发现能大幅度降低相变温度。虽然铵盐也能显著降低相变温度,但是与钠盐相比,铵盐加入会造成很多蛋白的盐析,从而在目标蛋白中引入了更多的杂蛋白,对后续的分离纯化不利[16]。与常规的ELPs相比 (如 ELP[V5],ELP[V5A2G3],ELP[V1A8G7]),本研究所设计的 ELPs蛋白质序列长度更短 (常规的ELPs序列一般至少需有60个以上五肽重复单元,才具有较低的相变温度)[10];对盐浓度更为敏感;且赖氨酸的相对含量更低,这有助于提高蛋白质的表达量[18]并可能与ELPs产生的tT∆(NaCl) 效应更低有关[2]。通过对盐离子的进一步优化,此ELPs序列有望开发成一个新的重组蛋白纯化标签。
目前,国内鲜有 ELPs的研究报道[20],而国外则相对较深入[15]。本研究所设计的 ELPs因其分子量较小,对钠盐非常敏感,产量较高,可望作为一种新型的纯化标签,为今后重组蛋白的分离纯化带来更多的选择,相关的研究仍在不断深入进行中。
REFERENCES
[1] Li YJ, Chen YY, Bi LJ. Fusion tags technology and their applications. Chin J Biotech, 2006, 22(4): 523−527.李永进, 陈媛媛, 毕利军. 融合标签技术及其应用. 生物工程学报, 2006, 22(4): 523−527.
[2] Lim DW, Trabbic-Carlson K, MacKay JA, et al. Improved non-chromatographic purification of a recombinant protein by cationic elastin-like polypeptides. Biomacromolecules,2007, 8(5): 1417−1424.
[3] Banki MR, Feng L, Wood DW. Simple bioseparations using self−cleaving elastin-like polypeptide tags. Nat Methods, 2005, 2(9): 659−661.
[4] Kim JY, O’Malley S, Mulchandani A, et al. Genetically engineered elastin−protein a fusion as a universal platform for homogeneous phase-separation immunoassay. Anal Chem, 2005, 77(8): 2318−2322.
[5] Christensen T, Trabbic-Carlson K, Liu WG, et al.Purification of recombinant proteins from Escherichia coli at low expression levels by inverse transition cycling.Anal Biochem, 2007, 360(1): 166−168.
[6] Lao UL, Kostal J, Mulchandani A, et al. Affinity purification of plasmid DNA by temperature-triggered precipitation. Nat Protoco, 2007, 2(5): 1263−1268.
[7] Joensuu JJ, Brown KD, Conley AJ, et al. Expression and purification of an anti-Foot-and-mouth disease virus single chain variable antibody fragment in tobacco plants.Transgenic Res, 2009, 18(5): 685−696.
[8] Floss DM, Sack M, Arcalis E, et al. Influence of elastin-like peptide fusions on the quantity and quality of a tobacco−derived human immunodeficiency virusneutralizing antibody. Plant Biotechnol J, 2009, 7(9):899−913.
[9] Sambrook J, Fritsch EF, Maniatis T. Molecular Cloning: A Laboratory Manual. 2nd ed. New York: Cold Spring Harbor Laboratory Press, 1989: 16−66.
[10] Meyer DE, Chilkoti A. Genetically encoded synthesis of protein−based polymers with precisely specified molecular weight and sequence by recursive directional ligation: examples from the elastin-like polypeptide system. Biomacromolecules, 2002, 3(2): 357−367.
[11] Cho Y, Zhang YJ, Christensen T, et al. Effects of hofmeister anions on the phase transition temperature of elastin-like polypeptides. J Phys Chem B, 2008, 112(44):13765−13771.
[12] McPherson DT, Morrow C, Minehan DS, et al. Production and purification of a recombinant elastomeric polypeptide,G-(VPGVG)19-VPGV, from Escherichia coli. Biotechnol Prog, 1992, 8(4): 347−352.
[13] Meyer DE, Chilkoti A. Quantification of the effects of chain length and concentration on the thermal behavior of elastin-like polypeptides. Biomacromolecules, 2004, 5(3):846−851.
[14] Hofmeister F. Zur Lehre von der Wirkung der Salze.Zweite Mittheilung. Arch Exp Pathol Pharmakol, 1988,24(4/5): 247−260.
[15] Chow D, Nunalee ML, Lim DW, et al. Peptide-based biopolymers in biomedicine and biotechnology. Mat Sci Eng R, 2008, 62(4): 125−155.
[16] Floss DM, Schallau K, Rose-John S, et al. Elastin-like polypeptides revolutionize recombinant protein expression and their biomedical application. Trends Biotechnol, 2010,28(1): 37−45.
[17] Meyer DE, Chilkoti A. Purification of recombinant proteins by fusion with thermally-responsive polypeptides.Nat Biotechnol, 1999, 17(11): 1112−1115.
[18] Trabbic-Carlson K, Liu L, Kim B, et al. Expression and purification of recombinant proteins from Escherichia coli: comparison of an elastin-like polypeptide fusion with an oligohistidine fusion. Protein Sci, 2004, 13(12):3274−3284.
[19] Teulé F, Cooper AR, Furin WA, et al. A protocol for the production of recombinant spider silk-like proteins for artificial fiber spinning. Nat Protoco, 2009, 4(3): 341−355.
[20] Hu F, Ke T, Li X, et al. Expression and purification of the antimicrobial polypeptide by fusion with elastin-like polypeptide. Chin J Mol Cell Biol, 2008, 41(3): 233−237.
胡凡, 柯涛, 李鑫, 等. 类弹性蛋白ELPs融合表达在抗菌肽分离纯化中的应用. 分子细胞生物学报, 2008,41(3): 233−237
De novo design, non-chromatographic purification and salt-effect of elastin-like polypeptides
Kaizong Huang, Jingjing Li, Wei Li, Huihua Ge, Wenyan Wang, and Guangya Zhang
Department of Bioengineering and Biotechnology, Huaqiao University, Xiamen 362021, China
Received: June 13, 2010; Accepted: October 20, 2010
Supported by: National Natural Science Foundation of China (No. 20806031), Natural Science Foundation of Fujian Province (No. 2009J01030).Research Foundation for Advanced Talents of Huaqiao University (No. 10BS220).
Corresponding author: Guangya Zhang. Tel: +86-595-22690290; E-mail: zhgyghh@hqu.edu.cn
国家自然科学基金 (No. 20806031),福建省自然科学基金 (No. 2009J01030),华侨大学高层次人才科研启动项目 (No. 10BS220) 资助。
