金黄色葡萄球菌isdb基因的克隆表达及其小鼠免疫试验
2011-09-29马金柱崔玉东张晶朱战波朴范泽
马金柱,崔玉东,,张晶,朱战波,朴范泽
1 黑龙江八一农垦大学生命科技学院,大庆 163319
2 黑龙江八一农垦大学动物科技学院,大庆 163319
金黄色葡萄球菌isdb基因的克隆表达及其小鼠免疫试验
马金柱1,崔玉东1,2,张晶1,朱战波2,朴范泽2
1 黑龙江八一农垦大学生命科技学院,大庆 163319
2 黑龙江八一农垦大学动物科技学院,大庆 163319
为了研究金黄色葡萄球菌表面Isdb蛋白的免疫原性,应用PCR方法扩增出金黄色葡萄球菌Wood46株的isdb基因并进行序列分析,再将isdb 基因插入到pET32-a(+) 载体上,构建了pET32-a(+)-isdb重组质粒,将重组质粒转化到宿主菌大肠杆菌BL21中并诱导表达和纯化Isdb蛋白。用纯化的Isdb蛋白免疫小鼠,检测小鼠血清中抗体水平;在二次免疫之后的第2周,用金黄色葡萄球菌Wood46、HLJ23-1株对小鼠攻毒,每组8只小鼠。研究结果发现:isdb基因在不同菌株中高度保守;Isdb蛋白在宿主菌中获得成功表达;在免疫后血清抗体效价与对照组相比,均显著升高 (P<0.05);攻毒结果表明Isdb蛋白对Wood46和HLJ23-1两种菌株攻毒保护率分别为62.5%和75%。以上结果表明Isdb蛋白具有较好的免疫原性和免疫保护作用。
金黄色葡萄球菌,isdb基因克隆,Isdb蛋白表达,免疫原性
Abstract:In order to characterize the immunogenicity and immunoprotection of the Staphylococcus aureus (S. aureus) surface Isdb, we amplified isdb gene from S. aureus Wood46 strain. The isdb gene was subsequently inserted into pET32a(+) vector and the recombinant plasmid was transformed into E. coli strain BL21. The recombinant Isdb was expressed and purified. Then, we immunized mice with the purified recombinant protein. The antibody level was measured by enzyme-linked immunosorbent assay. Finally, immunized mice were challenged with S. aureus strains Wood46 and HLJ23-1. These results showed that isdb gene sequences were highly conserved, and the recombinant Isdb was successfully expressed. The antibody titer in the immunized groups was increased significantly (P<0.05) compared with the control, the protective rate of Isdb protein inducted by challenge with the two S. aureus stains Wood46 and HLJ23-1 was 62.5% and 75%, respectively. These results showed that the Isdb protein had high immunogenicity and immunoprotective capacity.
Keywords:Staphylococcus aureus, isdb gene cloning, Isdb expression, immunogenicity
金黄色葡萄球菌 Staphylococcus aureus是一种重要的致病菌,可以引起人和动物的多种疾病,尤其它是引起奶牛乳房炎的主要病原菌,给奶牛业造成了巨大的经济损失[1-3]。目前,抗生素和金黄色葡萄球菌全菌苗、类毒素等传统疫苗是临床上预防和治疗奶牛金黄色葡萄球菌性乳房炎的主要方法,但是抗生素的耐药性、药物残留和传统疫苗免疫原性低等问题,一直以来都是亟待解决的重要难题[4-6]。近年来,研究发现菌体表面蛋白疫苗要比传统疫苗具有许多优点。它可引起机体产生较强的免疫应答,并且免疫持续时间长,同时它还可解决抗原血清型限制性等问题,这些优点使菌体表面蛋白可以作为新型疫苗。为了研究金黄色葡萄球菌菌体表面 Isdb蛋白的免疫原性,本研究通过基因工程方法表达Isdb蛋白,并将纯化的表达蛋白免疫小鼠,研究该蛋白的免疫原性,为进一步研制和开发金黄色葡萄球菌新型疫苗提供了有利参考。
1 材料与方法
1.1 材料
菌株、质粒:金黄色葡萄球菌标准菌株Wood46(S. aureus Wood46) 和地方分离菌株HLJ23-1(S. aureus HLJ23-1)、E. coli BL21宿主菌、原核表达载体pET32a(+) 均由黑龙江省八一农垦大学生物工程实验室提供。
主要试剂及酶:质粒提取试剂盒、限制性内切酶 Nco I/Xho I、Taq DNA聚合酶、DNA连接酶、蛋白marker、MagneHis™蛋白纯化系统、HRP标记的羊抗鼠抗体均购自大连宝生物工程有限公司;细胞因子 ELISA定量检测试剂盒购自 BPB Biomedical公司。
实验动物:昆明洁净级小鼠,体重约10~15 g,由长春市养殖场提供。
1.2 方法
1.2.1 表达载体的构建
引物设计:根据GenBank中的isdb基因序列,利用DNAStar软件设计1对扩增isdb编码全基因的特异性引物,并且引物两端分别加上酶切位点Nco I和Xho I的碱基序列 (下划线所示),经分析后引物具有很好的特异性。引物序列见表 1,由上海生工生物工程技术服务有限公司合成。
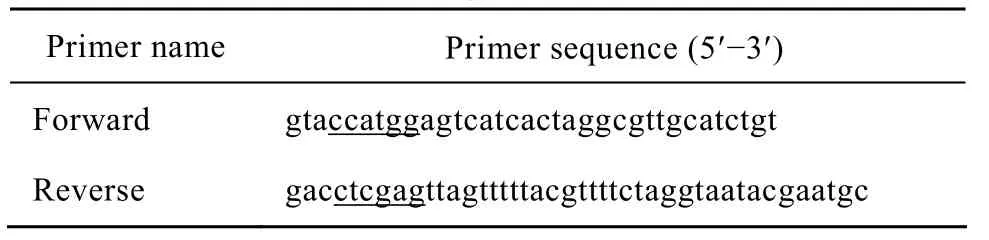
表1 融合基因引物Table 1 Primers for fusion gene
isdb编码基因的获得:采用蛋白酶方法提取金黄色葡萄球菌Wood46株的基因组DNA,并将其作为模板进行 PCR扩增。PCR反应体系组成如下:去离子水 14.3 µL,上游引物 1 µL (25 µmol/L)和下游引物 1 µL (25 µmol/L),DNA 模板 0.5 µL,2.5 mmol/L dNTPs 1 µL,10×PCR 缓冲液 2 µL,10 U/µL Taq DNA 聚合酶 0.2 µL,总反应体系为20 µL。PCR反应条件为:94 ℃预热3 min;94 ℃40 s,56 ℃ 50 s,72 ℃ 1 min ,30个循环;最后72 ℃延伸10 min。PCR反应结束后,取3 µL产物进行1%琼脂糖凝胶电泳。
酶切与连接及转化:将纯化的 PCR产物和pET32a(+) 载体酶切,酶切体系包括:10×NEB缓冲溶液 5 µL,PCR 产物 8 µL,100×BSA 0.5 µL,Nco I 1 µL,Xho I 1 µL,ddH2O 34.5 µL,混匀后,37 ℃水浴中酶切4 h。再将纯化的酶切产物进行连接,连接体系为:Solution I 5 µL (含 T4 DNA 连接酶),PCR产物 4 µL,载体 11 µL,最后 16 ℃连接 6 h。将上述连接产物加入感受态细胞中按热休克方法进行转化。
表达载体的鉴定:上述转化的菌培养12 h后,用质粒提取试剂盒提取质粒。采用酶切和测序分析的方法对提取的重组质粒进行鉴定,将获得正确的重组质粒命名为 pET32a(+)-isdb,从而获得 isdb原核表达载体。
1.2.2 重组Isdb蛋白的诱导表达及纯化
将构建的重组菌50 µL接种于含100 µg/mL氨苄青霉素的LB培养基中,37 ℃培养至OD600为0.4时,加入IPTG诱导表达4 h后,取1 mL菌液,10 000 r/min离心,弃上清,在沉淀中加入90 µL 1×上样缓冲液和 10 µL DTT (1 mmol/L) 后,煮沸5 min,取15 µL用于SDS-PAGE,同时,以未诱导重组菌和诱导的 pET32a(+) 空载体的重组菌为对照。另外,采用镍颗粒蛋白纯化试剂盒进行蛋白纯化,然后取10 µL蛋白浓缩液用于SDS-PAGE电泳检测蛋白纯化效果。
1.2.3 动物免疫
取健康小鼠62只,随机分成2组,每组31只,分别为对照组和Isdb蛋白免疫组。首免时对照组和蛋白免疫组每只小鼠分别用200 µL弗氏完全佐剂和与PBS乳化物 (体积比1∶1) 和200 µL Isdb蛋白免疫原 (含有100 µg Isdb蛋白PBS溶液与弗氏完全佐剂等体积乳化制成) 免疫。首疫后第21天进行2次免疫,对照组每只小鼠采用200 µL弗氏不完全佐剂与PBS乳化物 (体积比1∶1) 免疫,蛋白免疫组用200 µL Isdb 蛋白免疫原 (含有 100 µg Isdb 蛋白 PBS溶液与弗氏不完全佐剂等体积乳化制成) 免疫,免疫途径均为背部多点注射。在一免后7 d、14 d、21 d及二免后7 d、14 d进行采血,每次每组随机取3只小鼠采血,分离血清,用于抗体水平检测,每组剩16只小鼠用于攻毒试验。
1.2.4 重组Isdb蛋白的免疫原性检测
重组Isdb蛋白的Western blotting检测:将未经诱导和IPTG诱导4 h的样品进行SDS-PAGE。按半干转印法将胶中的蛋白质转移至 Nitrocellulose膜上,用金黄色葡萄球菌全菌体疫苗免疫二免 2周后的稀释1 000倍小鼠血清为一抗;HRP标记的羊抗小鼠为二抗,用立春红显色法显色,进行重组蛋白的Western blotting检测。
水平的测定:将作适当稀释的Isdb纯化蛋白以100 µL/孔(60 ng) 包被 ELISA 板,4 ℃过夜;PBST洗涤后加封闭液37 ℃封闭1 h;PBST洗涤,加入用5%脱脂奶粉稀释的待检免疫血清,37 ℃作用1 h;PBST洗涤后,加入HRP标记的羊抗鼠IgG(1 ∶ 1 0 000),37 ℃作用1 h;PBST洗涤后,每孔各加入TMB 100 µL溶液,避光37 ℃作用10 min;加50 µL终止液;最后测样品OD值并分析。
小鼠攻毒试验:取 50 µL −20 ℃冻存的 S. aureus Wood46 (Ⅴ型荚膜) 和S. aureus HLJ23-1 (Ⅷ型荚膜) 菌液接种到5 mL TSB培养基中,37 ℃培养复壮后,按平板计数法测定菌数,取对数生长期的细菌用PBS 洗涤3次后,根据测定以上两种菌对小鼠的最小致死量分别为3×109CFU和1×109CFU,最终将两种菌终浓度分别定为 1.5×1010CFU/mL和5×109CFU/mL。用两种菌分别对二免2周的Isdb蛋白免疫组和对照组各 8只小鼠攻毒,每只腹腔注射菌液0.2 mL,攻毒后,每天观察小鼠死亡情况并记录结果。
2 结果
2.1 isdb基因PCR扩增结果
以提取的金黄色葡萄球菌Wood46菌株DNA为模板,经PCR扩增得到一条特异DNA条带,与预期片段大小 (1 893 bp) 相符,电泳结果如图1所示。
2.2 重组质粒的鉴定结果
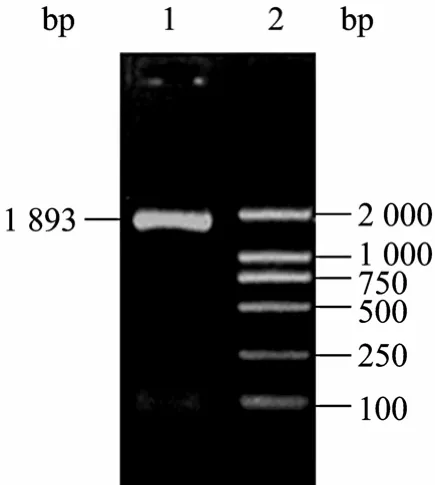
图1 isdb基因的PCR产物Fig. 1 PCR products of isdb. 1: PCR products; 2: DNA marker.
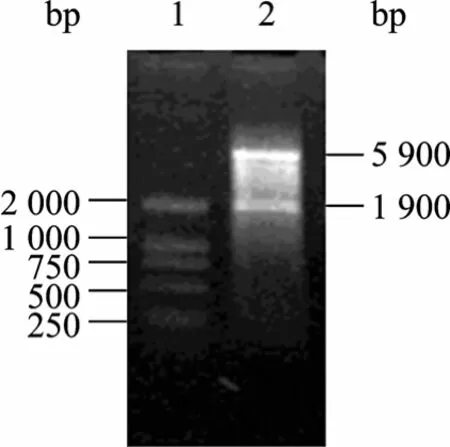
图2 pET32a(+)-isdb的酶切鉴定Fig. 2 Identification of pET32a(+)-isdb by enzyme digestion.1: DNA marker; 2: pET32a(+)-isdb Digested with Nco I and Xho I.
pET32a(+)-isdb质粒采用Nco I与Xho I双酶切后,经过琼脂糖电泳,可见插入的片段与目的片段大小相符,酶切后得到约为1 900 bp和5 900 bp的两条带,如图2所示。目的基因测序结果与GenBank上 4种标准菌株 (Staphylococcus aureus MW2,Staphylococcus aureus COL,Staphylococcus aureus N315,Staphylococcus aureus NEMAN) 的核酸和氨基酸之间比较同源性均为98.5%以上 (图3、4),说明不同菌株间isdb具有较高的同源性。以上结果表明目的基因插入正确。
2.3 重组菌的表达结果
重组菌诱导表达后进行SDS-PAGE电泳,结果在大于87 kDa位置出现1条明显的条带,与预测的重组蛋白Isdb (87.3 kDa) 大小相符 (图5)。
2.4 Isdb蛋白的Western blotting检测结果
应用S. aureus全菌免疫小鼠的血清为一抗体,测定重组蛋白的免疫原性,结果显示在87 kDa位置出现特异性条带,说明重组蛋白Isdb能与免疫血清发生反应并具有好的免疫原性 (图6)。
2.5 重组蛋白的免疫效果检测
2.5.1 IgG水平的测定结果
将每份一免小鼠血清1:1 000倍稀释后,再做2倍倍比稀释 (每组3只小鼠血清),即做1:2 000、1:4 000、1:8 000、1:16 000、1:32 000、1:64 000倍稀释。二免小鼠以1:4 000、1:8 000、1:16 000、1:32 000、1:64 000、1:128 000、1:256 000、1:512 000倍稀释,以羊抗鼠IgG为二抗做间接ELISA检测血清中IgG。结果小鼠免疫后Isdb抗体效价有明显提高,并随着免疫时间推移,抗体效价逐渐上升,并在二免2周时抗体效价达到高峰 (表2)。

图3 核酸序列的比较Fig. 3 Comparison of nucleic acid sequence.

图4 氨基酸序列的比较Fig. 4 Comparison of amino acid sequence.
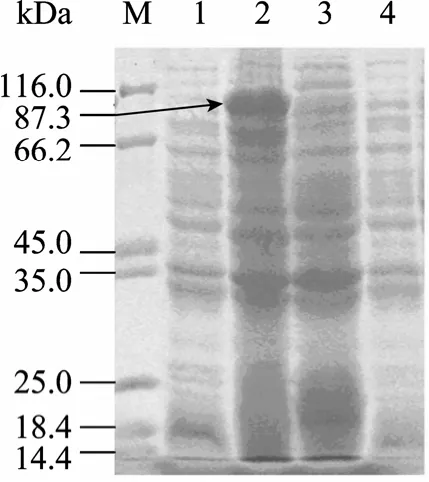
图5 重组菌诱导表达结果Fig. 5 Expression of induced recombinant E. coli. M: protein marker; 1: uninduced recombinant E. coli (pET32a(+)-isdb); 2:induced recombinant E. coli (pET32a(+)-isdb); 3: induced recombinant E. coli (pET32a(+); 4: uninduced recombinant E. coli (pET32a(+)).

图6 Isdb蛋白的Western blotting结果Fig. 6 Western blotting analysis of Isdb protein. 1: induced recombinant E. coli (pET32a(+)-isdb); 2: purified Isdb protein;3: protein marker.
2.5.2 攻毒实验结果
各免疫组在二免2周后,每组随机选出8只小鼠分别用S. aureus Wood46和S. aureus HLJ 23-1菌株攻毒,攻毒后 1周内观察小鼠的死亡情况。结果表明:S. aureus Wood46株攻毒组中,对照组小鼠全部死亡时,Isdb蛋白免疫组的保护率为 62.5%;S. aureus HLJ 23-1株攻毒组中,对照组小鼠全部死亡时,Isdb蛋白免疫组的保护率为 75%,如表3所示。
3 讨论
目前,金黄色葡萄球菌耐药菌株的不断出现给临床上疾病的预防和治疗带来了巨大的困难,这也使金黄色葡萄球菌性奶牛乳房炎解决的问题变得更加严峻。在过去的40多年里,人们对金黄色葡萄球菌全菌灭活苗、荚膜多糖结合苗以及菌体结构蛋白亚单位苗等作了大量研究,但免疫保护效果都不令人满意。研究学者发现金黄色葡萄球菌表面蛋白具有很好的免疫原性,将是解决金黄色葡萄球菌性疾病一个新的研究方向[7]。Isdb是Sortase A锚定在金黄色葡萄球菌细胞壁上的一种蛋白,它在金黄色葡萄球菌转运宿主血红蛋白过程中发挥重要作用[8-9]。Kuklin等研究表明 Isdb具有高度的保守性,并且Isdb蛋白对猕猴均有良好的免疫原性[10],但是,目前Isdb蛋白对其他动物的免疫原性的研究较少。
本研究表明Isdb蛋白能够刺激小鼠产生良好的体液免疫,并且对 S. aureus Wood46和 S. aureus HLJ23-1两种不同的菌株攻毒保护率分别为 62.5%和75%,这种保护效果要比Gaudreau等研究的Clfa、FnBPA和Sortase酶 (Srt) 多蛋白的DNA疫苗的保护率高出10%左右[11],与冯昊等研究的Clfa蛋白的保护率比较接近[12],这进一步说明Isdb蛋白具有较好的免疫原性。Isdb蛋白不能完全起到保护作用的原因可能与金黄色葡萄球菌的致病因子的多样性有关,也与金黄色葡萄球菌能通过荚膜阻止吞噬细胞的调理作用和产生多种免疫逃避因子以使自身逃避宿主免疫反应有直接关系[13],所以,要想解决金黄色葡萄球菌的感染问题,还需要进一步提高Isdb蛋白的保护率。随着对这种病原菌认识的不断深入和对金黄色葡萄球菌疫苗的研究探索,有学者提出预防金黄色葡萄球菌感染需要使用多抗原成分疫苗有望提高疫苗的保护率[14-15],这样不同蛋白联合免疫可以一定程度上提高其免疫效果[16],至少不应该比单一抗原免疫保护效果差[17]。所以,Isdb蛋白与金黄色葡萄球菌表面其他的结构蛋白组成联合疫苗有可能提高其免疫效果。另外,以上两种菌保护率的差异可能是两种菌不同荚膜型对抗吞噬作用影响程度的不同所致,也有可能是细菌本身毒力差异不同所致。要想澄清以上两种菌株保护率差异的问题还需要进一步深入研究。本研究为临床预防和治疗奶牛乳房炎疾病提供了有利参考,也为解决人的金黄色葡萄球菌性疾病提供了很好借鉴。

表2 免疫鼠血清中Isdb的IgG抗体效价Table 2 Antibody titer of IgG in the sera of the immunized and control mice
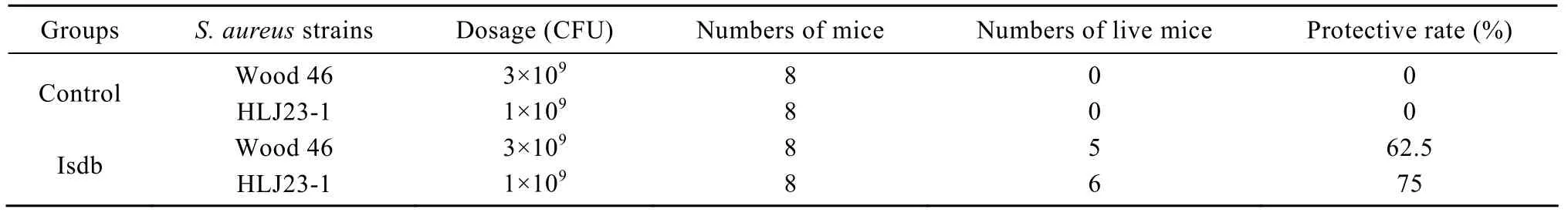
表3 不同金黄色葡萄球菌菌株攻毒结果Table 3 Challenge of immunized mice with S. aureus strains
REFERENCES
[1] Watts A, Ke D, Wang Q, et al. Staphylococcus aureus strains that express serotype 5 or serotype 8 capsular polysaccharides differ in virulence. Infect Immun, 2005,73(6): 3502−3511.
[2] Thakker M, Park JS, Carey V, et al. Staphylococcus aureus serotype 5 capsular polysaccharide is antiphagocytic and enhances bacterial virulence in a murine bacteremia model. Infect Immun, 1998, 66(11): 5183−5189.
[3] Karakawa WW, Sutton A, Schneerson R, et al. Capsular antibodies induce type-specific phagocytosis of capsulated Staphylococcus aureus by human polymorphonuclear leukocytes. Infect Immun, 1988, 56(5): 1090−1095.
[4] Hiramatsu K, Hanaki H, Ino T, et a1. Methicillin-resistant Staphylococcus aureus clinical strain with reduced vancomycin susceptibility. Anfimicmb Chemother, 1997,40(1): 135−136.
[5] Kerro-Dego O, Prysliak T, Potter AA, et al. DNA-protein immunization against the GapB and GapC proteins of a mastifs isolate of Staphyloococcus aureus. Vet Immunol Immunopathol, 2006, 13(1/2): 125−138.
[6] Zhang YY, Liang DR, Xu N. Clinical investigation and drug tolerance of Staphylococcus aureus (SA) on hospital infections. Chin J Infect Chemoth, 2002, 2(4): 241−242.
张勇扬, 梁德荣, 徐楠. 金黄色葡萄球菌医院感染的临床调查及其耐药性. 中国抗感染化疗杂志, 2002, 2(4):241−242.
[7] Stranger-Jones YK, Bae T, Schneewind O. Vaccine assembly from surface proteins of Staphylococcus aureus.Proc Natl Acad Sci USA, 2006, 103(45): 16942−16947.
[8] Marraffini LA, Dedent AC, Schneewind O. Sortases and the art of anchoring proteins to theenvelopes of Gram-positive bacteria. Microbiol Mol Biol Rev, 2006,70(1): 192−221.
[9] Maresso AW, Schneewind O. Iron acquisition and transport in Staphylococcus aureus. BioMetals, 2006,19(2): 193−203.
[10] Kuklin NA, Clark DJ, Secore S, et al. A novel Staphylococcus aureus vaccine: iron surface determinant B induces rapid antibody responses in rhesus macaques and specific increased survival in a murine S. aureus sepsis model. Infect Immunity, 2006, 74(4): 2215−2223.
[11] Gaudreau MC, Lacasse P, Talbot BG. Protective immune responses to a multi-gene DNA vaccine against Staphylococcus aureus. Vaccine, 2007, 25(5): 814−824.
[12] Feng H, Liu LF, Chi JQ, et al. Immunogenicity of Staphylococcus aureus recombinant clumping factor A.Chin J Biotech, 2009, 25(8): 1180−1186.冯昊, 刘乐锋, 迟佳琦, 等. 金黄色葡萄球菌凝集因子A的免疫原性. 生物工程学报, 2009, 25(8): 1180−1186.
[13] Foster TJ. Immune evasion by staphylococci. Nat Rev Microbiol, 2005, 3(12): 948−958.
[14] Middleton JR. Staphylococcus aureus antigens and challenges in vaccine development. Expert Rev Vaccines,2008, 7(6): 805−815.
[15] Schaffer AC, Lee J C. Vaccination and passive immunisation against Staphylococcus aureus. Infect Dis Clin North Am, 2009, 23(1): 153−171.
[16] Stranger-Jones YK, Bae T, Schneewind O. Vaccine assembly from surface proteins of Staphylococcus aureus.Proc Natl Acad Sci USA, 2006, 103(45): 16942−16947.
[17] Zhou H, Xiong ZY, Li HP, et al. An immunogenicity study of a newly fusion protein Cna-FnBP vaccinated against Staphylococcus aureus infections in a mice model.Vaccine, 2006, 24(22): 4830−4837.
Cloning and expression of Staphylococcus aureus surface protein Isdb and its immune experiment in mice
Jinzhu Ma1, Yudong Cui1,2, Jing Zhang1, Zhanbo Zhu2, and Fanze Piao2
1 College of Life Science and Biotechnology, Heilongjiang Bayi Agricultural University, Daqing 163319, China
2 College of Animal Science and Veterinary Medicine, Heilongjiang Bayi Agricultural University, Daqing 163319, China
Received: August 31, 2010; Accepted: December 28, 2010
Corresponding author: Yudong Cui. Tel: +86-459-6819290; E-mail: cuiyudong@yahoo.com
