骨唾液酸蛋白基因沉默抑制乳腺癌细胞与骨基质粘附
2011-09-29王丽王捷杨德猛杨传红夏冰王江涛冼江
王丽,王捷,杨德猛,杨传红,夏冰,王江涛,冼江
1 华南理工大学生物科学与工程学院,广州 510006
2 广州军区广州总医院医学实验科,广州 510010
骨唾液酸蛋白基因沉默抑制乳腺癌细胞与骨基质粘附
王丽1,2,王捷2,杨德猛1,2,杨传红2,夏冰2,王江涛2,冼江2
1 华南理工大学生物科学与工程学院,广州 510006
2 广州军区广州总医院医学实验科,广州 510010
旨在探索骨唾液酸蛋白 (Bone sialoprotein,BSP) 基因沉默对亲骨转移乳腺癌细胞 (MDA-MB-231BO) 与骨基质粘附能力的影响,为以BSP为靶点的乳腺癌骨转移预防和靶向治疗提供实验依据。体外检测BSP基因沉默对乳腺癌细胞与小鼠骨基质粘附能力的影响,MTS法检测细胞增殖能力;扫描电镜观察骨片表面肿瘤细胞粘附情况和骨吸收状况;ELISA法检测骨基质细胞粘附培养上清中TGF-β1和RANKL表达分泌量差异;左心室注射法构建裸鼠骨转移模型,检测不同细胞株在裸鼠体内转移能力。结果提示BSP基因沉默可抑制亲骨转移乳腺癌细胞与骨基质粘附能力和增殖能力。亲骨转移乳腺癌细胞易与骨基质发生粘附,粘附部位可见骨吸收造成的骨基质破坏。BSP基因沉默引起部分细胞表面形态的改变,并对TGF-β1和RANKL的表达和分泌具有抑制作用。裸鼠骨组织X线检查和HE染色结果显示,沉默BSP基因可在一定程度上抑制骨转移发生和转移灶发展。结果证实BSP基因沉默可抑制亲骨转移乳腺癌细胞增殖、骨基质粘附,影响细胞表面形态,进而抑制骨转移。
骨唾液酸蛋白,基因沉默,乳腺癌,骨转移,骨基质粘附
Abstract:We performed this research mainly to explore the effect of bone sialoprotein (BSP) silence by siRNA on the adhesion ability to bone matrix of bone-seeking breast cancer cells (MDA-MB-231BO). Also we aimed to provide experimental data for prevention and treatment of breast cancer bone metastasis by targeting BSP. We explored the effects of BSP gene silence on characteristics of bone-seeking breast cancer cells: proliferation by MTS[3-(4,5-dimethylthiazol-2-yl)-5-(3-carboxymethoxyphenyl)-2-(4-sulfophenyl)-2H-tetrazolium, inner salt] assay, bone adhesion ability by a mouse bone adhesion model in vitro, morphology of the cells by SEM, and secretion of transforming growth factor-β1(TGF-β1) and receptor activator ofnuclear factor-kappa B ligand (RANKL) by ELISA kits. We performed intra-cardiac injection in nude mice to explore bone metastatic ability of different cell lines. The results showed that knockdown of BSP significantly inhibited the proliferation of MDA-MB-231BO cells and their adhesion to bone matrix. We also observed bone destruction caused by bone resorption around some adhering cells. The appearances of the cells changed in BSP gene silenced group, and the secretion of TGF-β1and RANKL decreased. The results showed BSP gene silence can partial inhibition bone metastasis of breast cancer cells in nude mice by X-ray assay and hematoxylin-eosin staining. Based on our research, siRNA-mediated BSP silencing can inhibit proliferation and adhesion to bone matrix of bone-seeking breast cancer cells and change their surface structure, thus inhibits their bone metastatic ability.
Keywords:bone sialoprotein, gene silencing, breast cancer, bone metastasis, bone matrix adhesion
骨唾液酸蛋白 (Bone sialoprotein,BSP) 是一种高度磷酸化和糖基化的分泌性蛋白,富含唾液酸,平均分子量约 75 kDa,属于 SIBLINGs (Small integrin-binding ligand N-linked glycoproteins) 家族成员。BSP主要分布在矿质化的组织中,由成骨细胞、破骨细胞以及软骨细胞表达和分泌。1994年Bellahcence等首次阐述了BSP在易发生骨转移的人乳腺癌中表达[1]。多项研究提示BSP在肿瘤的粘附、增殖、侵袭、基质降解、免疫反应 (炎症和补体逃逸)、血管生成等转移相关的多个过程中发挥重要作用。BSP cDNA全片段转染的人乳腺癌细胞系MDA-MB-231-BAG可使裸鼠体内的乳腺癌转移灶明显增大[2]。在高表达 BSP的转基因小鼠体内,乳腺癌导致的骨和全身性转移灶明显增加[3]。而下调BSP可以抑制乳腺癌细胞的骨转移,减少溶骨性骨损伤面积[4]。转化生长因子β (TGF-β) 是影响骨转移进程的重要细胞因子之一,在破骨细胞进行骨吸收时储存在骨中的TGF-β从骨中释放,刺激乳腺癌细胞产生破骨细胞的强力趋化因子——甲状旁腺激素相关蛋白,活化破骨细胞,促进骨吸收[5]。肿瘤细胞与骨基质粘附是乳腺癌骨转移发生的关键环节之一,我们前期研究发现 BSP单克隆抗体对MDA-MB-231BO和骨基质黏附具有特异抑制作用[5],并通过RNAi技术获得BSP基因抑制表达的乳腺癌细胞231BO-BSP27[6]。该细胞株BSP基因在mRNA水平和蛋白水平抑制效率分别为 70.8%和69.3%[6],一段时间后 (超过20代) 再检测BSP蛋白表达抑制率为 69.3%[7],由此认为沉默效果基本稳定。本研究拟检测BSP基因沉默对231BO-BSP27与骨基质粘附能力的影响,并通过扫描电子显微镜观察细胞表面形态及其在骨片表面的粘附情况。为深入研究 BSP在乳腺癌骨转移中的调控机制,以及 BSP为靶点的乳腺癌骨转移的预防和治疗打下基础。
1 材料与方法
1.1 实验动物与试剂
昆明种雌性小鼠[实验动物合格证号(KM)060931](20±2)g,BALB/C-nu/nu 雌性裸鼠[实验动物合格证号:0058418] (14~16) g,SPF级,由广东中医药大学实验动物中心提供。亲骨转移乳腺癌细胞系 (MDA-MB-231BO,简称231BO) 由美国德州大学圣安东尼健康科学中心 Yoneda教授惠赠。经siRNA重组逆转录病毒感染稳定沉默 BSP基因表达的亲骨转移乳腺癌细胞系 (MDA-MB-231BO-BSP27,简称 231BO-BSP27) 和转染无关质粒的阴性对照亲骨转移乳腺癌细胞系 (MDA-MB-231BO-Scrambled,简称 231BO-Scrambled) 由本实验室制备[6]。小鼠TGF-β1 ELISA试剂盒购自博士德公司。小鼠RANKL ELISA试剂盒购自R&D公司。Ⅰ型胶原酶(201 U/mg) 购自 Gibco公司。胰蛋白酶购自Invitrogen公司。MTS购自 Promega公司。胎牛血清和DMEM培养液购自Hyclone公司。
1.2 细胞培养
231BO、231BO-BSP27、231BO-Scrambled乳腺癌细胞在含 10%胎牛血清的 DMEM 培养液、5%CO2、37 ℃条件下培养。
1.3 BSP基因沉默对亲骨转移乳腺癌细胞与骨基质粘附能力的影响
在24孔组织培养板中,将胶原酶和胰蛋白酶溶液处理的小鼠顶骨 (Parietal bones) 骨片固定于1%琼脂表面[5,8],各孔分别加入1 mL浓度为105个/mL的231BO、231BO-BSP27和231BO-scrambled细胞,对照组无肿瘤细胞。37 ℃、5% CO2孵育48 h。镜下观察骨片粘附情况。收集粘附到骨片上的细胞,经过甲苯胺蓝染色,测定OD488。以OD488值变化间接计算 3株肿瘤细胞与骨片粘附的相对数量差异,实验重复4次,总计16组。粘附抑制率%= (1−沉默组 OD488/亲代组 OD488) ×100%。
为验证粘附差异是否由 3株细胞增殖速度不同造成,在无骨片的条件下按上述方法重复实验,分别于24、48、72 h吸取细胞悬液100 μL转移到96孔板,并通过MTS法检测细胞增殖。其中24孔板做3个重复,96孔板做6个重复。增殖抑制率%=(1−沉默组 OD/亲代组 OD)×100%,其中 OD=OD490−OD620。
1.4 扫描电镜观察肿瘤细胞粘附状况
按1.3的方法将肿瘤细胞和骨片共培养72 h。经3%戊二醛 (pH 7.0) 固定后,梯度脱水、冷冻干燥、溅射,扫描电镜观察骨片表面细胞形态及粘附状况。以相同条件培养72 h但无肿瘤细胞的空白骨片作对照。
1.5 ELISA 检测沉默 BSP 对 TGF-β1、RANKL表达的影响
用小鼠 RANKL ELISA检测试剂盒和小鼠TGF-β1ELISA检测试剂盒检测上述48 h培养上清的RANKL和TGF-β1含量,以无肿瘤细胞的空白骨片和不添加骨片的细胞培养上清作对照。在450 nm检测紫外吸收,以620 nm为参考波长。每个样品做3个重复。
1.6 BSP基因沉默对乳腺癌细胞体内骨转移能力的影响
将21只4~6周龄的雌性裸鼠随机分为3组,每组7只,分别于左心室注射0.1 mL浓度为2.5×106个/mL的231BO、231BO-BSP27和231BO-scrambled细胞。第4周X射线检查骨损伤程度。处死后取四肢骨组织,经固定、脱钙、石蜡包埋、冷冻切片,HE染色观察组织切片转移灶的有无、数量和大小。
1.7 数据统计
2 结果与分析
2.1 BSP基因沉默抑制乳腺癌细胞与骨基质粘附
将3种乳腺癌细胞分别与骨片共培养48 h,显微镜下可见 3种细胞在骨片表面结团生长,而空白对照组没有。紫外分光光度计检测结果显示231BO-BSP27在488 nm处的吸光值明显小于其他2组 (表1)。以上数据表明稳定沉默BSP基因可以抑制亲骨转移乳腺癌细胞与骨基质的粘附,抑制率为48.53% (P<0.01),231BO-Scrambled组与 231BO组无显著差异 (P>0.05)。而且,BSP基因沉默对细胞粘附的抑制率明显大于其对细胞增殖的抑制率,即沉默BSP可以抑制乳腺癌细胞与骨基质粘附能力。
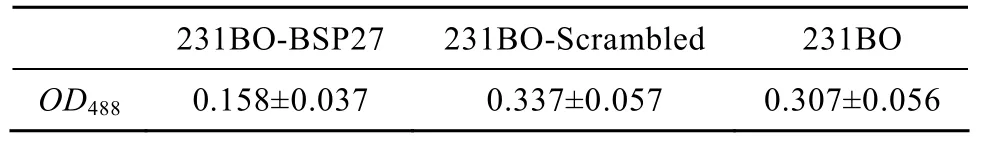
表1 BSP基因沉默抑制231BO细胞与骨基质粘附 (n=16)Table 1 BSP silence inhibited the adhesion of 231BO cells to bone matrix (n=16)
MTS检测 3种乳腺癌细胞 231BO、231BOBSP27、231BO-Scrambled在琼脂表面的增殖能力,结果显示 BSP基因沉默对亲骨转移乳腺癌细胞细胞增殖具有抑制作用 (图1)。0 h各组细胞数量无明显差异,在24 h、48 h和72 h的抑制率分别为17.40%、19.55%和 19.54% (P<0.01),231BO-Scrambled组与231BO组无显著差异 (P>0.05)。
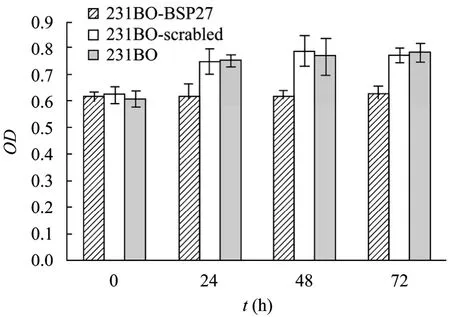
图1 BSP基因沉默对231BO细胞增殖的影响 (n=6)Fig. 1 BSP silence inhibited the proliferation of 231BO cells(n=6).
2.2 扫描电镜观察骨片表面细胞粘附和骨损伤状况
扫描电镜观察可见,接种乳腺癌的骨片表面粘附大量细胞,而对照组没有 (图2A~2D)。粘附在骨片表面的 231BO-BSP27没有其他 2株细胞排列密集,这一结论与前面检测到的3株细胞的粘附差异相吻合,但因细胞分散不十分均匀,因此不能作为定量指标。部分细胞紧密粘附在骨片表面,并伸展成梭形 (图 2E左侧细胞);部分细胞在发生粘附时出现结团现象,低倍镜下呈现花样外观 (图2A~2C),高倍镜下可见底层细胞与骨表面紧密粘附;部分细胞连接紧密,胞间分界不清晰 (图2E)。乳腺癌细胞表面密布小突起和泡状结构,通过表面伸出的丝状结构紧密粘附于骨表面,并可见粘附细胞周围明显的骨质破坏 (图2F)。高倍镜观察发现231BO-BSP27细胞中存在异常的细胞表面形态 (图 2G)——细胞表面相对光滑,泡状结构明显减少,表面凸起皱缩呈绒毛状,细胞表面出现小孔 (图 2G箭头所示)。而 231BO和 231BO-Scrambled则未见此状(图 2F~2H)。由此可见BSP基因沉默可能导致细胞表面形态的改变,进而影响细胞粘附能力和亲骨转移能力。
2.3 BSP基因沉默抑制骨基质分泌 TGF-β1和RANKL
TGF-β1和RANKL的ELISA检测结果 (图3) 显示,沉默BSP基因可以下调乳腺癌细胞与骨基质粘附过程中 TGF-β1和 RANKL的表达和分泌。其对TGF-β1的影响较大,与亲代231BO相比抑制率可达51.92% (P<0.01),对RANKL也有一定影响,抑制率为 21.15% (P<0.01)。而 TGF-β1和 RANKL 在另2个骨片细胞共培养组的表达量没有显著差异,细胞单独培养各组差异也不显著。但细胞和骨片共培养组表达量并不等于相应两者单独培养表达量之和,这一现象可能与培养环境、营养条件等多种因素相关。
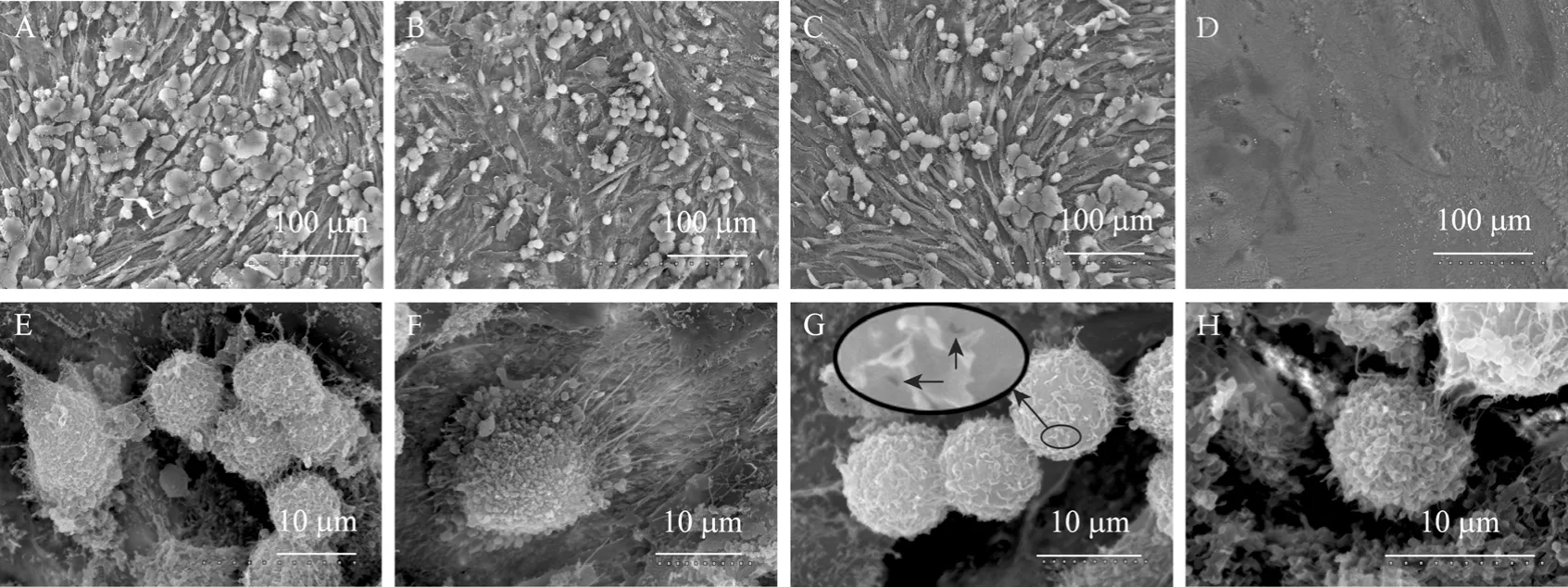
图2 SEM观察粘附细胞表面超微结构Fig. 2 Surface ultrastructural characteristics of adhering cells as depicted under the SEM. (A) 231BO. (B) 231BO-BSP27. (C)231BO-Scrambled. (D) blank bone matrix. (E) 231BO-Scrambled. (F) 231BO. (G) 231BO-BSP27. (H) 231BO-Scrambled.
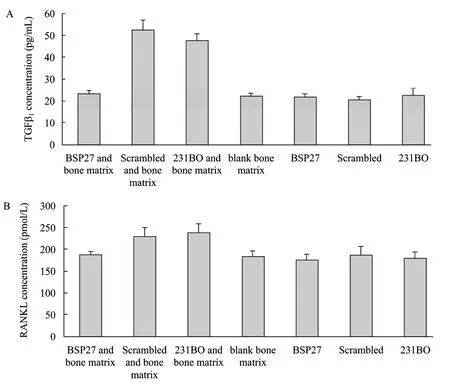
图3 BSP基因沉默降低细胞与骨片共培养上清中TGF-β1(A) 和RANKL (B) 水平Fig. 3 BSP silence decreased the level of TGF-β (A) and RANKL (B) in cell-bone coculture supernatant, detected by the ELISA assay.
2.4 BSP基因沉默抑制乳腺癌细胞骨转移发生
左心室注射模型是研究肿瘤细胞体内骨转移能力的经典方法。但心内注射容易引起小鼠死亡,建模难度较大。本研究中231BO组和231BO-scrambled组分别有2只裸鼠在心内注射2 h内死亡,因此未纳入数据统计 (表2)。

表2 乳腺癌细胞在裸鼠体内的骨转移率Table 2 Rates of breast cancer bone metastasis in nude mice
本研究X线照片检查异常表现包括 (图4):骨皮质欠连续或缺损、骨膜反应、周围软组织肿胀、虫蚀样骨质破坏或大片骨质破坏、甚至病理性骨折。综合3组裸鼠X光拍摄结果来看,231BO-BSP27组裸鼠比其他2组裸鼠骨损伤数目少,损伤度低。
正常的骨组织经HE染色后可见完整的骨髓腔,腔内分散体积较小且均一的蓝色骨髓细胞,以及一些分散的红色血细胞。出现转移灶的病理性骨组织中,肿瘤细胞比正常的骨髓细胞核浆比大,部分骨皮质因肿瘤细胞侵袭受到不同程度的损伤,许多肿瘤细胞聚集形成大小不规则的癌巢 (图5)。

图4 裸鼠骨损伤X光照片Fig. 4 X-ray scans of bone lesion of nude mice. (A) Healthy bone tissue. (B−D) Bone tissues with bone lesion.
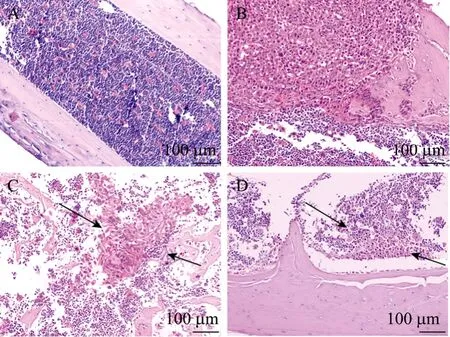
图5 骨组织HE染色结果Fig. 5 Results of HE stain of bone tissue. (A) Healthy bone tissue. (B−D) Bone tissues with breast cancer metastasis.
3 讨论
研究发现BSP与乳腺癌骨转移密切相关。多项研究证实,下调BSP可以抑制乳腺癌细胞的骨转移,减少动物模型中的溶骨性骨损伤面积。目前报道的降低BSP水平的方法有:反义核酸技术、BSP抗体抑制法、阻断BSP的转录途径——如通过氯丙嗪[9]、αvβ3[10]或 TGF-β 抗体[11]阻断 BSP 表达,通过脂多糖(LPS)[12]或肿瘤坏死因子-α (TNF-α)[13]阻断/促进蛋白激酶A和酪氨酸激酶依赖的途径抑制BSP基因转录,或利用siRNA和shRNA技术沉默BSP[6]等。上述方法都能够不同程度地降低细胞内BSP水平,然而,反义核酸技术虽然可以达到较高的沉默效率,仅仅是对BSP的瞬时沉默;鸡源和鼠源抗体在人体内的免疫原性、体内运输性差、毒副作用限制了BSP抗体药物的发展。用 RNAi技术沉默亲骨转移乳腺癌细胞中的BSP,可以稳定抑制BSP表达,有利于深入研究BSP在乳腺癌骨转移中的调控机制,并为实现以BSP为靶点的乳腺癌骨转移的预防和治疗打下基础。
乳腺癌细胞和骨基质的粘附是引起特异性骨转移的前提之一。BSP可能通过调节粘附过程影响骨转移,但目前国内外均未见有关BSP基因沉默与乳腺癌细胞骨基质粘附关系的报道。肿瘤细胞与小鼠颅骨的粘附模型[5,8]可以体外模拟人乳腺癌细胞亲骨转移的粘附过程,用于检测细胞与骨的粘附能力,同时避免了异种移植引起的免疫反应。本研究将 3株乳腺癌细胞分别置于经胶原酶消化的骨片表面培养,体外检测其粘附能力,证实稳定沉默BSP基因可抑制亲骨转移乳腺癌细胞与骨基质粘附,抑制率约48.53%。由于骨基质主要由I型胶原和非胶原蛋白组成,而乳腺癌一般不会发生以胶原为主要成分的组织转移 (如韧带、皮肤) 因此推测乳腺癌骨转移是通过肿瘤细胞与骨矿物质或破骨细胞结合实现的。小鼠骨片经 I型胶原酶消化后,骨组织细胞充分暴露,有利于与乳腺癌细胞相互作用,发生粘附。底层琼脂的加入可避免肿瘤细胞贴壁发生,可更好地模拟体内环境。
扫描电子显微镜可用于观察细胞表面形态,但未见将其应用于观察骨表面粘附肿瘤细胞的表面形态的报道,将之用于BSP基因沉默的亲骨转移乳腺癌细胞及其亲代细胞的观察也属首次。结果显示沉默BSP并不能完全抑制亲骨转移乳腺癌细胞粘附到骨基质表面,但是与亲代细胞和 Scrambled细胞相比粘附细胞量有所减少。由于细胞分散不是十分均匀,且观察视野有限,因此不能作为定量指标。部分乳腺癌细胞出现结团粘附,紧密粘附细胞在骨片表面伸展成梭形,底层细胞与骨表面紧密粘附,上层细胞通过与底层细胞的连接固定于骨片表面。乳腺癌细胞表面密布小突起和泡状结构,通过表面伸出的丝状结构紧密粘附于骨表面。BSP沉默还导致了部分细胞表面形态的改变。粘附细胞可造成周围骨质的明显破坏,但由于培养时间较短和肿瘤细胞的遮盖,未见明显的骨吸收陷窝。
裸鼠体内试验结果有力地印证了上述结论。乳腺癌骨转移的发生包含血管内渗、侵袭和粘附等多个环节,通过RNAi技术沉默BSP基因可以有效抑制亲骨转移乳腺癌细胞形成转移灶。
BSP基因沉默影响其与骨基质粘附可能原因有多种,本实验用 MTS法证实了BSP基因沉默可抑制乳腺癌细胞增殖。TGF-β和 RANKL是影响骨转移进程的重要细胞因子,可促进乳腺癌细胞与破骨细胞相互作用,促进溶骨性骨转移。Nam等[11]用抗TGF-β单克隆抗体处理乳腺癌小鼠模型,发现肺转移细胞中BSP表达下调,体外实验显示敲除BSP基因能够抑制TGF-β诱导局部胶原蛋白的降解和肿瘤细胞的侵袭能力。而且BSP Mab[5]和BSP基因沉默对骨基质中TGF-β1和RANKL的分泌均具有抑制作用。因此,对这一环节的影响也可能是BSP基因沉默抑制骨基质粘附的重要途径之一。此外,由于BSP的酸性多聚谷氨酸区域可提供与矿化基质结合的空间,RGD序列可与αVβ3结合,促进乳腺癌细胞与骨组织粘附发生,活化破骨细胞产生溶骨性骨吸收,从而促进乳腺癌细胞的骨转移进程[14]。BSP还能够促进体外破骨细胞表达并激活破骨细胞分化标志物(如Cathepsin K、TRAP和NFAT2),加速以自分泌方式进行的破骨细胞分化,进一步促进乳腺癌的溶骨性骨转移[3]。但是其具体的调控机制目前不是十分清晰,有待进一步研究证实。
REFERENCES
[1] Bellahcène A, Merville MP, Castronovo V. Expression of bone sialoprotein, a bone matrix protein, in human breast cancer. Cancer Res, 1994, 54(11): 2823−2826.
[2] Tu Q, Zhang J, Fix A, et al. Targeted overexpression of BSP in osteoclasts promotes bone metastasis of breast cancer cells. J Cell Physiol, 2009, 218(1): 135−145.
[3] Sharp JA, Waltham M, Williams ED, et al. Transfection of MDA-MB-231 human breast carcinoma cells with bone sialoprotein (BSP) stimulates migration and invasion in vitro and growth of primary and secondary tumors in nude mice. Clin Exp Metastasis, 2004, 21(1): 19–29.
[4] Peterschmitt J, Bäuerle T, Berger MR. Effect of zoledronic acid and an antibody against bone sialoprotein II on MDA-MB-231GFPbreast cancer cells in vitro and on osteolytic lesions induced in vivo by this cell line in nude rats. Clin Exp Metastasis, 2007, 24(6): 449−459.
[5] Gong YJ, Wang J, Song HX, et al. Inhibitory effects of bone sialoprotein monoclonal antibody on bone-seeking breast cancer cells adhering to bone matrix. Chin J Cancer Biotherapy, 2007, 14(6): 536−539.
龚应静, 王捷, 宋惠雪, 等. 骨涎蛋白单克隆抗体对亲骨转移乳腺癌细胞与骨基质黏附的抑制. 中国肿瘤生物治疗杂志, 2007, 14(6): 536−539.
[6] Yang ZF, Wang J, Zhang HB, et al. Inhibition of BSP gene expression in breast cancer cells by retrovirally mediated RNAi. J Med Mol Biol, 2009, 6(5): 415−419.
杨自飞, 王捷, 张宏斌, 等. 逆转录病毒载体介导的RNAi抑制乳腺癌细胞BSP基因表达. 医学分子生物学杂志, 2009, 6(5): 415−419.
[7] Yan H, Wang J, Yang ZF, et al. Effects of BSP RNAi on human breast cancer cell line MDA-MB231BO.Biotechnol Bull, 2010(6): 142−145.
燕慧, 王捷, 杨自飞, 等. BSP基因RNA干扰对乳腺癌MDA-MB-231BO细胞生物学特性的影响. 生物技术通报, 2010(6): 142−145.
[8] Du HY, Wang J, Yang J, et al. Studies on the effects of BSP over-expression in facilitating the metastasis of breast cancer cells to bone. Med J Chin PLA, 2007, 32(8):815−817.
杜红延, 王捷, 杨静, 等. 骨唾液蛋白 (BSP) 高稳定表达对乳腺癌骨转移的促进作用. 解放军医学杂志, 2007,32(8): 815−817.
[9] Nakajima Y, Kato N, Nakayama Y, et al. Effect of chlorpromazine on bone sialoprotein (BSP) gene transcription. J Cell Biochem, 2006, 97(6): 1198−1206.
[10] Bellahcène A, Boniean K, Fohr B, et al. Bone sialoprotein mediates human endothelial cell attachment and migration and promotes angiogenesis. Circ Res, 2000, 86(8):885−891.
[11] Nam JS, Suchar AM, Kang MJ, et al. Bone sialoprotein mediates the tumor cell–targeted prometastatic activity of transforming growth factor β in a mouse model of breast cancer. Cancer Res, 2006, 66(12): 6327−6335.
[12] Kato N, Nakayama Y, Nakajima Y, et al. Regulation of bone sialoprotein (BSP) gene transcription by lipopolysaccharide. J Cell Biochem, 2006, 97(2): 368−379.
[13] Samoto H, Shimizu E, MatsudaHonjo Y, et al. TNF-alpha suppresses bone sialoprotein (BSP) expression in ROS17/2.8 cells. J Cell Biochem, 2002, 87(3): 313−323.
[14] Uemura T, Liu YK, Feng Y, et al. The role of sialoprotein in recognition of bone surface by osteoblast via integrin.Mat Sci Eng, 1997, C4(4): 303−309.
Inhibitory effect of bone sialoprotein silencing on the adhesion ability of breast cancer cells to bone matrix
Li Wang1,2, Jie Wang2, Demeng Yang1,2, Chuanhong Yang2, Bing Xia2, Jiangtao Wang2,and Jiang Xian2
1 School of Bioscience and Bioengineering, South China University of Technology, Guangzhou 510006, China
2 Department of Medical Research, Guangzhou General Hospital of Guangzhou Military Command, Guangzhou 510010, China
Received: June 21, 2010; Accepted: September 25, 2010
Supported by: National Natural Science Foundation of China (No. 30700127), Hunan Provincial Natural Science Foundation of China (No. 08JJ3087).
Corresponding author: Zhonghua Liu. Tel: +86-731-8872556; Fax: +86-731-8861304; E-mail: liuzh@hunnu.edu.cn
国家自然科学基金 (No. 30700127),湖南省自然科学基金 (No. 08JJ3087) 资助。
