抗禽流感病毒H5N1分泌型IgA在中国仓鼠卵巢细胞中的表达
2011-09-29李存张宝中安小平米志强刘大斌姜焕焕潘博王盛陈斌黄芬王娟王晓娜童贻刚
李存,张宝中,安小平,米志强,刘大斌,姜焕焕,潘博,王盛,陈斌,黄芬,王娟,王晓娜,童贻刚
军事医学科学院微生物流行病研究所 病原微生物生物安全国家重点实验室,北京 100071
抗禽流感病毒H5N1分泌型IgA在中国仓鼠卵巢细胞中的表达
李存,张宝中,安小平,米志强,刘大斌,姜焕焕,潘博,王盛,陈斌,黄芬,王娟,王晓娜,童贻刚
军事医学科学院微生物流行病研究所 病原微生物生物安全国家重点实验室,北京 100071
分泌型IgA (SIgA) 在机体的粘膜免疫中具有重要作用,在外分泌道中比单体IgA和IgG抗体具有更好的抗感染活性。为了表达抗禽流感病毒H5N1人-鼠嵌合分泌型IgA抗体,首先以本室先前构建的稳定表达IgA的中国仓鼠卵巢细胞 (CHO) 细胞系为基础,共转染分泌片和J链表达质粒,然后用抗生素Zeocin选择阳性克隆细胞,利用倍比稀释的方法筛选分泌SIgA的单克隆细胞,通过Western blotting分析培养上清中SIgA的表达情况。结果表明,在CHO细胞中成功表达了SIgA抗体,上述研究为研制分泌型IgA抗体制剂奠定了良好的基础。
禽流感病毒H5N1,Western blotting,SIgA抗体
Abstract:Secretory IgA (SIgA) antibodies in external secretions play an important role in mucosal immune response. Polymeric SIgA was advantageous over monomeric IgA (mIgA) and IgG in several aspects. To express secretory IgA antibody against H5N1 virus, we constructed the secretory component and immunoglobulin J expressing plasmids and co-transfected the plasmids into the Chinese hamster ovary cells (CHO) stably expressing immunoglobulin A. Then we used Zeocin to select the positive clone cells,monoclonal cells stably secreting SIgA was screened through fold dilution method at last. The SIgA antibody secreted from the CHO cells was confirmed by Western blotting, which demonstrated that we had got the complete SIgA molecular. The successful expression of this polymeric anti-H5N1 SIgA in CHO cells will contribute to the production of recombinant SIgA as a preventive agent for infectious disease control.
Keywords:Avian influenza virus H5N1, Western blotting, secretory Immunoglobulin A
禽流感 (Avian influenza,AI) 是由甲型流感病毒引起的一种以侵害呼吸系统为主的疾病,严重危害人类健康和畜牧业的发展,并严重影响国家的经济发展。禽流感病毒 (Avian influenza virus,AIV)基因组极易发生变异,造成病毒的多型性,给禽流感防治带来极大难度。据WHO最新报道,截至2010年3月29日,全世界已确诊490人感染H5N1亚型高致病性禽流感,死亡290人,病死率为59.2%[1]。WHO预测下一次流感大流行不是有和无的问题,而是早和晚的问题。为此,发展人禽流感阻断技术,进行人禽流感的综合防控,成为世界各国的迫切需求。
在预防方面,使用疫苗进行主动免疫预防是一种较为理想的选择,但是目前人用禽流感疫苗上存在一些问题。由于目前尚没有禽流感在人群中流行,因此疫苗保护效果难以准确评价。使用疫苗进行预防还有一个很大的缺点,那就是从疫苗注射到产生保护性抗体需要数周的时间,这往往会影响预防效果,尤其是对一些高危人群,不能提供紧急防护,一旦疫情发生,有可能造成大量生命损失。抗体制剂作为一种被动免疫防护手段,可以弥补疫苗的不足,可以在使用之后立刻产生防护效果,尤其适合于重点人群的紧急保护。
分泌型IgA是20世纪60年代初在外分泌液中发现的一种IgA抗体,主要存在于乳汁、胃肠液、呼吸道分泌液等外分泌液中。SIgA 分子是由 2个IgA 单体 (每个单体含2条轻链和2条重链)、1条J链和1条分泌片 (Secretory component,SC,为多聚免疫球蛋白受体pIgR的胞外裂解片段) 构成的异源十聚体 (图1)[2]。

图1 SIgA多肽链示意图Fig. 1 Diagram of SIgA polypeptide chain.
与普通的抗体分子相比 SIgA具有许多优良特性:SIgA分子中的J链将2个IgA单体连接起来,由于每个IgA单体具有2个抗原结合部位,因此每个 SIgA抗体即有 4个抗原结合位点 (四价),从而比普通抗体分子具有更高的亲和力[3]。SIgA具有很高的稳定性,其在粘膜表面的半衰期为IgG的3倍,其在人体外分泌道中的保护作用可以持续4个月以上[3]。分泌片的存在还赋予SIgA特殊的免疫保护作用:首先,分泌片具有非特异性的病原微生物中和活性[4];其次,分泌片上的糖基粘附于粘膜上皮更使SIgA整齐地排列在粘膜表面,形成隔离保护层,可有效地阻止病毒的入侵[5]。因此,研究呼吸道或消化道分泌型IgA对禽流感病感染的阻断作用,具有潜在的应用价值。
1 材料与方法
1.1 质粒、细胞及主要试剂
DNA 工具酶购自 Promega公司;LipofectiAMINETM2000Regent购自 Gibco BRL公司;Zeocin抗生素购自Invitrogen公司;DMEM购自Hyclone公司;透析胎牛血清购自Bioind公司;本研究使用的抗体均购自 Sigma公司;protein A-agarose购自Invitrogen公司;实验中所用的抗禽流感病毒H5N1 HA的嵌合IgA稳定表达单克隆细胞系已由本实验室构建完成[8];实验所设计的引物由上海生工生物工程技术服务有限公司合成 (表1)。
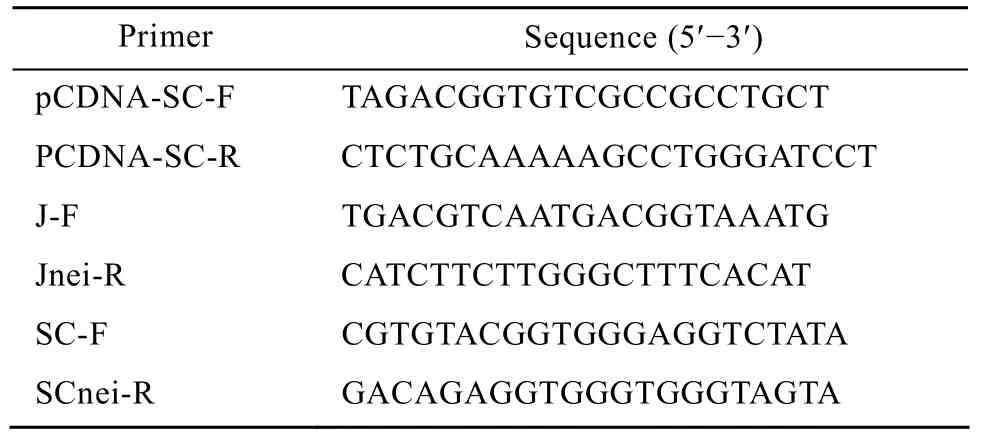
表1 合成引物序列Table 1 Primer Sequence
1.2 人-鼠嵌合SIgA抗体表达质粒的构建
1.2.1 人-鼠嵌合SIgA 抗体分泌片SC表达质粒的构建
本实验室通过 DNA剪接技术克隆得到了免疫球蛋白受体 (pIgR) 基因,但获得的 pGEM-T-pIgR的克隆中有部分突变 (融合引物内)[6],为了获得野生型的基因序列,选择pGEM-T-pIgR 1号和2号2个克隆 (克隆 1目的基因 3′端有突变,克隆 2目的基因5′端有突变),再加上pUC19,通过构建辅助质粒和中间质粒,利用“全长质粒快速定点突变技术”[7]完成重组质粒 pcDNA4-pIgR的构建(图 2)。
图2 pcDNA4-SC构建过程示意图Fig. 2 Construction of SC expression plasmid.
以EcoRⅠ/BamHⅠ双酶切pGEM-T-pIgR-1,回收约1 000 bp DNA 片段,同时以BamHⅠ/KpnⅠ双酶切pGEM-T-pIgR-2,回收约500 bp DNA片段,将上述回收的2条DNA条带插入到以EcoRⅠ/KpnⅠ双酶切的 pUC19载体中,形成辅助质粒 pUC19-pIgR-help;第二步将辅助质粒 pUC19-pIgR-help进行 EcoRⅠ/KpnⅠ双酶切,回收纯化约 1 500 bp的DNA条带,同时以 EcoRⅠ/KpnⅠ双酶切 pGEM-T-pIgR-1,回收纯化约1 000 bp的DNA条带,将上述回收的 2条 DNA条带插入到经 EcoRⅠ消化的pUC19载体中,形成中间质粒 pUC19-pIgR-final;最后将中间质粒 pUC19-pIgR-final使用 EcoRⅠ消化,回收完整pIgR 基因的2 500 bp DNA条带,与以EcoRⅠ酶切的哺乳动物表达载体pcDNA4/His A连接,完成人 pIgR基因的真核表达质粒 pcDNA4-pIgR的构建。
利用本实验室建立的“全长质粒快速定点突变技术”[7],将pcDNA4-pIgR质粒pIgR基因胞内区基因部分突变,从而完成 pIgR胞外区基因载体的构建。具体方法:设计2条突变引物pCDNA-SC-F和PCDNA-SC-R (表1);用Phusion超保真DNA聚合酶做标准的PCR反应,50 μL体系含有10 μL 5×GC Buffer(含 MgCl2),4 μL dNTPs (各 2.5 mmol/L),引物pCDNA-SC-F 和 pCDNA-SC-R (10 μmol/L 各 1 μL,0.2 μL pcDNA4-pIgR(10 ng) 作为PCR反应的模板,0.5 μL (2 U/μL) Phusion 超保真 DNA 聚合酶,用去离子水补至50 μL。将配好的PCR反应体系放入GeneAmp PCR system 2400 (Perkin Elmer,FosterCity,CA) 中进行扩增,反应条件为:98 ℃预变性30 s;变性98 ℃变性10 s,65 ℃退火20 s,72 ℃延伸150 s,35个循环;最后72 ℃延伸5 min。将上述PCR产物纯化并进行磷酸化,然后放入 37 ℃的水浴锅中30 min;最后70 ℃加热5 min将T4 多聚核苷酸激酶灭活;磷酸化的PCR产物进行自连,转化感受态细胞,摇菌提取质粒进行酶切鉴定及测序鉴定,突变后的质粒命名为pcDNA4-SC。
1.2.2 人-鼠嵌合SIgA抗体IgJ表达质粒的构建
与SC基因的扩增方法相同,我们也是利用DNA剪接技术克隆得到了 IgJ基因,并将其克隆到了PGEM-T-Easy克隆载体上[6]。以Hind /ⅢEcoRⅠ双酶切PGEM-T-Easy-IgJ,回收约700 bp IgJ基因片段,插入以Hind /ⅢEcoRⅠ双酶切的哺乳动物表达载体pcDNA4/His A中,得到人IgJ基因的哺乳细胞表达质粒 pcDNA4-IgJ (图 3)。

图3 重组质粒pcDNA3.1-IgJ构建示意图Fig. 3 Construction of IgJ expression plasmid.
1.3 嵌合IgA CHO单克隆细胞系的再转染及阳性克隆的筛选
本实验室已成功构建了稳定表达IgA的CHO单克隆细胞系[8],在此基础上我们再共转染SC和IgJ表达质粒。取pcDNA4-SC、pcDNA4-IgJ各2 μg加到100 μL无血清和无抗生素培养液DMEM中,取LipofectiAMINETM20004 μL 加到 100 μL 无血清和抗生素的培养液,室温孵育5 min,将二者混合,室温放置20 min。静置期间,每次用无血清和抗生素的DMEM培养液1 mL洗涤细胞 2次,最后加0.2 mL的无血清和双抗的DMEM培养液到六孔板细胞中。将 LipofectiAMINETM2000和 DNA的混合物滴加到培养板。于5% CO2、37 ℃孵箱培养6 h,吸弃上清,加入含10%透析胎牛血清的培养液培养48 h,然后用含500 μg/mL zeocin抗生素的培养液进行克隆化培养,通过96孔板倍比稀释的方法筛选单克隆细胞系。
1.4 嵌合分泌型IgA单克隆细胞系的PCR鉴定
将筛选得到的单克隆细胞系提取全基因组DNA,进行PCR反应,鉴定SC基因和IgJ基因是否已与CHO−细胞基因组发生重组。用J-F、Jnei-R和SC-F、SCnei-R分别扩增IgJ基因和SC基因,具体体系如下:5×FastPfu Buffer 5 μL;dNTPs (2.5 mmol/L)2.5 μL,J-F、Jnei-R (10 μmol/L) (或 SC-F、SCnei-R);FastPfu (2.5 U/μL) 0.5 μL;用水补至 25 μL。按以下条件进行PCR反应:95 ℃预变性2 min,95 ℃变性 20 s,51 ℃ (SC 57 ℃) 退火 20 s,72 ℃延伸30 s,35个循环;最后72 ℃再延伸5 min,将扩增的PCR产物经1%琼脂糖凝胶电泳分离鉴定。
1.5 嵌合分泌型IgA单克隆细胞系的无血清培养
将 SIgA单克隆细胞在含有 10%胎牛血清的DMEM 培养液中培养,等其生长至 G1期更换为DMEM无血清培养,72 h后收集无血清上清,然后进行免疫沉淀和Western blotting分析。
1.6 免疫沉淀实验
每毫升SIgA样品加入50 μL兔抗人的IgA (α)4 ℃孵育过夜,然后加入 50 μL protein A-agarose 4 ℃孵育4 h,5 000 r/min离心10 min后小心弃上清,加入60 μL SDS-PAGE上样缓冲液,沸水浴5 min,最后进行Western blotting分析。
1.7 嵌合分泌型IgA抗体的Western blotting分析
1.7.1 还原SDS-PAGE分析
免疫沉淀的蛋白样品进行还原SDS-PAGE电泳后转移到PVDF上,分别对SIgA的4个多肽链进行检测,一抗分别为鼠抗人 Kappa 链 (1∶1 500)、α链 (1∶2 000)、SC (1∶2 000) 和 IgJ (1∶2 000) 的单克隆抗体,二抗为辣根过氧化物酶 (HRP) 标记的羊抗鼠IgG (1∶3 000),以ECL显色。
1.7.2 非还原SDS-PAGE分析
免疫沉淀的蛋白样品进行非还原 SDS-PAGE电泳后转移到 PVDF上,然后利用鼠抗人的 SC(1∶3 000) 单克隆抗体进行Western blotting检测,二抗为辣根过氧化物酶 (HRP) 标记的羊抗鼠IgG (1∶3 500),以ECL显色。Western blotting印迹操作详见参考文献[9]。
2 结果与分析
2.1 人-鼠嵌合SIgA抗体分泌片SC表达质粒的构建
通过“全长质粒快速定点突变技术”,该方法是利用PCR一步定点突变,以pcDNA4-pIgR为模板,使用高保真的DNA聚合酶扩增全长质粒,并将目的基因pIgR胞内区部分突变,PCR产物磷酸化、自连、转化最终筛选阳性克隆pcDNA4-SC。用PVUⅡ消化pcDNA4-SC,产生3 378 bp、1 748 bp、1 275 bp和699 bp四条DNA条带 (图4),测序表明成功获得目标序列。
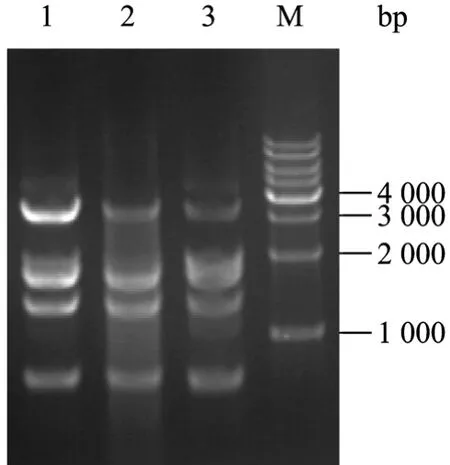
图4 SC表达质粒的酶切鉴定Fig. 4 Restriction of SC expression plasmid. 1, 2, 3: SC expression plasmid; M: DNA molecular weight marker 1 kb ladders.
2.2 人-鼠嵌合SIgA抗体IgJ表达质粒的构建
通过Hind Ⅲ和EcoRⅠ双酶切PGEM-T-Easy-IgJ,回收IgJ基因片段,插入以Hind Ⅲ和EcoRⅠ双酶切的哺乳动物表达载体pcDNA4/His A中,构建了质粒pcDNA4-IgJ。该重组质粒经 NcoⅠ酶切鉴定,产生3 443 bp、2 042 bp和220 bp三条DNA条带 (图5);进一步对该克隆的测序鉴定,说明成功插入目的基因。
2.3 嵌合分泌型IgA单克隆细胞系的PCR鉴定
将筛选得到的 SIgA单克隆细胞系提取全基因组DNA,利用载体和IgJ基因、SC基因内部特异引物进行PCR反应,扩增分别得到445 bp和566 bp的目的片段 (图6、图7),证明IgJ基因、SC基因已整合到CHO细胞基因组中。
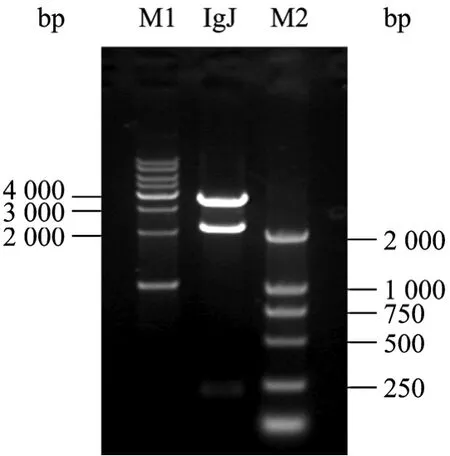
图5 IgJ表达质粒的酶切鉴定Fig. 5 Indentification of recombinant IgJ expression plasmid.IgJ: IgJ expression plasmid. M1: DNA molecular weight marker 1 kb ladders; M2: DNA molecular weight marker DL2000Plus.

图6 SC基因的PCR鉴定Fig. 6 PCR analysis of SC gene. 1,2: PCR product of SC gene.M: DNA molecular weight marker DL2000Plus.

图7 IgJ基因的PCR鉴定Fig. 7 PCR analysis of IgJ gene. 1,2: PCR product of IgJ gene.M: DNA molecular weight marker DL2000Plus.
2.4 嵌合分泌型IgA抗体的Western blotting分析
2.4.1 还原SDS-PAGE分析
免疫沉淀得到的 SIgA蛋白样品进行还原SDS-PAGE电泳后,转移到 PVDF膜上做 Western blotting分析,结果显示SIgA中包括重链 (55 kDa)、轻链 (25 kDa)、SC (66 kDa) 和 IgJ (17 kDa) 四种多肽链大小与阳性对照 (唾液,saliva) 一致 (图8)。

图8 重组SIgA抗体Western blotting鉴定Fig. 8 Western blotting analysis of recombinant SIgA. (A) Heavy chain. 1: positive control (saliva); 2: SIgA immunoprecipitation.(B) Kappa light chain. 1: SIgA immunoprecipitation; 2: positive control. (C) SC. 1: SIgA immunoprecipitation; 2: positive control (saliva IP). (D) IgJ. 1: SIgA immunoprecipitation; 2:positive control.
2.4.2 非还原SDS-PAGE分析
免疫沉淀得到的 SIgA蛋白样品进行非还原SDS-PAGE 电泳后,转移到 PVDF膜上做 Western blotting分析,一抗为鼠抗人SC (1∶3 000) 的单克隆抗体,二抗为辣根过氧化物酶 (HRP) 标记的羊抗鼠IgG (1∶3 000),经ECL发光显示出3条大小约为 66 kDa (SC)、160 kDa、400 kDa (SIgA 全分子) 的条带,与阳性对照 (唾液,saliva) 一致 (图 9),证明我们成功表达出了具有十聚体形式的 SIgA抗体分子。

图9 重组SIgA抗体非还原Western blotting鉴定Fig. 9 Western blotting analysis of recombinant SIgA under nonreducing conditions. 1: SIgA immunoprecipitation; 2:positive (saliva).
3 讨论
由于禽流感是一种呼吸道传染病,其感染途径主要是呼吸道或消化道,通过粘膜侵入,因此在病毒感染发生的最早阶段采取措施,极可能最有效地抵抗病毒的感染,用最少的药物达到最大的效果。SIgA 是外分泌液中存在的一种主要抗体,是呼吸道、消化道、泌尿生殖道和乳汁中抵御病原体及有害物质的第一道免疫防线,是机体粘膜免疫最重要的抗体,具有很强的抗感染能力[10]。分泌型IgA通过滴鼻/喷雾或口服/灌胃即可给药,无需注射,这样的用药方式更加安全和方便。而且因为是局部使用,使用剂量较小,成本较低。
抗体的高效表达技术是抗体工程研究的一个关键技术,提高单个细胞单位时间抗体表达量和提高发酵体积和细胞密度是提高抗体表达量的 2个关键的步骤和因素,同时也是 2个相互关联和相互影响的环节,优化系统提高抗体产量是一个极其复杂的系统工程,不仅要考虑基因的选择、载体的构建、基因整合的位置、表达调控序列的功能,而且要考虑细胞的生长速度、抗凋亡能力、生存活力、代谢特性、营养状况等复杂因素。通过借鉴国外先进的抗体高效表达经验,我们将采用强启动子、绝缘子、优化密码子、抗凋亡、促进蛋白质折叠、改善细胞代谢状况等措施提高抗体表达量,这将是我们下一步的主要工作内容。
本研究构建了稳定表达和分泌SIgA的CHO细胞系,并通过PCR和Western blotting分析,检测到本实验室构建的SIgA稳定CHO细胞系表达的SIgA由重链、轻链、分泌片和 J链构成,能稳定分泌嵌合 SIgA,而且表达的重链、轻链、J链、分泌片与天然SIgA大小一致,为进一步建立高效表达SIgA抗体的细胞系和开发出针对H5N1 高致病性禽流感的预防性SIgA 抗体制剂奠定了基础。
REFERENCES
[1] WHO. Cumulative Number of Confirmed Human Cases of Avian Influenza A/(H5N1) Reported to WHO. http://www.who.int/csr/disease/avian_influenza/country/cases_table_2 010_03_29/en/index.html, 2010.
[2] Corthésy B. Recombinant immunoglobulin A: powerful tools for fundamental and applied research. Trends Biotechnol, 2002, 20(2): 65−71.
[3] Ma JK, Hikmat BY, Wycoff K, et al. Characterization of a recombinant plant monoclonal secretory antibody and preventive immunotherapy in humans. Nat Med, 1998,4(5): 601−606.
[4] Dallas SD, Rolfe RD. Binding of Clostridium difficile toxin A to human milk secretory component. J Med Microbiol, 1998, 47(10): 879−888.
[5] Phalipon A, Cardona A, Kraehenbuhl JP, et al. Secretory component: a new role in secretory IgA-mediated immune exclusion in vivo. Immunity, 2002, 17(1): 107−115.
[6] Zhang BZ, An XP, Zhang X, et al. Clonging of genes by genomic DNA splicing for secretory IgA production.China Biotechnol, 2008, 28(6): 1−6.
张宝中, 安小平, 张昕, 等. 用基因组DNA剪接技术克隆SIgA相关基因. 中国生物工程杂志, 2008, 28(6): 1−6.
[7] Zhang BZ, Ran DL, Zhang X, et al. Rapid site-directed mutagenesis on full-length plasmid DNA by using designed restriction enzyme assisted mutagenesis. Chin J Biotech, 2009, 25(2): 306−312.
张宝中, 冉多良, 张昕, 等. 用 DREAM 技术进行全长质粒快速定点突变. 生物工程学报, 2009, 25(2):306−312.
[8] Zhang BZ, Zhang X, Chen WR, et al. Construction of anti-H5N1 virus chimeric IgA antibody gene and its expression in CHO cells. Chin J Biotech, 2009, 25(5):714−719.
张宝中, 张昕, 陈万荣, 等. 抗H5N1病毒嵌合IgA抗体基因的构建及其在CHO细胞中的表达. 生物工程学报,2009, 25(5): 714−719.
[9] Sambrook J, Fritsch EF, Maniatis T. Molecular Cloning: A Laboratory Manual. 2nd ed. New York: Cold Spring Harbor Laboratory Press, 1989: 880−897.
[10] Hammarström L, Weiner CK. Targeted antibodies in dairy-based products. Adv Exp Med Biol, 2008, 606:321−343.
Expression of anti-avian influenza virus H5N1 secretory IgA in Chinese hamster ovary cells
Cun Li, Baozhong Zhang, Xiaoping An, Zhiqiang Mi, Dabin Liu, Huanhuan Jiang, Bo Pan,Sheng Wang, Bin Chen, Fen Huang, Juan Wang, Xiaona Wang, and Yigang Tong
State Key Laboratory of Pathogen and Biosecurity, Beijing Institute of Microbiology and Epidemiology, Beijing 100071, China
Received: June 3, 2010; Accepted: October 15, 2010
Supported by: Program of Shanghai Subject Chief Scientist (A type) (No. 10XD1403500), Scientific Research Priming Foundation of Shanghai Public Health Clinical Center (No. KSF0268).
Corresponding author: Xiaoyan Zhang. Tel: +86-20-37990333-7310; Fax: +86-20-57247094; E-mail: zhang_xycn2002@yahoo.com.cn
上海市优秀学科带头人计划 (A类) (No. 10XD1403500),上海市公共卫生临床中心科研启动基金 (No. KSF0268) 资助。
