中国仓鼠卵巢工程细胞无血清流加培养关键工艺参数的考察
2011-09-29刘兴茂刘红叶玲玲李世崇吴本传王启伟陈昭烈
刘兴茂,刘红,叶玲玲,李世崇,吴本传,王启伟,陈昭烈
军事医学科学院生物工程研究所,北京 100071
中国仓鼠卵巢工程细胞无血清流加培养关键工艺参数的考察
刘兴茂*,刘红*,叶玲玲,李世崇,吴本传,王启伟,陈昭烈
军事医学科学院生物工程研究所,北京 100071
主要考察流加培养基中不同营养成分、流加起始时间及初始接种密度对 11G-S细胞无血清流加培养的影响。在研究中以悬浮适应的表达尿激酶原 (Pro-urokinase,Pro-UK) CHO工程细胞系11G-S为研究对象,在100 mL的摇瓶中无血清悬浮流加培养11G-S细胞,同时以活细胞密度、细胞活力及Pro-UK活性为评价依据。结果表明在培养基中氨基酸、无血清添加成分及无机盐对促进细胞生长、细胞活力维持及蛋白表达起着较为重要的作用;且流加起始时间为72 h及初始接种密度为3×105~4×105cells/mL的流加培养效果较好。在为期12 d的流加培养过程中,11G-S细胞的最大活细胞密度达到7.8×106cells/mL,Pro-UK的最大累积活性为8 570 IU/mL。在此基础上,分别考察了无血清悬浮流加培养及分批培养11G-S细胞的生长及代谢特征,流加培养中期11G-S细胞的比生长速率 (μ) 高于同期批次培养的11G-S细胞;流加培养中后期11G-S细胞的葡萄糖比消耗速率 (qglu) 和谷氨酰胺比消耗速率 (qgln) 均高于同期批次培养的11G-S细胞。
CHO工程细胞,无血清培养,流加培养,工艺参数,代谢特征
Abstract:Taking a suspension adapted recombinant CHO cell line, 11G-S expressing human Pro-urokinase (Pro-UK) as the object of study, the impacts of different feeding nutrients, the start time of feeding and cell inoculation density on the growth and Pro-UK production of 11G-S cells in serum-free fed-batch culture were evaluated in 100 mL shacking flasks. The results indicated that amino acids, serum-free supplements and inorganic salts played important role in cell growth, cell viability and protein expression. And the effects of cells fed-batch culture was much better with the initial cell inoculation density at3×105~4×105cells/mL and the start time of feeding set at 72 h, a maximum viable cells density of 7.8×106cells/mL with a peak Pro-UK activity at 8 570 IU/mL was achieved during 12 d fed-batch culture. Further, the μ of the 11G-S cells at the middle phase of the fed-batch culture, and both the qgluand qglnof the 11G-S cells at the middle and later phases of the fed-batch culture was higher than that of the 11G-S cells at the same phase of the batch culture, respectively.
Keywords:recombinant CHO cells, serum free culture, fed-batch culture, process parameter, metabolism character
动物细胞大规模培养过程中营养物的耗竭和大量代谢副产物的积累往往是限制细胞生长密度、影响培养过程的主要因素[1-2]。特别是在批次培养过程中,不断消耗的营养成分往往成为影响细胞密度、细胞活力和细胞表达产物生产的限制性因素。流加培养根据细胞对营养物质的不断消耗和需求,在培养过程中流加浓缩的营养液,可有效地减缓乃至消除营养限制因素,从而延长细胞培养时间,提高细胞培养密度及细胞表达产物浓度[3]。流加培养由于其操作的简易性、可放大性、灵活性已被广泛用于众多动物细胞表达产品的生产,成为动物细胞培养的主流工艺[4-5]。
动物细胞流加培养的效果受众多因素的影响。其中,流加液的营养成分、流加初始时间及细胞接种密度等因素是流加培养工艺的重要参数[6]。据此,本研究以悬浮适应的表达尿激酶原 (Pro-urokinase,Pro-UK) CHO工程细胞系11G-S为研究对象,考察无血清培养条件下细胞接种密度、流加起始时间和流加培养基中的不同营养成分对11G-S细胞无血清流加培养的影响,并对11G-S细胞在无血清流加培养和批次培养的生长及代谢特征进行比较,以期为CHO工程细胞无血清流加培养工艺的建立和应用提供参考。
1 材料与方法
1.1 材料
1.1.1 细胞系
适应悬浮培养的表达Pro-UK CHO工程细胞系11G-S (由军事医学科学院生物工程研究所构建、保藏)。
1.1.2 培养基
有血清培养基为含1% (V/V) 小牛血清、0.1%(W/V) Pluronic F-68和 25 μg/mL硫酸葡聚糖的DMEM/F12 (V/V,1:1)。无血清培养基为添加了胰岛素、腐胺、转铁蛋白、微量元素、Pluronic F-68及硫酸葡聚糖等成分的 DMEM/F12 (V/V,1:1)。流加培养基为由葡萄糖、谷氨酰胺、氨基酸、微量元素、维生素、无血清添加成分、无机盐及次黄嘌呤等组成的混合液。
1.2 方法
1.2.1 流加液营养成分对11G-S细胞流加培养效果影响的考察
将谷氨酰胺、氨基酸、微量元素、维生素、次黄嘌呤、无血清培养基添加成分及无机盐等组分按表1的组合配制8种不同的浓缩流加液。依据不同的浓缩流加液设置 8个实验组,并以批次培养作对照。11G-S细胞以3×105~3.5×105cells/mL的初始接种密度分别接入9个100 mL三角瓶中,培养初始体积为 35 mL,将三角瓶置于 37 ℃温箱中摇床上培养,摇床转速为90 r/min。培养至72 h开始实施每24 h补给3 mL浓缩流加液的间歇流加。流加培养时培养体系中谷氨酰胺及葡萄糖瞬时浓度水平分别控制在2~3 mmol/L及3~5 mmol/L。每24 h取样,用于检测活细胞密度、细胞活力及Pro-UK活性。
1.2.2 流加起始时间对11G-S细胞流加培养效果影响的考察
将11G-S细胞以3.5×105cells/mL的初始接种密度分别接入3个装有无血清基础培养液的100 mL三角瓶中,培养初始体积为35 mL,将三角瓶置于37 ℃温箱中摇床上培养,摇床转速为90 r/min。分别于培养至48 h、72 h、96 h开始按每24 h流加3 mL由谷氨酰胺、氨基酸、微量元素、维生素、次黄嘌呤、无血清培养基添加成分及无机盐等组成的浓缩流加液。每24 h取样,用于检测活细胞密度、细胞活力和Pro-UK活性。

表1 不同流加液营养成分对11G-S细胞流加培养效果的影响Table 1 Effects of different feeding nutrients on the growth and Pro-UK production of 11G-S cells in fed-batch cultures
1.2.3 细胞接种密度对11G-S细胞流加培养效果影响的考察
将 11G-S 细胞以 2×105、3×105、4×105、5×105cells/mL的初始密度分别接入4个装有无血清基础培养液的 100 mL三角瓶中,培养初始体积为35 mL,将三角瓶置于37 ℃温箱中摇床上培养,摇床转速为90 r/min。培养至72 h开始按每24 h流加3 mL由谷氨酰胺、氨基酸、微量元素、维生素、次黄嘌呤、无血清培养基添加成分及无机盐等组成的浓缩流加液。每24 h取样,用于检测活细胞密度、细胞活力和Pro-UK活性。
1.2.4 11G-S细胞流加培养生长和代谢特征的考察
将11G-S细胞以3.5×105cells/mL的初始接种密度接入装有无血清基础培养液250 mL摇瓶中,培养初始体积为80 mL,将三角瓶置于37 ℃温箱中摇床上培养,摇床转速为90 r/min。培养至72 h开始按每24 h流加15 mL由谷氨酰胺、氨基酸、微量元素、维生素、次黄嘌呤、无血清培养基添加成分及无机盐等组成的浓缩流加液,直至培养体积达到150 mL。同时,按相同接种密度和培养条件设置11G-S细胞无血清批次培养作为对照。每24 h取样,用于检测活细胞密度、细胞活力、葡萄糖、乳酸、谷氨酰胺和Pro-UK活性。
1.2.5 活细胞密度、细胞活力、葡萄糖、乳酸、谷氨酰胺和Pro-UK活性的测定
采用 Cedex AS20 细胞密度和活力自动分析系统 (Innovatis,Germany) 进行活细胞计数和活力分析。采用 YSI 7100 多参数生物分析系统 (Yellow Springs Instruments,USA) 定量检测细胞培养上清的葡萄糖、乳酸和谷氨酰胺的浓度。采用体外纤维蛋白琼脂板溶圈法检测 Pro-UK的体外纤维蛋白溶解活性[7]。
1.2.6 统计学处理
数据结果采用SPSS 13.0软件进行统计分析,组间差别采用双尾 t检验和方差分析(P<0.05 为有较显著性差异)。
2 结果与分析
2.1 不同流加营养成分对11G-S细胞流加培养的影响
为了确定流加液的营养组成,以活细胞密度、细胞活力及Pro-UK活性为评价依据,考察不同流加营养成分对11G-S细胞流加培养效果的影响 (表2)。从表2中的数据可以看出,FB1组的最大活细胞密度、最大Pro-UK活性及培养结束时的活细胞密度、细胞活力等指标均基本与FB0相同,FB0与FB1组间没有显著差异 (P>0.05),表明仅流加谷氨酰胺对11G-S细胞的生长和Pro-UK表达均无明显的促进作用。FB2、FB3、FB4、FB5及FB6各组之间的评价指标基本相同,且其中的最大活细胞密度及最大Pro-UK活性均明显高于FB1组,FB1与FB2~6组间有显著性差异 (P<0.05),但 FB2~6各组间无显著性差异 (P>0.05);表明流加液中的氨基酸成分具有明显的促进11G-S细胞生长和Pro-UK表达作用;流加液中的维生素、微量元素及次黄嘌呤等成分对11G-S细胞的生长及活力维持没有明显的作用。FB7组中的最大活细胞密度与FB2~6组实验没有明显差异 (P>0.05),但培养结束时的活细胞密度及细胞活力均较前几组有所提高,提示流加培养液中的无血清添加成分对维持 11G-S细胞的活力有一定的作用。FB8组中各项评价指标均高于其他实验组,且与 FB2~6组相比具有显著性差异 (P<0.05),但与FB7组相比无显著性差异 (P>0.05)。表明流加培养液中的无机盐具有促进11G-S细胞生长和保持细胞活力的作用。
2.2 流加起始时间对11G-S细胞流加培养的影响
流加起始时间是影响流加培养效果的重要因素之一,为了确立11G-S细胞流加培养工艺的最佳流加起始时间,以活细胞密度、细胞活力及Pro-UK活性作评价指标,考察流加起始时间对流加培养效果的影响。在以72 h为流加起始时间实验组的各项评价指标中,除细胞活力外,其他指标均优于流加起始时间为48 h和96 h的实验组 (表3)。总体而言各实验组间无明显差异 (P>0.05)。
2.3 细胞接种密度对11G-S细胞流加培养的影响
表4为考察不同接种密度对11G-S细胞流加培养效果影响的各项评价指标值。细胞接种密度为2×105cells/mL、3×105cells/mL 和 4×105cells/mL 实验组中的各项评价指标基本相同,且均优于细胞接种密度为5×105cells/mL实验组,但各实验组间无明显差异 (P>0.05)。结果表明在11G-S细胞无血清流加培养工艺中选取较低的细胞接种密度,既可提高11G-S细胞的倍增数量,也便于流加培养工艺的规模放大。
2.4 11G-S细胞流加培养的生长和代谢特征
图1所示为11G-S细胞无血清流加培养及批次培养过程中的细胞生长和Pro-UK表达。根据11G-S细胞的活细胞密度和细胞活力变化,可将为期12 d的培养过程大致分为前期、中期、后期3个阶段,即0~4 d的快速生长期、4~8 d的生长迟滞期、8~12 d的细胞衰退期,11G-S细胞无血清流加培养及批次培养的细胞生长呈现基本相同的变化趋势。11G-S细胞的μ值自流加培养第3 天的0.75 d−1下降至第5天的0.36 d−1,批次培养同期的 11G-S细胞μ值从0.70 d−1下降至−0.07 d−1,表明流加培养减缓了11G-S细胞由快速生长期进入生产迟滞期μ的下降程度。细胞培养中期μ值下降幅度不同的直接体现在最大活细胞密度的出现时间和数值的不同。11G-S细胞无血清流加培养的最大活细胞密度出现在第 6天,达到7.8×106cells/mL;批次培养的最大活细胞密度出现在第4 天,达到4.2×106cells/mL (图1A)。Pro-UK活性峰值分别在流加培养的第6 天达到8 570 IU/mL和批次培养的第4 天达到5 672 IU/mL(图1B)。图2反映了11G-S细胞无血清流加培养及批次培养代谢特征的葡萄糖比消耗率 (qglu)、乳酸比生产率(qlac) 及谷氨酰胺比消耗率 (qgln) 总体上呈现出由高到低的相同变化趋势。流加培养中后期11G-S细胞的葡萄糖比消耗速率 (qglu) 和谷氨酰胺比消耗速率 (qgln) 分别维持在(0.6±0.27) μmol/(106cells·d)和(0.4±0.23) μmol/(106cells·d),同期批次培养 11G-S 细胞的 qglu和 qgln分别维持在(0.1±0.04) μmol/(106cells·d)和(0.02±0.01) μmol/(106cells·d)。11G-S 细胞在两种培养模式的 qlac均由培养早期的(2.5±0.6) μmol/(106cells·d)下降到中后期的(−0.24±0.11) μmol/(106cells·d)。流加培养中后期培养基中葡萄糖和谷氨酰胺浓度高于同期批次培养的葡萄糖和谷氨酰胺浓度,可能是11G-S细胞流加培养中后期qglu和qgln高于同期批次培养的成因。
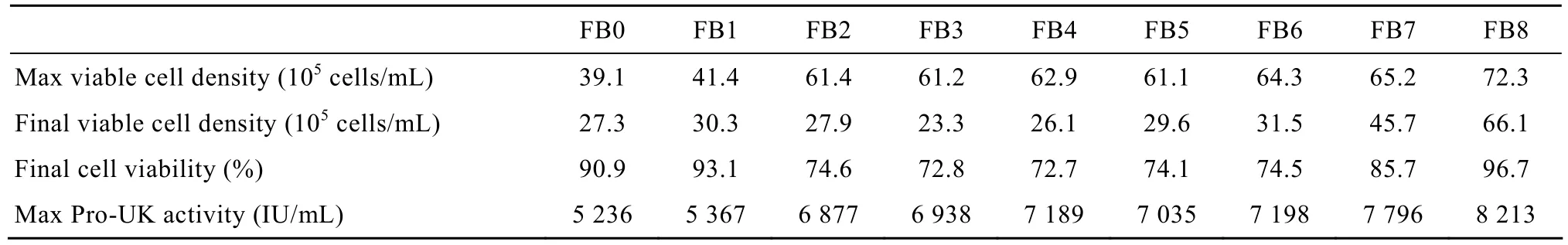
表2 不同流加营养成分对11G-S细胞流加培养效果的影响Table 2 Effects of different feeding nutrients on the growth and Pro-UK production of 11G-S cells in fed-batch cultures

表3 流加起始时间对11G-S细胞流加培养效果的影响Table 3 Effects of the starting time of feeding on the growth and Pro-UK production of 11G-S cells in fed-batch cultures
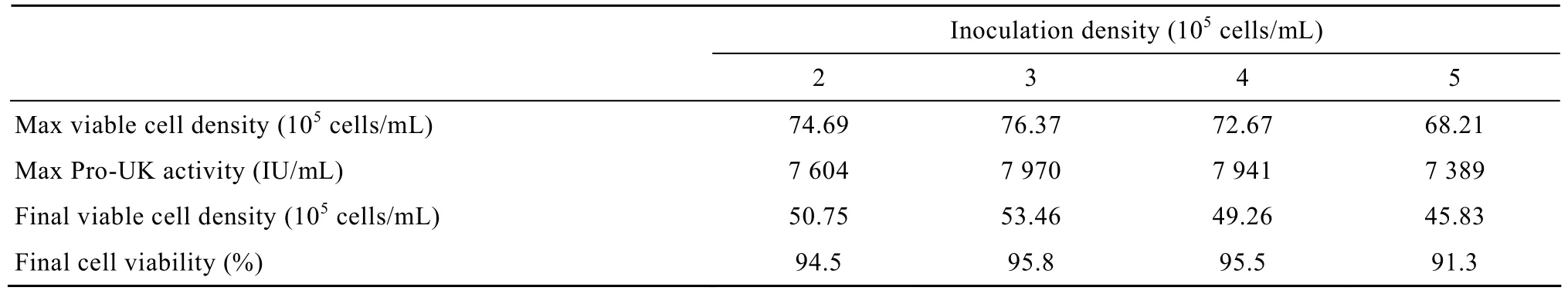
表4 细胞接种密度对11G-S细胞流加培养结果的影响Table 4 Effects of inoculation density on the growth and Pro-UK production of 11G-S cells in fed-batch cultures
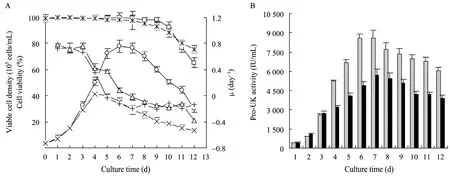
图1 11G-S细胞在无血清流加培养和批次培养中的细胞生长 (A) 和Pro-UK生产 (B)Fig. 1 The growth (A) and Pro-UK production (B) of 11G-S cells in serum-free fed-batch and batch culture. ×: viable cell density in batch culture; *: cell viability in batch culture; +: μ in batch culture. (B) ■: Pro-UK activity in batch culture; (A) O: viable cell density in fed-batch culture; □: cell viability in fed-batch culture; △: μ in fed-batch culture; ■: Pro-UK activity in fed-batch culture. Data represent the means of three experiments.
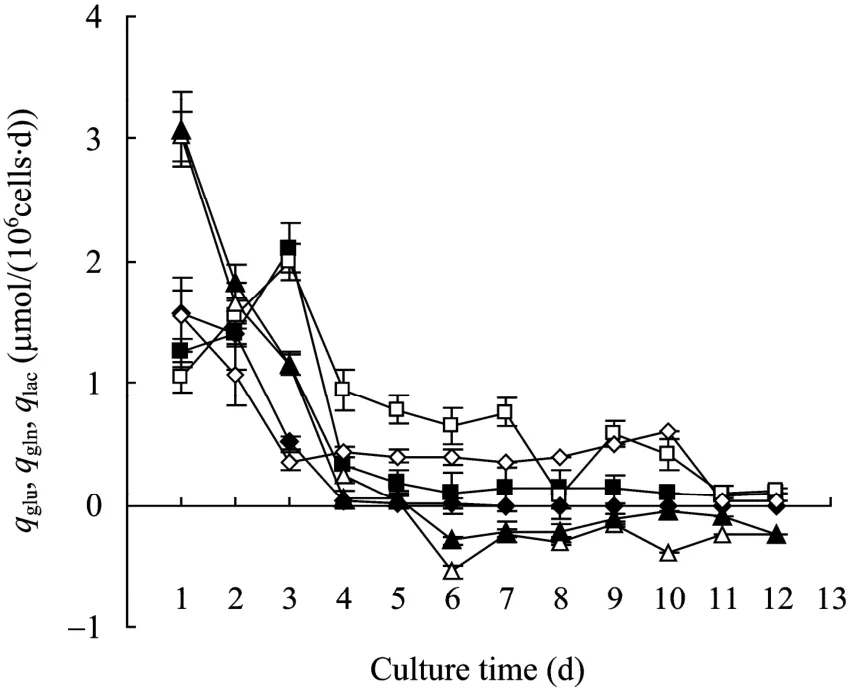
图2 11G-S细胞在无血清流加培养和批次培养中的葡萄糖、乳酸和谷氨酰胺代谢Fig. 2 The metabolism of glucose, lactate and glutamine of 11G-S cells in serum-free fed-batch and batch culture. ■: qgluin batch culture; □: qgluin fed-batch culture; ▲: qlacin batch culture; △: qlacin fed-batch culture; ◆: qglnin batch culture;◇: qgluin fed-batch culture. Data represent the means of three experiments.
3 讨论
多样、均衡的营养供是维持体外培养细胞生长代谢的基本前提[8]。流加培养根据细胞的营养需求,针对性地流加浓缩的营养液,使细胞在培养过程中处于能够满足或基本满足其生长代谢需要的营养供给环境[3]。根据其消耗量和检测的难易程度,流加液中的营养成分可大致地分为以下 2类:一类是消耗量较大且易于检测的营养组分,如葡萄糖和氨基酸等;另一类是其消耗较少且不易检测的营养组分,如维生素、微量元素及一些无血清添加成分等[9]。
流加液中消耗量较大且易于检测的营养成分,主要是细胞生长代谢的能源和前体。其中,氨基酸对促进细胞生长和蛋白表达发挥着重要的作用,但单一的流加谷氨酰胺往往不能满足细胞生长代谢的营养需求[10-11]。研究表明细胞吸收的所有营养成分均是通过细胞膜运输的,并且营养成分传输速率是受培养介质中营养成分浓度的影响。有些缓慢消耗的养分可能需要高浓度环境下才能有效地跨越细胞膜,因此在流加培养过程中维持氨基酸的绝对浓度是影响流加培养效果的一个至关重要的因素。本研究结果表明,在CHO工程细胞的无血清流加培养过程中,氨基酸的添加可有效地促进细胞生长和蛋白表达。
流加液中消耗较少且不易检测的营养成分一般并不作为细胞生长代谢的能源和前体,但参与调节细胞的代谢。在细胞培养过程中这类营养成分生物活性的逐渐降低或因其自细胞外向在细胞内的富集,均可造成其含量和活性不足,进而对细胞生长和代谢带来不利影响[12]。本研究结果证实,在CHO工程细胞的无血清流加培养过程中,添加无血清添加成分对细胞的生长没有明显促进作用,但可以有效地延长细胞培养时间,使细胞在培养后期维持着较高的活率。同时,适量流加无血清添加成分和无机盐不仅有助于细胞培养密度的提高,也有利于细胞活力的维持。
细胞接种密度和流加起始时间是影响流加培养效果的互为关联因素,流加起始时间在很大程度上受细胞接种密度的影响,过早或过晚启动流加都会影响细胞流加培养的效果[3-13]。一般而言,细胞接种密度高,流加起始时间提前;反之,流加起始时间延后。本研究的结果提示,较高的细胞接种密度(5×105cells/mL) 并不能提高 CHO 工程细胞无血清流加培养的效果;较低的细胞接种密度(2×105~3×105cells/mL) 既可提高 CHO 工程细胞无血清流加培养的倍增数量,也便于流加培养工艺的规模放大。
比较11G-S细胞无血清流加培养和批次培养的细胞生长动态,11G-S细胞无血清流加培养及批次培养的细胞生长呈现基本相同的变化趋势。流加培养中期μ值下降的减缓使 11G-S细胞的最大活细胞密度、培养时间及Pro-UK活性均较批次培养有较大程度的提高。对比反映11G-S细胞无血清流加培养及批次培养代谢特征的 qglu、qlac及 qgln参数,流加培养中后期11G-S细胞的qglu及qgln高于同期批次培养的qglu及qgln葡萄糖和谷氨酰胺浓度,但qlac均由培养早期的(2.5±0.6) μmol/(106cells·d)下降到中后期的(−0.24±0.11) μmol/(106cells·d),这也反映了 11G-S细胞在流加培养中后期的代谢效率优于同期批次培养的11G-S细胞。同时,研究结果也表明当11G-S细胞的 qglu降低至一定水平,会显著降低进入糖酵解的葡萄糖比例,有利于减缓甚至消除乳酸的生成和积累对细胞的负面影响。
REFERENCES
[1] Hesse F, Wagner R. Developments and improvements in the manufacturing of human therapeutics with mammalian cell cultures. Trends Biotechnol, 2000, 18(4): 173−180.
[2] Fletcher T. Designing culture media for recombinant protein production: a rational approach. BioProcess International, 2005, 3(1): 30−36.
[3] Wlaschin KF, Hu WS. Fedbatch culture and dynamic nutrient feeding. Adv Biochem Eng Biotechnol, 2006,101: 43−74.
[4] Chu L, Robinson DK. Industrial choices for protein production by large-scale cell culture. Curr Opin Biotechnol, 2001, 12(2): 180−187.
[5] Dingermann T. Recombinant therapeutic proteins:production platforms and challenges. Biotechnol J, 2008,3(1): 90−97.
[6] Whitford WG. Fed-batch mammalian cell culture in bioproduction. BioProcess International, 2006, 4: 30−40.
[7] Jespersen J, Astrup T. A study of the fibrin plate assay of fibrinolytic agents. Optimal conditions, reproducibility and precision. Hamostasis, 1983, 13(5): 301−315.
[8] De Alwis DM, Dutton RL, Scharer J, et al. Statistical methods in media optimization for batch and fed-batch animal cell culture. Bioproc Biosyst Eng, 2007, 30(2):107−113.
[9] Zhou WC, Rehm J, Europa A, et al. Alternation of mammalian cell metabolism by dynamic nutrient feeding.Cytotechnology, 1997, 24(2): 99−108.
[10] Kuwae S, Ohda T, Tamashima H, et al. Development of a fed-batch culture process for enhanced production of recombinant human antithrombin by Chinese hamster ovary cells. J Biosci Bioeng, 2005, 100(5): 502−510.
[11] Chen PF, Harcum SW. Effects of amino acid additions on ammonium stressed CHO cells. J Biotechnol, 2005,117(3): 277−286.
[12] Gambhir A, Korke R, Lee J, et al. Analysis of cellular metabolism of hybridoma cells at distinct physiological states. J Biosci Bioeng, 2003, 95(4): 317−327.
[13] Liu XM, Chen ZL. The current state and trend of in fed-batch mammalian cell culture. China Biotechnol,2008, 28(11): 104−109.
刘兴茂, 陈昭烈. 动物细胞流加培养的技术现状和发展趋势. 中国生物工程杂志, 2008, 28(11):104−109.
Evaluation of the critical process parameters for the cultivation of recombinant Chinese hamster ovary cells in serum-free fed-batch mode
Xingmao Liu*, Hong Liu*, Lingling Ye, Shichong Li, Benchuan Wu, Qiwei Wang, and Zhaolie Chen
Institute of Biotechnology, Academy of Military Medical Sciences, Beijing 100071, China
Received: June 2, 2010; Accepted: September 21, 2010
Supported by: Fundamental Research Funds for the Central Universities (No. BLYX200924), National High Technology Research and Development Program of China (863 Program) (No. 2009AA10Z107).
Corresponding author: Xiaoming Pang. Tel: +86-10-62336269; E-mail: xmpang@163.com
中央高校基本科研业务费专项资金 (No. BLYX200924),国家高技术研究发展计划 (863计划) (No. 2009AA10Z107) 资助。
