光谱法研究高铁肌红蛋白活性中心与咪唑的配位反应
2011-09-29周华伟曹洪玉李进京郑学仿
周华伟 曹洪玉, 唐 乾, 李进京 郑学仿*,,
(1大连大学生物工程学院,大连 116622)(2辽宁省生物有机化学重点实验室,大连 116622)
光谱法研究高铁肌红蛋白活性中心与咪唑的配位反应
周华伟2曹洪玉1,2唐 乾1,2李进京1郑学仿*,1,2
(1大连大学生物工程学院,大连 116622)(2辽宁省生物有机化学重点实验室,大连 116622)
采用紫外-可见(UV-Vis)、常规荧光、同步荧光等光谱法研究了高铁肌红蛋白(metMb)与咪唑的轴向配位反应的光谱性质。结果表明,metMb-咪唑配位体系的形成使得metMb的Soret带和Q带均发生红移;并对7位和14位2个Trp残基微环境极性的影响是不同的;同时还引起metMb活性中心铁卟啉597 nm处荧光增强,并且体系荧光强度与加入咪唑的浓度成线性关系,由此计算了不同温度下反应的配位数、结合常数及热力学参数;metMb与咪唑配体之间的配位反应是按物质的量比1∶1进行的;温度升高不利于配位反应的进行;热力学参数表明,此配位反应是自发进行的,焓变是整个配位反应的主要动力。
高铁肌红蛋白;咪唑;配位反应;热力学参数;荧光光谱
血红素蛋白与生物活性小分子的配位反应广泛存在于生命体中,例如二价血红素铁蛋白可逆的结合氧气从而完成贮存[1]和运输氧气的功能[2],二价和三价血红素铁蛋白均可以与信使分子NO配位[3-4]进而完成重要的生理功能。因此,血红素蛋白与生物活性小分子配位反应的研究备受关注[5-7]。但是研究领域大多集中在利用人工合成的金属卟啉配合物来模拟血红素蛋白的配位反应[8-9],研究方法则集中在stopped-flow等动力学方法[10]。
肌红蛋白(Mb)是由一条多肽链和一个血红素辅基构成,因其结构简单研究较成熟,一直被作为血红素蛋白配体结合动力学和构象改变的模型体系。利用模型蛋白metMb配位中心597 nm处荧光强度变化的方法推算出配位反应的结合常数和热力学参数尚属空白。
本文用UV-Vis、普通荧光、同步荧光等光谱,并结合metMb配位中心597 nm处荧光强度变化研究了metMb与咪唑配位反应的光谱性质,得到了metMb与咪唑配位反应的结合常数和热力学参数,研究结果对从分子水平上认识生物体内血红素蛋白的配位反应提供了有用的信息和数据。
1 实验部分
1.1 试剂与仪器
马心肌红蛋白样品(美国Sigma公司)使用时没有经过进一步的提纯,UV-Vis吸收光谱特征峰表明其几乎全部为metMb。将metMb溶解在Na2HPO4-NaH2PO4缓冲溶液(0.05 mol·L-1,pH=7.40)中,配制成浓度为10 μmol·L-1的溶液(应避光保存并尽快用于实验)。将咪唑配制成浓度为1.0 mol·L-1的储备液。实验用水为去离子水。仪器主要有日本Jasco公司生产的V-560型UV-Vis分光光度计、FP-6500型荧光分光光度计;德国Julabo公司生产的F-12型制冷和加热循环器。
1.2 实验方法
移取 2 mL 浓度为 10 μmol·L-1的 metMb 溶液于1 cm石英比色池中,置于V-560型UV-Vis分光光度计中,用微量进样器每次加入 2 μL 1.0 mol·L-1的咪唑溶液(累积总体积小于50 μL),加入后混合均匀,静置2 min后,测定metMb与咪唑配位反应的UV-Vis吸收光谱的变化。按上述相同操作步骤测定荧光光谱及同步荧光光谱的变化。
2 结果与讨论
2.1 UV-Vis吸收光谱分析
图1A为用1.0 mol·L-1的咪唑滴定浓度为10 μmol·L-1的metMb溶液所形成轴配体系时Soret带的光谱变化曲线。随着咪唑浓度的不断增加,metMb在409 nm处吸光度值不断减小,表明metMb在逐渐消耗;同时,吸收谱带向长波长处不断的移动,并在416 nm处产生1个等吸光点,此时配位体系中metMb和所形成的配合物具有了相同的吸光度值。根据Gouterman的四轨道模型[11],metMb分子Soret带是由 a1u(π)-eg*(π)跃迁产生,归属于卟啉 π-π* 跃迁的第2电子激发态。当咪唑与metMb分子进行配位反应时,由于这些亲核性较强的咪唑分子的引入,咪唑分子电荷通过Fe3+转移到卟啉环上,使得卟啉环上电子密度增大,a1u(π)轨道能量增加,与eg*(π)间的能量差减小,激发能降低,从而造成 Soret带的红移[8]。

图1 咪唑对metMb溶液UV-Vis吸收光谱的影响Fig.1 Effects of imidazole on UV-Vis absorbance spectra of metMb
图1B为metMb-咪唑配位体系形成时Q谱带的光谱变化曲线。随着咪唑浓度的不断增加,Q带中503 nm处的峰和543 nm附近的肩峰同时红移28 nm至531 nm和571 nm附近,并在517 nm和597 nm处产生2个清晰的等吸光点,此时进一步证明了配位体系的形成;根据Gouterman的四轨道模型及Q带与配体供电子能力的关系[12],配体供电子能力增加则Q带红移,503 nm峰和543 nm附近的肩峰同时红移的实验现象与咪唑的供电子能力强于水的供电子能力是一致的。
2.2 蛋白质内源芳香氨基酸残基荧光变化分析
对于肌红蛋白的同步荧光光谱Δλ=20 nm时仅表现为酪氨酸残基的荧光,Δλ=60 nm时则显示色氨酸残基的荧光[13]。图2为metMb-咪唑配位体系形成时Δλ=20 nm时酪氨酸残基的发射光谱变化曲线。随着咪唑浓度的不断增加,311 nm处荧光增强,同时347 nm处出现1个新的荧光峰。根据图3中作为空白对照实验的咪唑同步荧光 (Δλ=20 nm)可知,347 nm处的荧光峰是过量的咪唑形成的。311 nm处荧光增强则是由于配位体系的形成影响了酪氨酸残基微环境的极性。

图2 咪唑对metMb溶液同步荧光光谱(Δλ=20 nm)的影响Fig.2 Effects of imidazole on synchronous fluorescence spectra of metMb(Δλ=20 nm)
图 4为 metMb-咪唑配位体系形成时 Δλ=60 nm时色氨酸残基的发射光谱变化曲线。随着咪唑浓度的不断增加,339 nm处的荧光峰和351 nm处的肩峰荧光强度均在增加,并且339 nm处的荧光峰有红移现象;同时,在369 nm处出现1个新的荧光峰。根据图3中作为空白实验的咪唑同步荧光(Δλ=60 nm),369 nm处的荧光峰是过量的咪唑形成的。339 nm处的荧光峰强度增加并有红移现象,表明配位体系的形成造成色氨酸残基微环境极性增加[14-15]。造成图4中351 nm处肩峰越来越明显的原因有2个,其一是色氨酸残基微环境极性增加对色氨酸2个吸收带[16]影响不同从而使得肩峰越来越显著,其二是配位体系的形成对metMb中7位Trp和14位Trp残基微环境极性的影响不同近而使得肩峰越来越显著。图5为1.0 mol·L-1的咪唑滴定浓度为 1.0 μmol·L-1的 Trp 溶液荧光光谱变化曲线,可以看出在逐渐加入咪唑时单独的一个Trp并没有出现肩峰和肩峰增强的现象,只是表现出378 nm处咪唑的荧光峰逐渐增强(对照实验图2)。因此,可推断出图4中351 nm处肩峰越来越明显的原因是后者。

图3 缓冲溶液、咪唑的荧光光谱Fig.3 Fluorescence spectra of buffer and imidazole

图4 咪唑对metMb溶液同步荧光光谱(Δλ=60 nm)的影响Fig.4 Effects of imidazole on synchronous fluorescence spectra of metMb(Δλ=60 nm)

图5 咪唑对Trp溶液荧光光谱的影响Fig.5 Effects of imidazole on fluorescence spectra of Trp
2.3 配位中心铁卟啉环的荧光变化分析
用Soret带409 nm激发metMb可发射597 nm的荧光[17],这是由 eg*(π)-a2u(π)跃迁产生的。对照实验表明咪唑在此处没有荧光峰。为尽量减少光照对铁卟啉环荧光性能的影响,只扫描metMb样品及最后一次加入咪唑的荧光光谱图,其余则采用荧光定点采集模式测定597 nm处的荧光强度。图6表明随着咪唑浓度的增加,597 nm处卟啉环荧光增强。这是由于当metMb与咪唑分子进行配位反应时,使得卟啉环上电子密度增大,基态电子数增加所致。这是咪唑与metMb之间形成轴配体系的证据之一[12]。此结论与紫外-可见吸收光谱的结果一致。
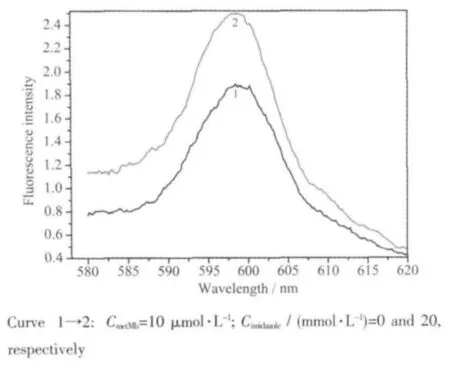
图6 咪唑对metMb铁卟啉环荧光光谱的影响Fig.6 Effects of imidazole on fluorescence spectra of heme of metMb
以铁卟啉环597 nm荧光强度为纵坐标,咪唑浓度为横坐标作图(图7),对实验数据(298 K)线性拟合得到直线方程(相关系数R=0.979 06),说明铁卟啉环荧光强度与加入咪唑的浓度成较好的线性关系。
2.4 咪唑与metMb的结合常数及热力学参数
设咪唑分子与metMb配位时有n个相互独立且等同的结合位置,则对下述反应(其中L代表咪唑)

结合常数K为

式中,CLnmetMb为生成物 LnmetMb 的浓度,Cf,L,Cf,metMb分别为咪唑和metMb的游离浓度,Ct,metMb为metMb的总浓度。因铁卟啉荧光的增强是由于咪唑和metMb配位引起,则有

令ΔF=F-F0

即
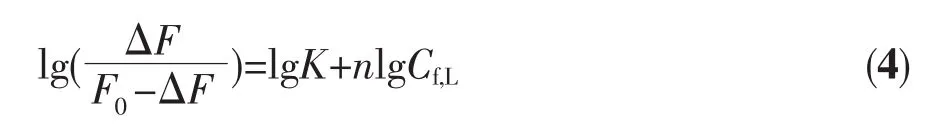
式中F0和F分别为未加和加入给定浓度的咪唑时溶液的荧光强度。因为溶液中咪唑的总浓度远大于反应消耗掉的咪唑浓度,所以Cf,L可以用溶液中咪唑的总浓度代替。
由实验测得不同温度(298、303、308 K)时体系在597 nm处的荧光数据,根据公式(4)分别以lg[ΔF/(F0-ΔF)]对lgCf,L线性拟合,求得咪唑与metMb配位反应的结合常数K和配位数n(见表1)。
由表1结果可知,配位数n≈1,表明咪唑与metMb之间配位反应是按物质的量比1∶1进行的(见Scheme 1);线性关系较好说明荧光增强公式[21]对所研究的metMb配位反应体系是适合的。除此之外,K随着温度的升高而逐渐减小,说明温度升高不利于轴配位反应的进行。

表1 MetMb与咪唑配位反应的结合常数K、结合位点数n、线性相关系数R和热力学参数Table 1 Binding constant K,number of coordination n of coordination reaction between metMband imidazole,correlation coefficient R and the thermodynamic parameters

图式1 MetMb与咪唑的配位反应Scheme 1 Coordination reaction between metMb and imidazole

中stopped-flow动力学方法求出的metMb和配体结合热力学数据相比较,符号和大小均在文献范围内[18-20](表1)。配位反应的焓变和熵变均为负值,表明焓变是整个配位反应的主要动力。
3 结 论
本文运用光谱法研究了metMb与咪唑配位反应的光谱性质及反应特点。实验结果表明,metMb-咪唑配位体系的形成使得metMb的Soret带和Q带均发生红移;并对7位和14位2个Trp残基微环境极性影响不同;另外还造成metMb活性中心铁卟啉597 nm处荧光增强,并且体系荧光强度与加入咪唑的浓度成线性关系,由此计算了不同温度下配位反应的配位数、结合常数及热力学参数。与动力学方法得到的数据相比较,这些数据均比较合适。这些实验结果和方法有助于研究其他血红素蛋白配位反应的光谱学性质和热力学参数等。
参考文献:
[1]Wittenberg J B.Physiol.Rev.,1970,50:559-636
[2]Hills B A.Science,1973,182:823-825
[3]Soldatova A V,Ibrahim M,Olson J S,et al.J.Am.Chem.Soc.,2010,132:4614-4625
[4]Laverman L E,Wanat A,Oszajca J,et al.J.Am.Chem.Soc.,2001,123:285-293
[5]Nicoletti F P,Thompson M K,Howes B D,et al.Biochemistry,2010,49:1903-1912
[6]Yukl E T,de Vries S,Moenne-Loccoz P.J.Am.Chem.Soc.,2009,131:7234-7235
[7]Feis A,Marzocchi M P,Paoli M,et al.Biochemistry,1994,33:4577-4583
[8]WANG Shu-Jun(王树军).Chin.J.Appl.Chem.(Yingyong Huaxue),2010,27(6):721-726
[9]XU Xin(徐昕),ZOU Jian-Zhong(邹建忠),YE Lei(叶蕾),et al.Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),1999,15(1):89-94
[10]CHENG Yi(程驿),LIN Hua-Kuan(林华宽),WANG Kui(王夔).Chem.J.Chinese Universities(Gaodeng Xuexiao Huaxue Xuebao),1998,19(6):876-878
[11]Zerner M,Gouterman M,Kobayashi H.Theor.Chim.Acta,1966,6:363-400
[12]NI Chun-Lin(倪春林),LU Hui-Jun(卢惠娟).Chem.Reag.(Huaxue Shiji),2002,24(5):268-270
[13]JIAN Ju(剑菊),YANG Xiu-Juan(杨秀娟),DU Jiang-Yan(杜江燕),et al.Chin.J.Anal.Chem.(Fenxi Huaxue),2001,29(2):219-221
[14]MA Jing(马静),ZHENG Xue-Fang(郑学仿),TANG Qian(唐乾),et al.Chem.J.Chinese Universities(Gaodeng Xuexiao Huaxue Xuebao),2008,29(2):258-263
[15]Joseph R L.Principles of Fluorescence Spectroscopy.New York:Plenum Press,1983:533
[16]Havel H A.Spectroscopic Methods for Determine Protein Structure in Solution.New York:Wiley-VCH,1996:66
[17]FENG Yu-Ying(冯玉英),YANG Hui(杨辉),GU Xiao-Tian(顾晓天),et al.Spectrosc.Spectr.Anal.(Guangpuxue Yu Guangpu Fenxi),2003,123(3):532-534
[18]Blanck J,Scheler W.Acta Biol.Med.Germ.,1968,20:721-730
[19]Anusiem A C,Beetlestone J G,Irvine D H.J.Chem.Soc.,1966,77:2687-2891
[20]George P.Currents in Biochemical Research.New York:Interscience,1956:338
[21]TANG Shi-Hua(唐世华),LI Jing-Quan(李景权),LEI Fu-Hou(雷福厚).Acta Chim.Sin.(Huaxue Xuebao),2009,67(3):185-190
Spectral Study on Coordination Reaction between MetMb and Imidazole
ZHOU Hua-Wei2CAO Hong-Yu1,2TANG Qian1,2LI Jin-Jing1ZHENG Xue-Fang*,1,2
(1College of Bioengineering,Dalian University,Dalian,Liaoning 116622,China)(2Liaoning Key Laboratory of Bio-organic Chemistry,Dalian University,Dalian,Liaoning 116622,China)
The spectroscopic properties of coordination reaction between metMb and imidazole were investigated by means of UV-Vis absorption spectra,fluorescence spectra,and synchronous fluorescence spectra.The experimental results showed that the transitions of Soret and Q band shifted to lower energies due to the formation of metMbimidazole complex;effect of the formation of metMb-imidazole complex on Trps at position 7 and 14 were different;the equation for calculating the binding constant of imidazole to metMb was introduced based on the relationships between the fluorescence enhancement of heme at 597 nm and the concentration of imidazole.According to the fluorescence enhancement equation,the binding constants of the complex at different temperatures and the thermodynamic parameters at corresponding temperatures were obtained.The coordination reaction was carried out in a molar ratio of 1∶1.The association constant would decrease with increasing temperature,which was a disadvantage factor for the reaction.The thermodynamic parameters revealed that the driving force of the coordination reaction was the change of enthalpy.
metmyoglobin;imidazole;coordination reaction;thermodynamic property;fluorescence spectrum
O629.73;Q518.2
:A
:1001-4861(2011)03-0445-06
2010-10-18。收修改稿日期:2010-11-02。
国家自然科学基金(No.20871024)、辽宁省高校创新团队项目(No.2006T002,2008T005,2009T003);辽宁省教育厅项目(No.2009A069,2009A071)和大连市科技计划项目(No.2008E11SF170)资助。
*通讯联系人。 E-mail:dlxfzheng@163.com
