芳基锌试剂在偶联反应中的研究进展
2011-09-29严胜骄
席 亮,严胜骄,林 军
(云南大学化学科学与工程学院教育部自然资源药物化学重点实验室,云南昆明 650091)
芳基锌试剂在偶联反应中的研究进展
席 亮,严胜骄,林 军
(云南大学化学科学与工程学院教育部自然资源药物化学重点实验室,云南昆明 650091)
有机锌偶联反应是有机合成中形成碳碳键的重要方法之一.主要综述了芳基锌试剂的制备及其与官能团化合物的偶联反应,并对该反应在近年来有机合成中的应用进展进行了介绍.
芳基锌试剂;偶联反应;研究进度
偶联反应的研究始于上世纪 70年代,因其可高效、专一地形成碳 -碳键而成为合成方法学中最活跃的研究领域之一.常见的几类交叉偶联反应包括 Negishi反应 (卤代物和有机锌)、Stille反应 (卤代物和有机锡)、Suzuki反应 (卤代物和有机硼)、Heck反应 (卤代物和烯烃)等,这些反应可以使 2个小分子通过 C-C键结合成结构较复杂的大分子,在功能材料、液晶及药物的合成等方面均有广泛应用.其中,有机锌试剂由于制备方便,毒性小,对官能团兼容性强等特点,己成为现代合成化学中很多新反应的源泉,也是实现有机合成中高选择性、高原子经济性及温和条件反应的重要手段.文中综述了一些常见芳基锌化合物的制备方法及其在有机合成中的应用进展.
1 芳基锌试剂的制备
有机锌试剂是最早发现的有机金属试剂之一,由于没有格氏试剂活泼而使其具备良好的官能团兼容性及很高的化学、区域和立体选择性[1].它除了能进行格氏试剂所能发生的偶联反应外,反应物中可以存在氰基、酯基及羰基等活性基团,可实现含官能团化合物合成的最短途径.此外,与有机铜和有机锂试剂相比,有机锌的分子中还可允许相对显酸性的质子存在[2],从而使反应可以在更加宽松的条件下进行.
有机苯锌试剂可以通过直接将锌插入卤代苯制备,但需较高温度及极性溶剂条件[3],而官能团化的有机锌则通过碘锌或溴锌交换反应来制备.另一经典的方法是进行锂与锌的交换反应,由于有机锂的稳定性较差而使其应用受到限制[4],但可以在钯催化下,经过卤代物将其转化为相应的低活性有机锌化合物,如脂肪族及苄基型有机锌卤化物可直接由锌粉和相应的卤代物制备[5],芳基锌可以从活性锌与芳卤直接反应[6],或由相应的格氏试剂与无水 ZnCl2反应制备[7-8].
1.1 通过锌的直接插入制备
早在 1849年,Frankland就在氮气保护下,将金属锌与碘乙烷一起加热,合成了有机锌化合物——二乙基锌[9].1962年,Gaudedemar发现在温和的条件 (25~50℃)下,锌箔在四氢呋喃中能迅速与碘代烷发生金属插入反应,这是制备官能团化有机锌的一般方法.反应速率主要与单质锌的活化方法、卤代烃的结构、卤素种类及反应条件 (溶剂、底物的浓度和反应湿度)等因素有关[10].2003年,Kazmierski等发现在 Co的催化下可由锌粉以较高的产率直接制得芳基锌[11](Scheme 1).

1.2 通过碘锌交换反应制备二芳基锌
二烃基锌试剂可与醛类发生不对称加成反应,广泛用作合成具有光学活性伯醇的亲核试剂,因而这类锌试剂的制备显得尤为重要.1966年,Furukawa发现二碘甲烷容易与二乙基锌发生碘交换反应,以定量的产率生成碘甲基乙基锌和碘乙烷[12].近年的研究表明,含各种官能团的伯碘化物均可发生此反应,生成官能团化的二芳基有机锌试剂[13](Scheme 2).

1.3 通过对官能团化的有机铜试剂的插入反应制备
将锌直接插入卤代物已经成为有机锌卤制备的最常见方法,而一些文献描述了将有机铜[14-15]通过I CH2ZnI转化为 NuCH2Cu·ZnI2[16-18]的方法,这种方法常用于得到增加一个碳原子的苄基铜锌试剂(Scheme 3).

1.4 通过有机锂试剂的锂 -锌金属交换制备
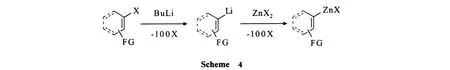
由于烯基卤和芳基卤很难与金属锌发生直接插入反应,而烯基锂和芳基锂相对较容易制备,因此,先合成锂化物再进行锂 -锌交换,是制备一些烯基卤化锌和芳基卤化锌的较好途径[19-21](Scheme 4).
2 芳基卤化锌的偶联过程
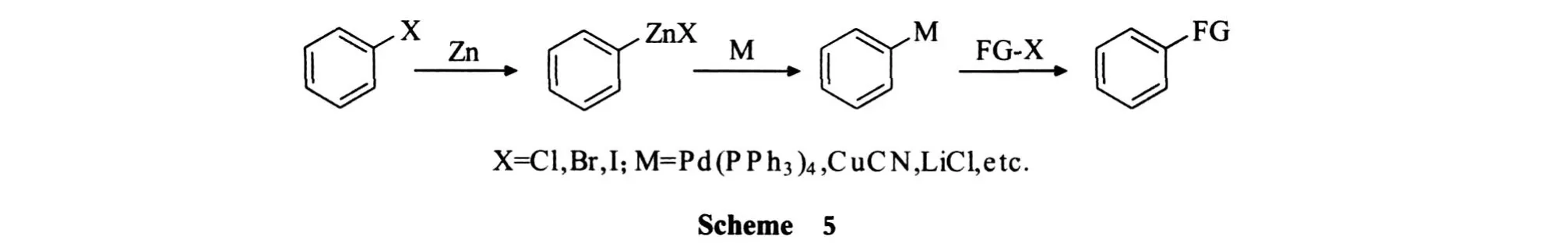
钯催化芳基卤化锌偶联反应分为有机锌的引入,高活性金属离子通过离子交换反应对反应基团的激活,金属催化偶联这 3个步骤.直接插入法、碘锌交换法、锂锌交换法及苄基铜锌试剂等方法可对芳基卤化物引入金属锌,再通过高活性金属离子对反应基团的激活,最后与官能团化卤代物反应进行偶联(Scheme 5).
2.1 高活性金属离子通过离子交换反应对反应基团的激活
带有官能团的有机金属试剂,其活性主要取决于分子中金属的活性.有机金属化合物中碳 -金属键离子型越大,越能提高官能团在有机反应中的活性.通常认为有机锂试剂、格式试剂等比有机锌类化合物有着更高的活性[22],如 Scheme 6(鲍林标度)所示金属活性顺序.

然而有机反应中有机金属试剂要具有一定的化学稳定性,这就要求金属本身对其自身所带的官能团显示出一定的化学惰性,那么这些有机金属试剂的碳 -金属键的反应活性必然很低,但这样的有机金属试剂同样对大多数亲电试剂的反应活性也较低,甚至没有活性.直到 20世纪 70年代,人们针对这一矛盾有了初步的解决方案,那就是将高活性的有机镁和有机锂试剂用铜盐或钛盐处理,发生金属交换反应,得到具有高化学选择性的新型试剂——有机铜或有机钛试剂.然而由于这类化学选择性的有机金属试剂是由相应的高活性、低选择性的有机镁和有机锂试剂制得,真正高度官能团化的有机铜和有机钛试剂仍不能制得.
这个矛盾可通过采用 2种金属 Zn和高活性金属M进行 2次金属化得以解决.锌的作用是将高度官能团化的底物 FG-RX转化为较稳定、反应活性相对较低有机金属试剂 FG-RZn,然后再被其它金属M转化为反应活性较高的有机金属试剂 FG-RM,之后再与亲电试剂发生各种类型的反应.
2.2 目标基团的引入——偶联成键
官能团化有机锌化合物通常情况下只能与高活性的亲电体 (烯丙基卤、苄基卤)较好地进行偶联反应.如目标产物与芳基共轭,多将其转化为有机铜后偶联,其它情况下则在镍与钯的催化下以提高偶联反应的活性 (Scheme 7).也有文献报道,冠醚的引入可以提高反应速率和产率[23].

3 芳基卤化锌偶联反应的应用
3.1 立体选择性合成芳基取代α,β-不饱和酯
TsCl与 N-甲基咪唑偶联生成高活性的 N-sulfonylamonium中间体,β-酮酯可以较好的产率经 TsCl-NM I-Et3N反应生成反式产物,经 TsCl-NM I-LiOH反应生成顺式产物.产物再与芳基卤化锌经 Negishi或Sonogashira偶联得立体芳基取代α,β-不饱和酯[24](Scheme 8).

3.2 二苯乙烯及其类似物的合成
这是 Negishi反应的又一最新应用,可比较高效地形成二苯乙烯及其类似物,且可在不需附加配体的常见催化条件下,与包括含杂原子的官能团反应.不同取代基条件下,产率在 70%左右[25](Scheme 9).

3.3 官能团化三苯基膦的合成
三苯基膦及其衍生物是重要的化学试剂和均相催化剂的配位体,可作为维蒂希试剂 (W ittig Reagent)、威尔金森催化剂 (W ilkinson Catalyst)、Rydon试剂等参与有机合成反应,并能用做橡胶抗臭剂、润滑油抗氧化剂、抗静电剂、阻燃剂、抗腐蚀剂等[26].Gall等人从官能团化芳基溴化锌出发,与 Ph2PCl一步反应直接得到官能团化的三苯基膦,产率约为 70%~80%[27](Scheme 10).

3.4 取代联苯化合物的合成
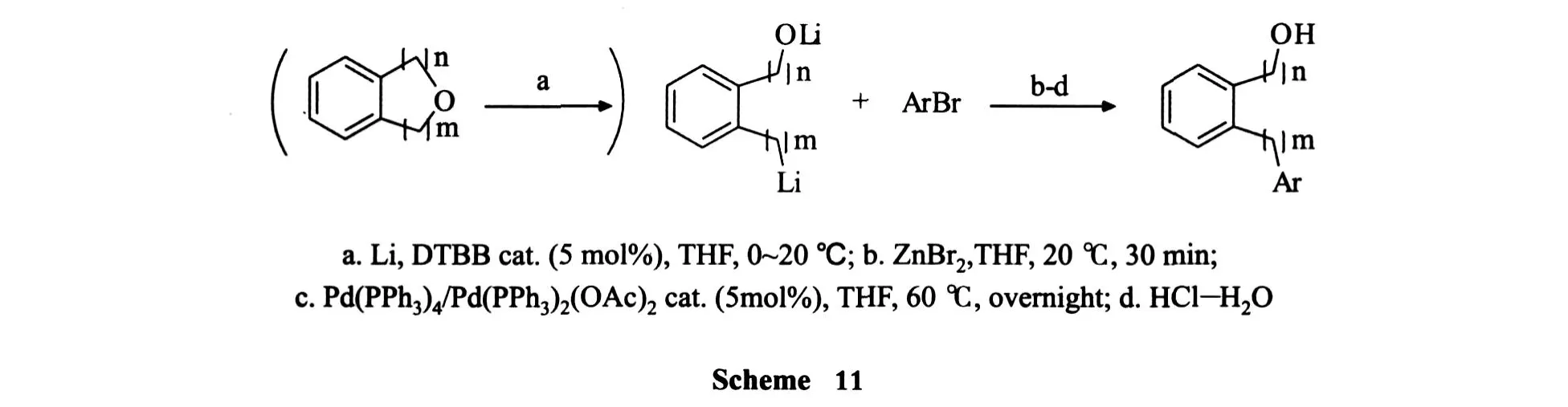
含苯基的杂环类化合物,可由锂先进行开环,再通过锂 -锌交换反应制备有机锌,然后经与芳基 Negishi试剂偶联生成邻位苯取代化合物.该反应条件温和,产物纯度在 95%以上,产率约 70%[28](Scheme 11).
3.5 多官能团 Oligoarenes型催化剂的合成
多官能团 Oligoarenes型催化剂作为一种经典的生物活性催化剂,在自组分子[29-30]生物活性化合物[31]以及生物模拟酶[32]等方面有着重要应用.此长链分子在以溴代苯酚为基元的基础上,经酚基保护及去保护2步重复反应合成[33](Scheme 12).

3.6 芳香型非蛋白质氨基酸的合成
非蛋白氨基酸是指除组成蛋白质的 20种常见氨基酸以外的含有氨基和羧基的化合物.非蛋白氨基酸是对天然氨基酸的有益补充,与蛋白氨基酸相比,它自身代谢与结构功能方面有着蛋白氨基酸所不能起到的作用.人们在它的发现与合成上,对其功能与应用的研究也逐渐深入,如能深入地了解非蛋白氨基酸的作用机理,将有助于研究和开发出结构特殊的非蛋白氨基酸药物[34].
在钯催化芳香卤化物和α,β,γ反应氨基酸衍生的有机锌碘经 Negishi交叉耦合已被广泛用于非蛋白质氨基酸及其衍生物的合成.但与β,γ氨基酸相比,有机锌试剂分子内稳定性更好,反应更加简便易行[35](Scheme 13).

3.7 艾氏腹水癌抑制剂——OF4949-III的合成
艾利希氏腹水癌细胞 (Ehrlich′s ascites carcinoma cell)是由罗旺塔尔 (H.Loewenthal)在 1930年将埃利希(P.Ehrlich)在鼷鼠身上所发现的鼷鼠移植性乳癌转变成的腹水型肿瘤细胞,这是与吉田肉瘤 (Yoshida sarcoma)同样的恶性腹水瘤.其 RNA及磷酸酶的含量比正常细胞多,不仅用腹水 (0.2~0.3mL)可以移植,且用任何系统的廉价鼷鼠都有很高移植率,所以多用于癌的生物化学、化学疗法和病毒学等研究.
OF4949-Ⅲ结构为联苯环状三肽化合物,能够抑制艾氏腹水癌细胞产生的氨基肽酶B,从而阻止肿瘤细胞的扩散[36].合成 OF4949-Ⅲ的方法之前有许多报道,其核心是分子间的交叉偶联,有机锌试剂将氨基酸叔丁酯引入联苯化合物,从而成为形成环状三肽分子构型的关键步骤[37](Scheme 14).

3.8 罂粟碱的合成
罂粟碱对血管、支气管、胃肠道、胆管等平滑肌都有松弛作用,通过松弛血管平滑肌,使冠脉扩张、外周阻力及脑血管阻力降低,主要用于脑血栓形成、肺栓塞、肢端动脉痉挛症及动脉栓塞性疼痛等,亦可用于治疗肠道、输尿管及胆道痉挛疼痛和痛经,以及作为复方支气管扩张喷雾剂的组分;还可用于高血压、心绞痛、并发心律失常的心脏局部缺血症等.
针对有机锌化合物在合成有机大分子方面的优势,从异喹啉出发,通过对 2个主要底物的卤化、锌化,最后经偶联合成罂粟碱[38](Scheme 15),这是有机锌试剂偶联反应合成天然产物的一个成功范例.

4 总结与展望
芳香化合物因受其本身空间构型影响,偶联反应并不能很容易进行,引入高活性有机金属试剂可增加芳基的活性,但高活性带来的不利后果就是反应的选择性较差.为此人们才引入了有机锌试剂,利用其对烯丙基、苄基等官能团的优良选择性来进行选择性偶联反应,不仅广泛应用于各类小分子的合成,也被应用于天然产物的合成.
近年来,不对称交叉偶联反应逐渐兴起,为金属锌参与的芳香化合物偶联反应提出了更高的要求.虽然在研制新型手性含锌配体,拓展新的反应类型或提高产物的对映选择性等方面都已取得长足的进步.但在多数情况下,产物的 ee值离实际应用的需要仍有一定的差距,且由于手性催化剂的制备困难,价格较高等限制了它的实际应用.进一步研制催化活性高,对映选择性更好,易与有机锌试剂结合的廉价高效的手性催化剂将是芳香化合物偶联反应未来发展的新方向.
[1]WE IDMANN B,SEEBACH D.Organometallverbindungen von titan und zirconium als selektive nucl-eophile reagentien für die organische synthese[J].Angew Chem,1983,95(1):12-26.
[2]KNOESS H P,FURLONGM T,ROZEMA M J,et al.Preparation and reactions of zinc and copperorganometallics bearing acidic hydrogens[J].J Org Chem,1991,56(21):5 974-5 978.
[3]YUGUCH IM,TOKUDA M,OR ITO K.Pd(0)-catalyzed conjugate addition of benzylzinc chlorides toα,β -enones in an atmosphere of carbon monoxide:preparationof 1,4-Diketones[J].J Org Chem,2004,69(3):908-914.
[4]R ICHARD H,MUELLER SW,PAUL D.Diastereoselective reaction of a grignard reagentwith chiral imides:A practical preparation of a key intermediate in the synthesis of ifetroban sodium[J].Recent ResDevelOrg Chem,1997,1(1):14-19.
[5]FRANCO IS C J,LEONEM,GERAND P.A convenient synthesis ofβ-hydroxyesters from andehydes or ketones and-bromoestersBrCH2-Coor’,R’beingA long Carbon chain[J].Synth Commun,1989,19(11,12):2 167-2 173.
[6]ZHU L Ishan,R IEKE R D.A facile method for the preparation of functionalized 2,3-disubstituted-1,3-butadienes[J].Tetrahedron Lett,1991,32(25):2 865-2 866.
[7]OKAMOTO Y,YOSH IOKA K,YAMANA T,et al.Palladium-catalyzed cross-couplingof bromobenzenes,containing an acetylor a formyl group,with organozinc reagents[J].J Organomet Chem,1989,369(3):285-290.
[8]AMATORE C,JUTAND A,NEGR I S,et al.Efficient palladium-catalyzed synthesis of unsymmetric aldonor acceptor biaryls and polyaryls[J].J Organomet Chem,1990,390(3):389-398.
[9]FRANKLAND E.Justus ueber die isolirung der organischen radicale[J].LiebigsAnn Chem,1849,71(2):171-213.
[10]FREUND A.Ueber die natur der ketone[J].LiebigsAnn Chem,1861,118(1):1-21.
[11]KAZ M IERSKI I,GOS M IN IC,PAR IS J M.New progress in the cobalt-catalysed synthesis of aromatic organozinc compounds by reduction of aromatic halides by zinc dust[J].Tetrahedron Lett,2003,44(34):6 417-6 420.
[12]FURUKAWA J,KAWABATN,N ISH IMURA J.A novel route to cyclopropanes from olefins[J].Tetrahedron Lett,1966,7(28):3 353-3 354.
[13]ROZENMA M J,S IDDURIA,K NOCHEL P.Preparation of functionalized dialkylzinc reagents via an iodine-zinc exchange reaction.Highly enantioselective synthesis of functionalized secondary alcohols[J].J Org Chem,1992,57(7):1 956-1 958.
[14]HERMAN W A.Synthetic method of organometallic and inorganic chemistry[M].Stuttgart:Theme,1999.
[15]SOA I K,N IWA S.Enantioselective addition of organozinc reagents to aldehydes[J].S Chem Rev,1992,92(5):833-856.
[16]NEGISH I E.Palladium-or nickel-catalyzed cross coupling.A new selective method for carbon-carbon bond for mation[J].Acc Chem Res,1982,15(11):340-348.
[17]S IB ILLE S,RATOVELOMANANA V,PER ICHON J.Electrochemical conversion of functionalised aryl chlorides and bromides to arylzinc species[J].J Chem Soc Chem Commun,1992,283-284.
[18]TAMARU Y,OCH IA I H,YOSH IDA Z.Enone synthesis via Palladium catalyzed reductive carbonylation of ter minal acetylenes[J].Tetrahedron Lett,1984,25(35):3 861-3 864.
[19]TUCKER C E,MAJ ID TN,Knochel P.Preparation of highly functionalizedmagnesium,zinc,and copper aryl and alkenylorganometallics via the corresponding organolithiums[J].J Am Chem Soc,1992,114(10):3 983–3 985.
[20]KLEMENT I,ROTTLÄNDER M,TUCKER C E.Preparation of polyfunctional aryl and alkenyl zinc halides from functionalizedunsaturated organolithiums and their reactivity in cross-coupling and conjugated addition reactions[J].Tetrahedron,1996,52(21):7 201-7 220.
[21]TUCKER C E,ACHYUTHARAO S,KNOCHEL P.The olefination of functionalized alkylidenemalonates by 1,1-dimetalloalkanes:a new chemo-and stereoselective preparation of functionalized olefins[J].J Org Chem,1990,55(20):5 446-5 448.
[22]KNOCHEL P,ALMENA J,JONES P.Organozinc mediated reactions[J].Tetrahedron,1998,54(29):8 275–8 319.
[23]VENKATRAANM S,L IC J.The effectof crown-etheron the palladium-catalyzed ul lmann-type couplingmediated by zinc in air and water[J].Tetrahedron Lett,2000,41(25):4 831-4 834.
[24]NAKATSUJ IH,UENO K,M ISAKI T,et al.General,robust,and stereocomplementary preparation ofβ-ketoester enol tosylates as cross-coupling partners utilizing TsCl-N-Methyl imidazole agents[J].OrgLett,2008,10(11):2 131-2 134.
[25]METZGER A,SCHADEM A,KNOCHEL P.LiCl-mediated preparation of highly functionalized benzylic zinc chlorides[J].Org Lett,2008,10(6):1 107-1 110.
[26]谭国华.三苯基膦及其应用[J].化工时刊,1994,8(3):7-12.
[27]GALL E L,TROUPELA M,NÉDÉLEC J Y.Nickel-catalyzed reductive coupling of chlorodiphenylphosphine with aryl bromides into functionalized triarylphosphines[J].Tetrahedron,2003,59(38):7 497-7 500.
[28]M IGUEL Y,JOAQU IN G.Negishi cross-coupling with functionalised organozinc compounds prepared by lithium–zinc transmetallation[J].Tetrahedron Lett,2001,42(33):5 721-5 724.
[29]LEHN J M.Supramolecular chemistry:concepts and perspectives:Vol 9[M].Weinheim:VCH,1995.
[30]SAKA IN,MAREDA J,MAT ILE S.Rigid-Rod molecules in biomembrane models:From hydrogenbonded chains to synthetic multifunctional pores[J].Acc Chem Res,2005,38(2):79-87.
[31]ORNER B P,ERNST J T,HAM ILTON A D.Toward proteom imetics:Terphenyl deri vatives as structural and functionalmimicsof extended regions of anα-helix[J].J Am Chem Soc,2001,123(22):5 382-5 383.
[32]CRAM D J,SUN P Y,HO S P.A transacylase partialm imic[J].J Am Chem Soc,1986,108(4):839-841.
[33]SH IM IZU H,MANABE K.Negishi coupling strategy of a repetitive two-step method for oligoarene synthesis[J].Tetrahedron Lett,2006,47(33):5 927-5 931.
[34]范镇基.非蛋白氨基酸的应用和功能研究进展[J].广东科技,2009,18(7):118-120.
[35]OS WALDA C L,CARR ILLO-MÁRQUEZA T,CAGG IANO L.Negishi cross-coupling reactions ofα -amino acid-derived organozinc reagents and aromatic bromides[J].Tetrahedron,2008,64(4):681-687.
[36]SCHM IDTU,WELLER D,HOLDER A.Total synthesis of 4949-Ⅲ,a natural inhibitor of aminopeptidase B from ehrlich ascites carcinoma cells[J].Tetrahedron Lett,1988,28(26):3 227-3 230.
[37]NOLASCO L,GONZALEZM P,CAGG IANO L.Application of negishi cross-coupling to the synthesisof the cyclic tripeptidesof 4949-Ⅲand K-13[J].J Org Chem,2009,74(21):8 280– 8 289.
[38]SHAHJAHAN K,AARON M,JAMESM C.An efficient palladium-catalyzed negishicross-coupling reaction with arylvinyl iodides:facile regioselective synthesis of E-stilbenes and their analogues[J].Tetrahedron Lett,2007,48(41):7 269-7 273.
(责任编辑王 琳)
Research Advances of Aromatic Zinc Reagent in Coupling Reaction
XILiang,YAN Sheng-jiao,LIN Jun
(KeyLaboratory ofMedicinal Chemistry forNatural Resource,Ministry of Education,School of Chemical Science and Technology,Yunnan University,Kunming 650091,China)
Organic zinc coupling reaction is one importantmethod to form carbon-carbon bond in organic synthesis.The preparation of aromatic zinc reagent and the coupling reaction with functional compounds has been reviewed,and the recent application progresses in organic synthesis have been discussed.
aromatic zincreagent;coupling reaction;application
O 627.23
A
1672-8513(2011)01-0001-08
10.3969/j.issn.1672-8513.2011.01.001
2010-08-05.
国家自然科学基金(20762013,30860342).
席亮 (1986-),男,硕士研究生.主要研究方向:有机合成.
林军 (1960-),男,教授,博士生导师.主要研究方向:有机合成.
