不同游泳训练对大鼠海马蛋白激酶C表达的影响
2011-09-28张瑞萍钦少君赵振军张安民
张瑞萍,钦少君,赵振军,张安民,张 波
不同游泳训练对大鼠海马蛋白激酶C表达的影响
张瑞萍1,钦少君1,赵振军1,张安民1,张 波2
海马是下丘脑-垂体-肾上腺皮质轴(HPA)应激反应的高位调节中枢,在抑制 HPA的应激反应中起着非常重的作用。刺激海马可抑制应激诱导的糖皮质激素的分泌,损伤整个海马或海马背侧,则可引起 HPA轴对多种应激源的敏感性增强,血浆糖皮质激素浓度异常升高[16]。据此,Fuchs提出边缘系统-下丘脑-垂体-肾上腺皮质轴(HLPA)的概念[13],因此,作为边缘系统的海马就更受关注。蛋白激酶C(protein kinase C,PKC)是Nishizuka等1977年被发现的,它是 Pl信号传递系统中的一个重要的蛋白激酶,因其广泛参与细胞信息传递、分泌、离子通道调节、细胞增殖、分化及癌变等一系列与生命现象相关的过程而成为生物界和医学界研究的一个热点。本研究采用不同游泳训练方式建立大鼠运动模型,选取海马结构为研究脑区,应用免疫组织化学的方法对大鼠海马区PKC表达做出检测,进一步探讨游泳运动训练与PKC的关系及其可能机制,为运动训练及运动康复提供理论依据。
作者单位:1.烟台大学,山东烟台264005;2.海军航空工程学院基础部,山东烟台264001
1 材料与方法
1.1 实验动物与分组
55只健康雄性SD大鼠(山东绿叶天然药物研究开发有限公司提供),3月龄,体重255.5±19.4 g,常规分笼饲养,饲养环境温度(19.8±2.9)℃,相对湿度 62.0%±13.5%,自然光照,自由饮食和饮水。大鼠购进后,先适应性喂养3天,记录体重,同时进行适应性游泳,每天一次,由15min、20 min至30 min,逐日递增运动时间。然后随机分为对照组(5只)和训练组(50只),训练组又分为持续游泳训练组(25只)和间歇游泳训练组(25只),每笼5只,分笼饲养。
1.2 游泳训练模型
1.2.1 游泳条件
塑钢玻璃游泳池,规格为150 cm×70 cm×60 cm,水深40 cm,水温控制在(33~36)℃。
1.2.2 游泳方案
训练组进行6周游泳训练,每周训练6天,休息1天。2小组分别采用不同的游泳形式:持续训练组每天游2次,每次150 min,中间休息120 min;间歇训练组每天训练1次,负重3%~5%体重的重物,游泳6 min后休息4min,连续循环训练10组。训练结束后吹干毛发,返回鼠笼。对照组不做任何训练,常规饲养,自由活动。训练按计划进行,2组游泳训练在同一时刻结束。
1.3 体重测量
采用 HD-2006B天平,对大鼠的体重进行全程测量,开始运动前测量1次,然后,每周一运动前对所有大鼠进行体重测量、记录。
1.4 取材与固定
持续训练组和间歇训练组分别于最后一次训练结束后即刻、30 min、60 min、240 min(每个时间点取 5只大鼠),用2%戊巴比妥钠(40 mg/kg)腹腔注射麻醉大鼠,打开胸腔,从心尖将穿刺针插入至升主动脉,然后迅速剪破右心耳,并快速灌入400 ml预冷的生理盐水冲洗血管,随后用4%多聚甲醛250 ml快速灌注,接着放慢速度仍用4%多聚甲醛250ml灌注,进行前固定,然后用10%蔗糖PBS液灌入300 ml,至肺脏变硬变白为止。最后迅速断头,将头部放在冰盘上,打开颅腔,暴露全脑。对照组灌注取脑同时进行。取下海马所在部位脑组织放入4%中性甲醛固定液中固定24 h,更换固定液1次。
1.5 组织固定后的处理
将固定好的脑组织块用手术刀修整,置于水龙头下自来水冲洗6 h后,按顺序分别浸入70%、85%、95%、100%酒精脱水各30 min。将经过脱水处理的组织入二甲苯透明约40 min,然后,按顺序分别浸入在60℃恒温箱中,已熔化的熔点分别为52℃~54℃、56℃~58℃、60℃~62℃的石蜡中,浸蜡时间分别为45 min、1 h、1 h,同时,熔化包埋蜡 (60℃温箱内进行)。包埋时需先点燃酒精灯,将熔化的蜡倒入金属包埋框内,用加温后的镊子速将浸蜡后的组织块放入包埋框内,随后插入标签纸,待自然冷却变硬后取下包埋框。
1.6 石蜡切片
将包埋好的蜡块整理后进行切片,在展片机中展片(水温40℃),分片后用APES(3-氨丙基-3-乙氧基甲硅烷)包被好的载玻片捞片并标记,放入标本盒,稍微晾干后将切片放入60℃烤箱内烘烤过夜。
1.7 SP法免疫组织化学染色
兔抗大鼠 PKC抗体、SP免疫组化试剂盒(3%H2O2、5%山羊血清封闭液,生物素化二抗工作液、辣根酶标记链霉卵白素工作液)、DAB染色试剂盒源自北京博奥森生物技术有限公司。将脑组织石蜡切片常规脱蜡、水化,0.01 mol/LPBS液中漂洗5 min×3次;微波炉内抗原修复15 min(修复前柠檬酸缓冲液需预热至95℃),取出后室温冷却30 min,3%H2O2室温孵育15 min;37℃条件下5%山羊血清封闭非特异性抗原30 min;加入1∶50兔抗大鼠PKC抗体置湿盒内4℃冰箱过夜,取出后置37℃孵育1 h;0.01 mol/LPBS液漂洗5 min×3次,滴加二抗,37℃湿盒内孵育30 min;0.01 mol/LPBS液漂洗5 min×3次,滴加三抗,37℃湿盒内孵育30 min;0.01 mol/LPBS液漂洗5 min×3次,最后DAB显色10 min;苏木精复染5 min,充分水洗30 min。常规上行梯度酒精脱水,二甲苯透明,中性树胶封片。
1.8 图像分析与统计学分析
选取免疫组化标记的切片,参照《大鼠脑立体定位图谱》,定位于海马。采用 ImagePro-Pluse图像分析系统(IPP,美国Media Cybernetics公司),先测量大鼠DG照片中的阳性染色区域中的灰度值,换算成光密度 (OD),将照片上各点的光密度值累加起来,得到总光密度(IOD),IOD值除以目标分布区域的面积,得到平均光密度值。每例动物取5张切片,在40×10倍光镜下计数统计。采用SPSS 17.0统计软件进行分析,数据以均数±标准差 (X ±S)表示,相同运动形式各时间点与对照组比较采用多重比较,方差齐者采用同LDS法、SNK法方差分析,方差不齐者采用 Games-Howell法、Tambane,s T2法分析;同一时刻两种运动形式之间比较采用 t检验,P<0.05为有统计学意义。
2 结果
2.1 不同游泳方式对大鼠体重的影响
在训练前,间歇训练组和持续训练组与对照组大鼠的初体重相比 (表1),无显著性差异 (P>0.05),训练组大鼠按计划游泳训练2周后,对照组大鼠正常喂养1周后,体重开始增加,并在随后的几周内体重都呈现明显增加的趋势 (P<0.01),说明实验中喂养得当,大鼠处于正常发育状态。从体重增加情况来看,对照组大鼠因不参加训练,与训练组相比虽无显著性差异,但增重是最多的;与间歇组比较,持续组大鼠增重较少 (P<0.05),这与该组大鼠长期进行有氧训练,其主要运动能量来源于体内脂肪的有氧代谢有关;间歇组大鼠训练中以无氧代谢供能为主,有氧代谢供能为辅,因此,体重增加处于中间水平。大鼠体重的不同变化趋势是本实验动物训练客观规律的正确反映,说明大鼠游泳训练运动模型建立很成功。
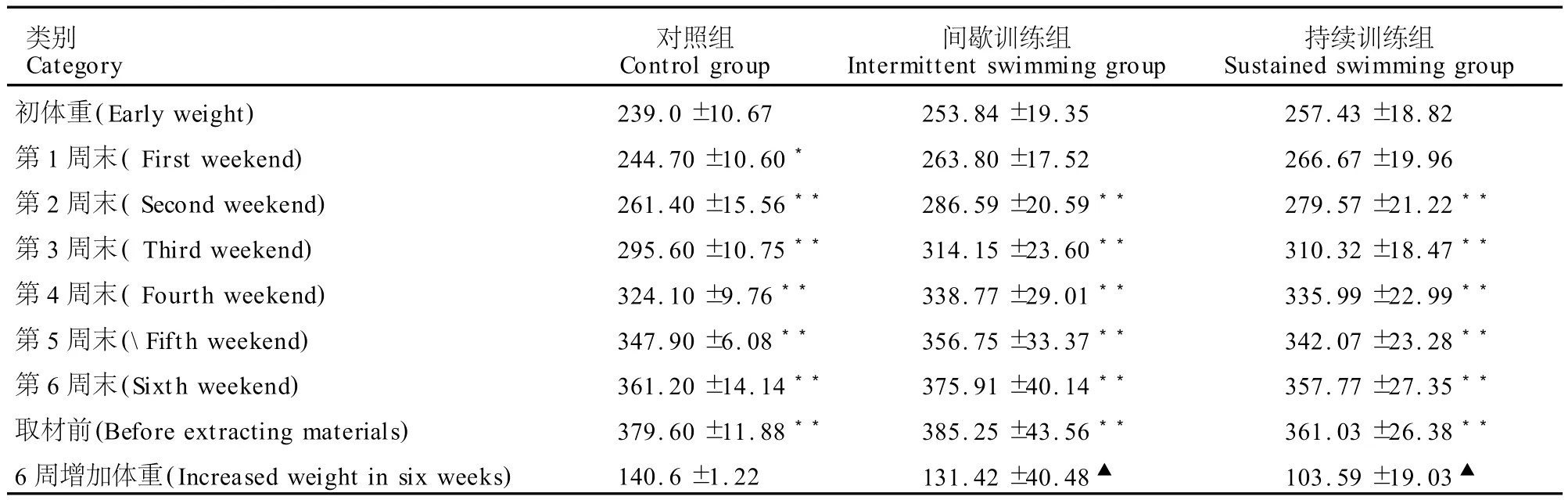
表1 游泳训练后大鼠体重分析结果一览表Table 1 Results of Rat Body Weight after Swimming Training (g)
2.2 SP法海马 PKC的表达
海马在大鼠大脑中的位置形态如图1所示。海马PKC的表达产物染色呈棕黄色,位于神经元胞核内。低倍镜下可见海马 PKC表达呈C形带状分布(图2)。高倍镜下可见对照组大鼠海马锥体细胞层有散在的胞核深染的PKC阳性神经元(图3)。持续游泳训练组和间歇游泳训练组海马锥体细胞层可见均匀分布的大量的胞核深染的PKC阳性神经元(图4、图5)。
2.3 游泳训练后大鼠海马PKC的表达
间歇、持续游泳训练组PKC在训练后各时间点的表达均明显高于对照组(P<0.01,表2),且整个时程内都呈现出波浪式的变化(图2)。持续组 PKC在运动后即刻表达达到最高峰,然后依次呈阶梯式下降趋势;间歇组 PKC则在运动后60 min表达达到最高峰,整个时程变化趋势较平缓。持续组 PKC在运动后即刻、30 min、60 min 3个时段内表达均明显高于间歇组(P<0.01),而运动后240 min时表达则明显低于间歇组(P<0.01)。
图1 冠状位海马结构部位截面图Figure 1. The Coronal Section for Dissection of Hippocampus

图2 训练组海马结构PKC表达图(SP法,×40)Figure 2. Expression of PKC in the Hippocampus in Training G roups(SP,×40)
3 分析与讨论
大鼠具有潜在的、自发的游泳能力,在接受游泳训练时,一般不表现强烈的抵抗行为,因此,可减少对游泳运动外其他不良因素刺激的反映[17]。
PKC属于丝氨酸/苏氨酸激酶家族成员[8],是最早被确认的蛋白激酶之一,由二酰甘油 (diacylg-lycero,l DAG)、Ca2+等第二信使激活。激素、蛋白因子启动的信号转导,经过分布于不同组织中PKC的传递,在各种生命现象中发挥着广泛而重要的作用。PKC有着广泛的底物谱,能使代谢途径的关键酶类、离子通道及细胞膜离子泵磷酸化,使与信号转导有关的蛋白质磷酸化,调控基因表达的转录因子或翻译有关因子,如c-Fos[7,5]、核因子κB等磷酸化,从而影响内分泌腺和外分泌腺的分泌、神经递质的释放、凋亡、神经元可塑性、心肌收缩、平滑肌张力改变和代谢途径调节,在免疫反应及炎症过程中也起重要作用,PKC还参与调控细胞的增殖与分化[10,11,2,1]。PKC在神经系统中起着重要的作用,特别是对大脑的记忆和认知功能产生重要的影响[6]。

图3 对照组海马PKC表达图(SP法,×400)Figure 3. Expression of PKC in the Hippocampus in Control G roupB(SP,×400)

图4 持续组即刻 (A)、30 min(B)、60 min(C)、240 min(D)表达图(SP 法 ,×400)Figure 4. Expression of PKC in the Hippocampus at 0 min,30 min,60 min,240 min after Sustained Swimming Exercise(SP,×400)

图5 间歇组即刻(A)、30 min(B)、60 min(C)、240 min(D)海马 PKC表达图(SP法,×400)Figure 5. Expression of PKC in the Hippocampus at 0 min,30 min,60 min,240 min after Intermittent Swimming Exercise(SP,×400)
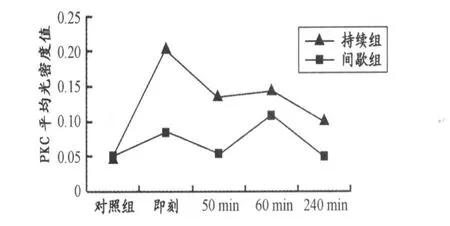
图6 间歇组与持续组大鼠海马PKC表达的时效性示意图Figure 6. Timelines of the Expression of PKC in the Hippocampus in Training G roups
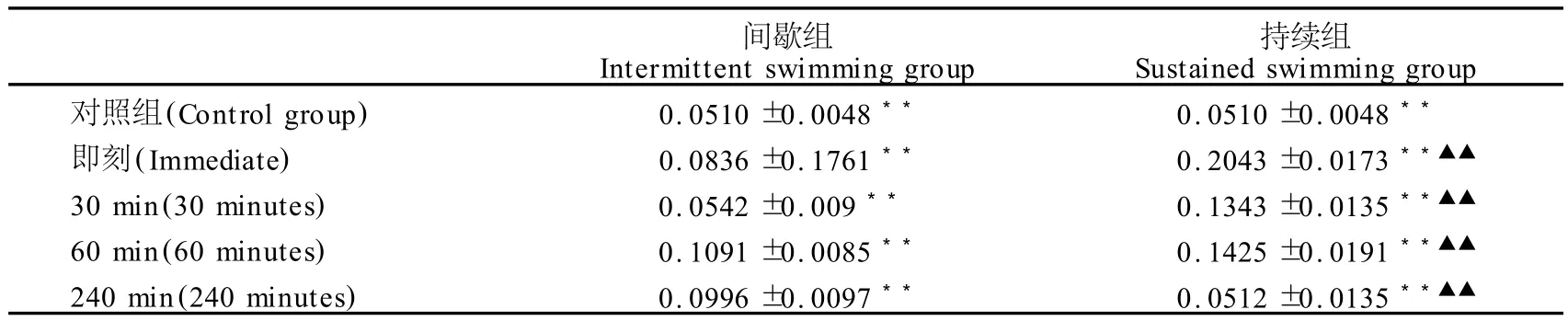
表2 游泳训练后大鼠DG中PKC平均光密度值分析结果一览表Table 2 Mean Optical Density of PKC in Hippocampus after Swimming Training
海马属于边缘系统,是学习记忆的重要神经中枢。研究表明,海马与大脑近期记忆和新信息的储存有关,海马结构受损,动物将丧失将短时记忆转化为长时记忆的功能,从而导致顺行性或逆行性遗忘[9,4]。研究证明,运动训练可以影响海马的神经化学物质,提高有关营养因子的表达,增强神经元的活性,或促进新的神经细胞的生成,提高海马神经细胞突触可塑性,从而提高学习记忆能力[12,14,15,18]。本研究中,游泳运动后大鼠海马 PKC在各个时间点的表达量比对照组均明显增加,说明游泳运动作为一种应激可以促进海马 PKC的表达,激活海马的神经元或促进神经元的活化,加强大鼠的学习记忆功能。
本实验结果显示,持续和间歇游泳运动后大鼠海马PKC的表达都是到达峰值后再降低,且峰值出现的时间、持续的时间与训练方式的不同有关。本研究中,持续游泳训练源于有氧运动模式,间歇游泳训练源于无氧运动模式。持续训练是指负荷强度较低、负荷时间较长、无间断地连续进行练习的训练方法;间歇训练指对多次练习时的间歇时间有严格规定,使机体处于不完全恢复状态下,反复进行练习的训练方法[3]。两种运动的持续时间、间隔时间、运动强度均不同。有氧训练可有效刺激心血管系统、呼吸系统,进而使体内血红蛋白含量增加[8],因此,体内基本无氧负亏情况,而间歇运动负荷强度大,对训练间歇时间有严格规定,运动后即刻大鼠体内存在氧负亏,而后随着机体的逐渐恢复,血氧含量也逐渐升高。本研究中,持续组大鼠在游泳训练后即刻 PKC出现最高峰值,间歇组则在运动后60 min表达达到最高峰,峰值出现较晚,PKC的这种变化趋势可能与大鼠进行不同方式的运动后体内血氧含量的变化有关,其相关性有待进一步验证。总之,运动后大鼠海马 PKC的表达随运动刺激的强度、时间的变化而不同,具有明显的时效性、量效性。
[1]葛薇,尤胜国,王亚非,等.急性髓系白血病细胞总RNA冲击的树突细胞诱导抗自身白血病的 T淋巴细胞免疫[J].中华血液学杂志,2005,26(8):461-464.
[2]何学鹏,尤胜国,卞寿庚,等.急性髓系白血病患者树突状细胞诱导抗自身白血病T细胞免疫的实验研究[J].中华血液学杂志,2001,22(12):629-632.
[3]田麦久.运动训练学[M].北京:高等教育出版社,2006:158-162.
[4]雅德.海马与近期记忆有关[J].国外医学情报,2001,22(1):25.
[5]于芳,张安民,王根深,等.间歇性负重游泳训练对大鼠杏仁核基底外侧核(BLA)C-FOS蛋白表达的影响[J].北京体育大学学报,2008,31(10):1357-1360.
[6]杨红,董海松,林逸玲,等.蛋白激酶C神经保护作用的研究进展[J].Med Recapitul,2009,15(18):2736-2738.
[7]张安民,王根深,于芳,等.大鼠持续运动对中央杏仁核c-fos蛋白表达影响的实验研究[J].体育科学,2008,28(1):39-42.
[8]ADAMS J M,CORY S.The Bcl-2 protein family:arbiters ofcell survival[J].Sci,1998,281(5381):1322-1326.
[9]AGGLETON J P,O’MARA S M,VANN S D,et al.Hippocampal-anterior thalamic pathways for memory:uncovering a network of direct and indirect actions[J].Eur J Neurosci,2010,31(12):2292-307.
[10]CHOUDHURY B A,LIANG J C,THOMAS E K,et al.Dendritic cellsderived in vitro from acutemyelogenous leukemia cells stimulate autologus,antileukemia T-cell responses[J].Blood,1999,93(3):780-786.
[11]CHOUDHURY A,GAJ EWSKI J L,LIANGJ C,et al.Use of leukemic den-dritic cells for the generation ofantileukemic cellular cytotoxicity a-gainstPhiladelphia chromosome positive chronic myelogenous leu-kemia[J].Blood,1997,89(9):1133-1134.
[12]FORDYCE D E,WEHNER J M.Physical Activity Enhances Spatial LearningPerformance with an Associated Alteration in Hippocampal Protein Kinase C Activity inC57BL/6 and DBA/2 Mice[J].Brain Res,1993,619:111-119.
[13]FUCHS E,FLUGGE G.Chronic social stress:effects on limbic brain structures[J].Physiol Behav,2003,79(3):417-427.
[14]GOMEZ-PINILLA F,DAO L,SO V.Physical Exercise Induces FGF2 and Its mRNAin the Hippocampus[J].Brain Res,1997,764:1-8.
[15]HENRIETTE VAN PRAAG H,KEMPERMANN G,GAGE F H.Running increasesCell proliferation and neurogenesis in the adult mouse dentate gyrus[J].Nat Neurosci,1999,(2):266-270.
[16]JACOBSON L,SAPOLSKY R.The role of the hippocampus in feedback regulation of the hypothalamic-pituitary-adrenocortical axis[J].Endocr Rev,1991,12(2):118-134.
[17]KRAMER K,DIJ KSTRA H,BAST A.Control of physical exercise of rats in a swimming basin[J].Physiol Behav,1993,53(2):271-276.
[18]VAN PRAAG H,KEMPERMANN G,Gage FH.Running increases cell proliferation andneurogenesis in the adult mouse dentate gyrus[J].Nat Neurosci,1999,2(3):266-270.
Effects of Different Swimming Exercise Styles on the Expression of Protein Kinase C in Hippocampus of Rats
ZHANG Rui-ping1,QIN Shao-jun1,ZHAO Zhen-jun1,ZHANG An-min1,ZHANG Bo2
目的:探讨不同游泳运动方式对大鼠海马蛋白激酶C(PKC)表达的影响;方法:55只雄性SD大鼠,随机分为对照组(5只)、持续和间歇游泳训练组(各25只)。建立大鼠运动模型,采用SP免疫组织化学方法,观察大鼠海马 PKC在对照组、持续游泳训练组和间歇游泳训练组的表达规律;结果:间歇、持续游泳训练组 PKC在训练后各时间点的表达均明显高于对照组(P<0.01)。持续组PKC在运动后即刻表达达到最高峰;间歇组PKC则在运动后60 min表达达到最高峰。持续组PKC在运动后即刻、30 min、60 min时段内表达均明显高于间歇组(P<0.01),而运动后240 min时表达则明显低于间歇组(P<0.01);结论:游泳运动作为一种应激可以促进海马PKC的表达;运动后大鼠海马PKC的表达随运动刺激的强度、时间的变化而不同。
海马;蛋白激酶 C;游泳训练;大鼠;动物实验
Objective:To analyze the effects of different swimming exercise styles on the expression of protein kinase C(PKC)in hippocampus of rats.Methods:55 male SD rats were randomly divided into control group(n=5),sustained swimming group(n=25)and intermittent swimming group(n=25).To establish the swimming exercise models in rats,and detect the changes of the expression of PKC in control group and in the other two exercise groups after training by using the method of SP immunohistochemistry,then analyze the data with statistical software.Results:After training,the expression of PKC in sustained swimming group and intermittent one was obviously higher than control group at different time points(P<0.01).The expression of PKC was the highest at 0min in sustained swimming group and was the highest at 60 min in intermittent swimming group after training.The expression of PKC in sustained swimming group were obviously higher at 0min,30 min,60 min(P<0.01)and obviously lower at 240 min(P<0.01)than intermittent one after training.Conclusions:After swimming training,the expression of PKC increased in stress in hippocampus.The expression of PKC was different between two type exercises which possibly depended on the intensity and endurance of exercise.
hippocampus;P KC;swimming exercise;rats
G804.7
A
1000-677X(2011)03-0063-05
2011-01-21;
2011-02-25
国家自然科学基金资助项目(30671019);山东省自然科学基金资助项目(Y2008c29)。
张瑞萍 (1976-),女,山东人,讲师,硕士,研究方向为运动医学,Tel:(0535)6901780,E-mail:Zrp076@163.com。
1.YanTai University,Yantai 264005,China;2.Naval Aeronautical and Astronautical University,Yantai 264001,China.
