一氧化氮在一次高负荷运动诱导大鼠腓肠肌线粒体生物合成的转录调控作用
2011-09-28陈英杰赵广高
陈英杰,赵广高
一氧化氮在一次高负荷运动诱导大鼠腓肠肌线粒体生物合成的转录调控作用
陈英杰1,赵广高2
1 前言
研究发现,一氧化氮(Nitric Oxide,NO)是一种兼有第2信使物质和神经介质功能的新型生物信使,对机体病理和生理功能起着十分重要的生物学作用[1]。NO对骨骼肌收缩的调控是通过多条信号转导途径完成的,在野生鼠的多种细胞系中,3个月或是12个月的限制进食可以诱发eNOS的表达和3’,5’-cGMP的生成[7];培养的细胞在经过 4~6天100 μM的NO供体SNAP处理后,组织中NO含量增加,而且是通过cGMP这个信号通路[26]。同时,一氧化氮供体还可降低离体骨骼肌肌质网的Ca2+释放,从而抑制骨骼肌收缩[4]。研究表明,在骨骼肌中也存在着NO-NOS-cGMP转导通路,由于NO的3种亚型在不同肌纤维中的分布不同,而不同强度的运动对不同类型的肌纤维动用也是不一样。线粒体生物合成是指在一个细胞的生命周期中线粒体的增殖,是一个由核和线粒体基因共同参与调控的线粒体系统合成和个体合成的过程[9],各种不同的生理刺激都会激发线粒体的合成和分解。比如,暴露在冷环境、运动和限制进食等生理刺激都可能诱发线粒体合成发生改变[7,8],研究表明,耐力训练能够提高骨骼肌的呼吸能力,增加线粒体呼吸链内容物,提高ATP合成酶和代谢所需酶系的含量,为骨骼肌肌的线粒体生物合成提供了强有力的刺激[5]。本研究旨在观察一次高负荷运动是否可以促进腓肠肌产生NO以及NO在一次性运动诱导的腓肠肌线粒体生物合成中信号转导作用如何,并试图探究其可能的分子机制。
作者单位:1.阜阳师范学院体育学院,安徽阜阳236037;2.南昌大学体育系,江西南昌330031
2 实验材料与研究方法
2.1 实验动物与分组
雄性SD大鼠56只,平均体重为303±16.37 g,由北医三院实验动物中心提供,在本实验室分笼饲养,自由饮食。饲养环境为20℃~25℃,光照12 h/天。实验将56只 SD大鼠分为安静对照组(C)、运动后即刻(E0)、运动后3 h(E3)、6 h(E6)、12 h(E12)、18 h(E18)和 24 h(E24)组 ,共计 7 个组 ,每组均为8只,组间体重无显著性差异。
2.2 动物运动方式
实验前,所有动物均未进行过跑台运动。正式训练前,动物先在跑台上进行3天0°,8.2 m/min,10 min/天跑步以适应跑台,再分批进行一次性高负荷跑台运动。跑台为中国产6跑道小动物跑台。采用Bedford据大鼠体重/摄氧量回归方程所建立的递增运动负荷训练大鼠模型[3]。按以下运动程序运动至90 min:第1级负荷:0°,8.2 m/min,15 min(相当于53%˙VO2max);第2级负荷:5°,15 m/min,15 min(相当于64%˙VO2max);第3级负荷:10°,19.3 m/min(相当于76%˙VO2max)运动至90 min。大鼠在运动过程中,经驱赶不能再坚持运动时,使其休息2 min后,继续按上述要求进行运动,如此反复运动,直到运动时间累计达到90 min,停止运动。分别选取实验动物安静时、运动后即刻、运动后3 h、6 h、12 h、18 h和 24 h,共 7个实验观察点。
2.3 动物组织的提取
所有组别的动物均以1.5%戊巴比妥钠(30 mg/kg)腹腔注射麻醉,在无任何反射反应后,迅速取出腓肠肌,液氮速冻,之后于-70℃冻存。
2.4 一氧化氮(NO)浓度的测定
使用南京建成生物工程研究所的试剂盒,所有操作均严格按照试剂盒说明书进行。NO浓度采用硝酸还原酶法测定,单位为μmol/g组织蛋白(μmol/g prot)。组织蛋白质浓度用考马斯亮蓝法测定[21]。样品前处理:取约0.1 g腓肠肌,加入900μl的生理盐水,用手动匀浆器制备成10%的匀浆,离心取上清液测定NO浓度和NOS活性。
2.5 一氧化氮合酶(NOS)活性的测定
使用南京建成生物工程研究所的试剂盒,所有操作均严格按照试剂盒说明书进行。NOS活性是通过测定单位重量组织蛋白质在单位时间内生成NO的nmol数来测定,其活性单位的定义为:每毫克组织蛋白每分钟生成1 nmol NO为一个酶活力单位,单位为U/mg组织蛋白(U/mg prot)。
2.6 环一磷酸鸟苷(cGMP)含量的测定
使用上海中医药大学核医学实验室的试剂盒,所有操作均严格按照试剂盒说明书讲行。cGMP含量采用放射免疫法测定,单位为pmol/ml组织蛋白。
2.7 RT-PCR测定线粒体生物合成相关基因的测定
采用RT-PCR法测线粒体生物合成相关基因表达:
1.Trizol Reagent抽提总RNA;
2.测定总RNA纯度和完整性:将3μlRNA于0.8%的琼脂糖上进行电泳,经凝胶成像仪分析,如28 s、18 s、5 s 3条带清晰可见,RNA可用于逆转录。同时,在紫外分光光度计上测260/280值,计算 RNA含量,在比值大于等于1.70时,RNA可用于逆转录;
3.逆转录:采用Revert Aid First Stand cDNA Synthesis kit进行逆转录反应,所有操作均严格按照逆转录试剂盒说明书讲行;
4.PCR反应:1)引物序列及产物长度(表1);2)荧光定量RT-PCR反应体系组成:按照SYBR○RPremix Ex Taq TM Kit(TaKaRa)说明书配制反应体系;3)温度循环参数:actin:预 变 性 95℃/1min;95℃/15s,55℃/15s,72℃/15s,共40cycles。eNOS:预变性 95℃/1min;95℃/15s,55℃/15s,72℃/15s,共40cycles;4)图像分析:目的基因的相对量为:Fold Change=2- Δ(ΔCT);ΔCT=CT target-CT actin;Δ(ΔCT)=ΔCT target-ΔCT control;PGC-1α:预变性 95 ℃/1min;95℃/15s,57℃/15s,72℃/15s,共40cycles。NRF-1:预变性95℃/1min;95℃/15s,58℃/15s,72℃/15s,共40cycles。Tfam:预变性 95℃/1min;95℃/15s,57℃/15s,72℃/15s,共40cycles。COXIV:预变性 95℃/1min;95℃/15s,59℃/15s,72 ℃/15s,共 40cycles。
5.图像分析:目的基因的相对量为:Fold Change=2-Δ(ΔCT);ΔCT=CT target-CT actin;Δ(ΔCT)=ΔCT target-ΔCT control。
2.8 数据处理
3 结果
3.1 一次高负荷运动后腓肠肌NO浓度、NOS活性、NOS基因表达和cGMP含量的变化结果
一次高负荷运动后,与安静对照组相比,运动后即刻(E0)腓肠肌NO浓度略有升高。在恢复期,NO浓度基本维持在同一水平;运动后即刻(E0)腓肠肌NOS活性显著增加(P<0.01),随后降低,在运动后 6 h(E6)达到峰值(P<0.01),然后下降,在运动后24 h(E24)已基本恢复到安静水平;一次性运动后即刻(E0)腓肠肌eNOS mRNA表达显著下降(P<0.01),随后逐渐回升,在运动后6 h(E6)达到峰值,然后缓慢下降。一次性运动后即刻腓肠肌cGMP含量显著升高,在运动后6 h(E6)达到峰值(表2)。

表1 PCR引物一览表Table 1 Oligonuclcotide Primers Used in the PCR Amplification
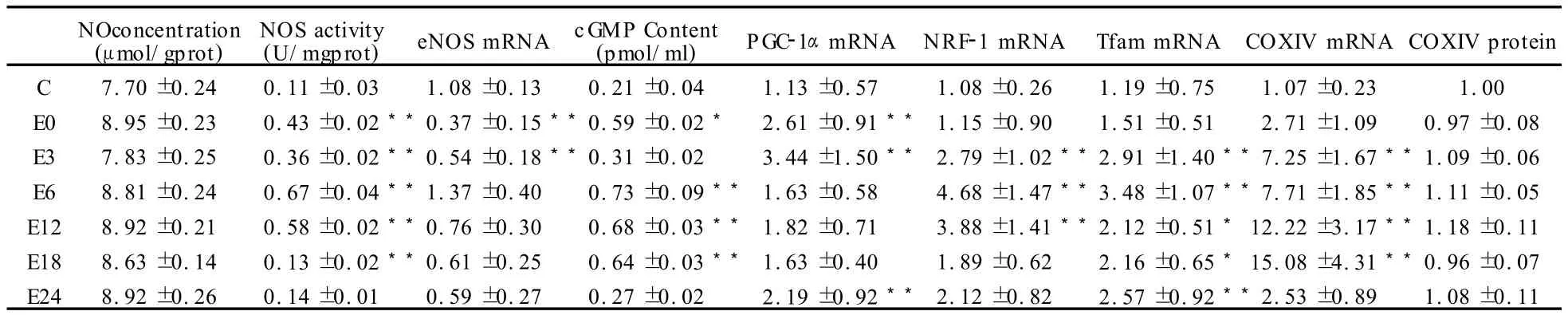
表2 一次高负荷运动后大鼠腓肠肌NO浓度、NOS活性eNOS mRNA和cGMP含量以及腓肠肌线粒体生物合成的转录因子mRNA表达、核编码的线粒体基因COXIV基因和蛋白表达的变化一览表Table 2 The Changes of G astrocnemius NO、NOS activity、eNOS mRNA 、cGMP Content、PGC-1αmRNA、NRF-1 mRNA、Tfam mRNA、COXIV mRNA and COXIV Protein after a High-intensity Exercise
3.2 一次高负荷运动后大鼠腓肠肌线粒体生物合成的转录因子mRNA表达的变化结果
一次高负荷运动后即刻(E0)大鼠腓肠肌线粒体转录因子 PGC-1αmRNA显著升高(P<0.01),随后继续升高,PGC-1αmRNA的表达在运动后3 h(E3)达到峰值(P<0.01),运动后即刻(E0)大鼠腓肠肌线粒体转录因子NRF-1 mRNA、Tfam mRNA的表达都升高,随后继续升高,NRF-1 mRNA、Tfam mRNA的表达在运动后6 h(E6)达到峰值(P<0.01),然后都缓慢下降(表2)。
3.3 一次高负荷运动后大鼠腓肠肌线粒体生物合成的核编码线粒体基因COXIV基因和蛋白表达的变化结果
一次高负荷运动后即刻(E0)大鼠腓肠肌核编码的线粒体基因COXIV mRNA表达逐步升高,在运动后12 h和18 h保持较高水平(P<0.01),然后下降;而一次高负荷运动后即刻COXIV蛋白含量略有下降,在恢复期中,COXIV含量逐步上调,在运动后12 h(E12)达到峰值,但没有显著性差异(表2)。
4 讨论与分析
4.1 一次高负荷运动后腓肠肌NO浓度、NOS活性、NOS基因表达及NO-NOS-cGMP转导通路变化的分析
NO是近些年来发现的一种重要的细胞内信使,在骨骼肌系统中可能发挥着信息传递作用。NO可由L-精氨酸经NOS的催化作用而产生,NO激活可溶性鸟苷酸环化酶(sGC),使细胞内cGMP含量增加,cGMP又作为细胞内第2信使,通过调控离子通道、调节磷酸二酯酶(PDE)的活性、激活eGMP依赖的蛋白激酶(GPK)和与cAMP依赖的蛋白激酶(PKA)的交互作用,而引发细胞一系列的级联反应,发挥信息传递作用[2]。运动训练对NOS的影响随运动强度和时间的不同而不同。短时间运动后即可激活内皮细胞与骨骼肌的NOS活性,增加NO的生成;而持久锻炼则能使NOS mRNA的表达上调,提高NOS的数量,从而增强内皮细胞和骨骼肌产生NO的能力。John等认为,运动引起NO升高的原因可能是由于运动训练使NOS mRNA表达上调,NO生成增加[25]。Shen和Sessa分别对狗进行研究发现,长期运动训练使NOS基因表达上调[17]。长期高强度训练后恢复期骨骼肌内iNOS活性增高[1]。Robers等[18]发现,大鼠在45min跑台运动后即刻NOS活性提高了37%,可能是由于运动中细胞内Ca2+依赖性的cNOS(结构型NOS)所致。有实验表明,一次性运动后即刻腓肠肌NOS活性显著提高,同时,伴随肌糖原浓度的下调,经过L-NAME(NO抑制剂)处理后,
运动后即刻NOS活性则显著降低[19]。然而,关于运动后机体NO含量和NOS活性的变化,目前研究结果不尽相同,多数研究支持运动后机体NO含量和NOS活性明显升高。本实验发现,大鼠运动后即刻,骨骼肌NO浓度有所升高,NOS活性显著提高,而eNOS mRNA的表达却显著下调。这与以往的研究结论基本相似。同样有实验发现,以运动强度为78%˙VO2max运动的大鼠,力竭即刻其心肌cNOS mRNA和蛋白水平下调[14],但其原因尚不明确。本实验观察到,骨骼肌NO浓度没有明显的变化;NOS活性在运动后6 h达到峰值,随后下降,24 h时已基本回落到安静水平;eNOS mRNA表达量也在运动后6h达到最高,随后降低。这说明,一次高强度运动激活骨骼肌NOS活性和NOS mRNA的表达,而且是一过性的表达上调,从而增加了骨骼肌内NO的水平。我们认为,一次高负荷运动可以调控骨骼肌eNOS表达。
NO对骨骼肌收缩的调控是通过多条信号转导途径完成的,在心肌和平滑肌中,NO的作用主要是通过作为“第二信使”的cGMP来介导的。在骨骼肌中也存在着 NO-NOS-cGMP转导通路,其通路如图1所示[20]。NO供体可以使cGMP浓度升高,阻断 NOS则可降低cGMP含量。至于NO-NOS-cGMP信号转导途径作用的靶目标至今尚未确定。
本实验结果可以看出,一次高负荷运动显著提高了腓肠肌中cGMP含量,其中,运动后6h达到最高值,运动后24 h才恢复接近安静对照值。由此说明,运动促进了大鼠腓肠肌cGMP的产生。一次高负荷跑台运动后,腓肠肌NOS活性和eNOS mRNA表达在运动后6 h出现峰值,腓肠肌cGMP含量也在运动后 6h其含量最高。从整体上讲,腓肠肌cGMP的变化规律与腓肠肌NOS活性和eNOS mRNA表达的变化基本一致,证实可能存在腓肠肌中NO-NOS-cGMP通路激活参与调控NO体系。
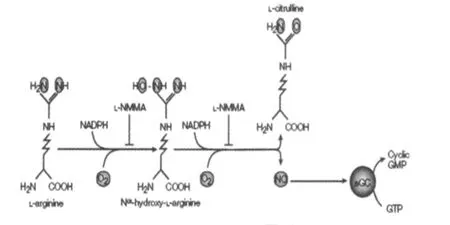
图1 NO-NOS-cGMP信号转导通路示意图Figure 1. NO-NOS-cGMP Signalling Pathw ays
4.2 一次高负荷运动后腓肠肌线粒体生物合成相关基因表达和蛋白含量变化分析
线粒体是细胞能量代谢的主要场所,产生大量的ATP满足正常生理功能的需要。线粒体已不再被认为是静止的细胞器,而是在细胞中时刻运动的,不断发生着融合和分裂[15]。线粒体生物合成是指在一个细胞的生命周期中线粒体的增殖,以及线粒体的系统合成和个体合成的过程,是一个由核和线粒体基因共同参与调控的过程。由核基因编码的线粒体生物合成相关的转录因子主要有:PGC-1α、NRF-1、NRF-2、Tfam等。在这些调控因子中,PGC-1α(过氧化物酶增殖激活受体γ-辅助激活因子-1α)是至关重要的一个。PGC-1α可以促进NRF-1(核呼吸因子1)和 NRF-2(核呼吸因子2)的表达,激发参与mtDNA转录和复制的核编码的基因表达[22]。实验证实,PGC-1α高表达后细胞内线粒体数量增加,并伴随核基因 NRF-1、NRF-2、Tfam、UCP-2及线粒体基因COX亚基的高表达[27]。

图2 线粒体转录因子调控示意图Figure 1. The Mitochondrial Transcription Factors Control Schemes
目前的研究普遍公认,PGC-1α通过刺激 NRF-1和NRF-2,然后激活 Tfam,Tfam表达后被运输到线粒体内,与其启动子位点相结合,增加线粒体编码的基因表达,通过以上途径激活核和线粒体内表达线粒体蛋白的基因,从而促进线粒体的生物合成(图1)[6]。
一次性运动或电刺激均可以诱发骨骼肌中PGC-1αmRNA和蛋白的表达上调[10-12,24]。一次运动后18h,骨骼肌PGC-1αmRNA和蛋白的表达量上升大约2倍,NRF-1和NRF-2的表达也显著上调[13]。Pilegaard等人的研究发现,运动后恢复期,人骨骼肌中由运动诱导出的 PGC-1α的转录水平明显提高[16]。本实验结果显示,大鼠经过一次大强度的跑台运动,运动后即刻腓肠肌中PGC-1αmRNA表达显著升高,NRF-1、Tfam和COXIV mRNA的表达也有升高的趋势,而腓肠肌COXIV蛋白含量略有下调的趋势。在恢复期,这些转录因子的基因表达会继续上调,PGC-1α的表达在运动后3h达到峰值,NRF-1和 Tfam的表达分别在运动后6h达到最高,COXIV的表达在运动后18h达到峰值。这些结果与大部分文献报道基本相符。Takayuki的实验发现一次跑台运动后3h,小鼠腓肠肌PGC-1αmRNA含量会有一过性的显著上调[23]。从实验结果看,我们认为转录因子出现峰值存在着前后顺序,而且运动可以诱导它们一过性的表达上调,进一步验证了线粒体生物合成的转录调控途径,即PGC-1α首先会刺激NRF-1和NRF-2,然后激活 Tfam,Tfam表达后被运输到线粒体内,与其启动子位点结合,发挥作用。
运动促进NRF-1与Cyt-c、NRF-2与COXIV启动子的结合,以及Cytc、ALAS和柠檬酸合成酶mRNA表达的上调要先于PGC-1α的表达,而半衰期较短的线粒体蛋白的表达上调可能会与 PGC-1α蛋白的上调同步[12]。我们实验发现运动后3h腓肠肌 PGC-1αmRNA表达最高,而其蛋白含量在运动后12h达到峰值。基因的表达与蛋白含量之间不同步,蛋白的变化要滞后于 mRNA的变化。然而,腓肠肌NRF-1和Tfam的mRNA表达在运动后3h就开始显著上调,6h时达到峰值。这间接提示,诱导腓肠肌 NRF-1和Tfam表达的不一定是 PGC-1αmRNA的上调,而可能是PGC-1α活性的增加先于mRNA作用于后续的线粒体转录因子,但这一推论尚不确定。
5 结论
1.一次高负荷运动会一过性地上调骨骼肌NOS活性和NOS mRNA的表达,进而增加骨骼肌内NO的水平,可能存在腓肠肌中 NO-NOS-cGMP通路激活参与调控 NO体系。
2.一次高负荷运动会促进腓肠肌线粒体转录因子PGC-1α、NRF-1和 Tfam的mRNA表达,以及由核编码的线粒体蛋白COXIV的mRNA和蛋白的水平也出现一过性的上调。
3.NO通过sGC-cGMP依赖信号途径激活一次高负荷运动腓肠肌线粒体PGC-1α,进而激发线粒体生物合成。
[1]党晓云,张建,梁芝栋.NO及其生成调节与运动[J],河南师范大学学报(自然科学版),2009,37(2):132-134.
[2]范宏刚,卢德章,胡魁,等.替来他明对大鼠不同脑区NO-cGMP信号转导系统的影响[J].中国兽医科学,2008,(10):904-908.
[3]史绍蓉,王娟.α-心肌肌球蛋白重链与原肌球蛋白-1在不同负荷运动中的差异表达研究[J].北京体育大学学报,2009,32(10):51-54.
[4]钟慈声,孙安阳.一氧化氮的生物医学[M].上海:上海医科大学出版社,1997:3-39.
[5]BOOTH FW,THOMASON DB.Molecular and cellular adaptation of muscle in response to exercise:perspectives of various models[J].Pysiol Rev,1991,71:541-585.
[6]DANIEL PK,RICHARD CS.Transcriptional regulatory circuits controlling mitochondrial biogenesis and function[J].Gene&Development,2004,(18):357-368.
[7]ENZO N,CRISTINA T,Annalisa C,et al.Calorie restriction promotes mitochondrial biogenesis by inducing the expression of eNOS[J].Science,2005,310:314-317.
[8]ENZO N,EMILIO C,CLARA P,et al.Mitochondrial biogenisis in mammals:The role of endogenous nitric oxide[J].Science,2003,299:896-899.
[9]GARESSE R,VALLEJO C G.Animal mitochondrial biogenesis and function:A regulatory cross-talk between two genomes[J].Gene,2001,263(1-2):1-16.
[10]GOTO M,TERADA S,KATO M,et al.cDNA cloning and mRNA analysis of PGC-1 in epitrochlearis muscle in swimming-exercised rats[J].Biochem Biophys Res Commun,2000,274:350-354.
[11]HENRIETTE P,BENGT S P,DARRELL N.Exercise induces transient transcriptional activation of the PGC-1αgene in human skeletal muscle[J].J Physiol,2003,546:851-858.
[12]ISABELLA I,PETER JA,TREACEY S,et al.PPARγcoactivator-1αexpression during thyoid hormone and contractile activity-induced mitochondrial adaptations[J].Am JPhysiol,2003,284:C1669-C1677.
[13]KEITH B,ADAM RW,TERRY EJ,et al.Adaptation of skeletal muscle to exercise:rapid increase in the transcriptional coactivator PGC-1[J].FASEB,2002,16:1879-1885.
[14]MOTOYU KI E,TAKASHI M,SEIJ I M,et al.Intense exercise causes decreases in expression of both endothelial NO synthase and tissue Nox level in hearts[J].Am J Physiol Regulatory Integrative Comp Physiol,2000,279(3):R951-R959.
[15]NEUPERT W.Protein import into mitochondria[J].Annu.Rev.Biochem,1997,66:863-917.
[16]PILEGAARD H,SAL TIN B,NEUFER P D.Exercise induces transient transcriptional activation of the PGC-1alpha gene in human skeletal muscle[J].J Physiol,2003,546:851-858.
[17]PRINCE R G,GUNSON D E.Rising interest in nitric oxide synthase[J].TIPS,1993,18(2):35-36.
[18]ROBERS C K,JANA R,PER A,et al.Differential expression of nitric oxide synases(NOS 1-3)in rats skeletal muscle following exercise[J].FASEB J,2004,10:1096-1099.
[19]ROBERS C K,BAMARD R J,JASMAN A,et al.Acute exercise increases nitric oxide synthase activity in skeletal muscle[J].Am J Physiol,1999,277:E390-E394.
[20]SALVADOR M,JORGED E.Does nitric oxide modulate mitochondrial energy generation and apoptosis[J].Nature,2002,(3):214-220.
[21]SAMBROOKJ,FRITSCH EF.分子克隆实验指南(第2版)[M].金冬雁,黎孟枫等译.北京:科学出版社,1995.
[22]SCAPULLA R C.Nuclear activators and coactivators in mammalian mitochondrial biogenesis[J].Biochem Biophys Acta,2002,1576:1-14.
[23]TAKAJ YU KI A,STEVEN T C P,PING L,et al.Exercise stimulates PGC-1αtranscription in skeletal muscle through activation of the p38MAPKpathway[J].J Biol Chem,2005,280:19587-19593.
[24]TERADA S,GOTO M,KATO M,et al.Effects of low-intensity prolonged exercise on PGC-1 mRNA expression in rat epitrochlearis muscle[J].Biochem Biophys Res Commun,2002,296(2):350-354.
[25]XU DL,MARTIN PY,JOHN ST,et al.Upregulation of endothelial and neuronal constitutive nitric oxide synthase in pregnant rats[J].AmJ Physiol Regulatory Integrative Comp Physiol,1996,271:1739.
[26]WANG S,YAN L,WESLEY R A,et al.Nitric oxide increases tumor necrosis factor production in differntiated U937 cells by decreasing cyclic AMP[J].J Biol Chem,1997,272:5959-5965.
[27]WU Z,PUIGSERVER P,ANDENSSON U,et al.Mechansms controlling mitochondrial biogenesis and respiration through the thermogenic coactivator PGC-1[J].Cell,1999,98:115-124.
NO Effects of Transcriptional the Regulation of Rat G astrocnemius Mitochondria Biosynthesis after a High-load Exercise
CHEN Ying-jie1,ZHAO Guang-gao2
目的:观察一次高负荷运动后NO介导腓肠肌线粒体生物合成的转录调控作用。方法:6周龄雄性SD大鼠56只,随机分成:安静对照组(C)、运动后即刻组(E0)、运动后3 h组(E3)、6 h组(E6)、12 h组(E12)、18 h组(E18)和 24 h组(E24);硝酸还原酶法测腓肠肌NO浓度和 NOS活性,放射性免疫法测 cGMP含量;RT-PCR测eNOS、PGC-1α、NRF-1、Tfam和COXIV基因;Western-blotting测COXIV蛋白。结果:E0组腓肠肌NO浓度、cGMP含量升高,NOS活性增加,eNOS mRNA下降;E6组NOS活性、eNOS mRNA和cGMP含量都达到峰值。E0组腓肠肌NRF-1mRNA、Tfam mRNA、PGC-1α和 COXIV mRNA升高。结论:一次高负荷运动可能通过NO-NOS-cGMP通路激活、调控NO体系,进而激活 sGC-cGMP依赖信号途径,激发线粒体生物合成。
高负荷运动;腓肠肌;一氧化氮;环一磷酸鸟苷;线粒体;生物合成;鼠;动物实验
Objective:To observe the variation of gastrocnemius muscle NO-NOS-Cgmp pathway and NO effects the gastrocnemius muscle transcriptional regulation of mitochondrial biogenesis after a high-load exercise.Methods:56 male SD rats(6-week-old)randomly divided into quiet control group(C),0-hour after treadmill exercise group(E0),3 h(E3),6 h(E6),12 h(E12),18 h(E18)and 24 h(E24)group.Determinate gastrocnemius muscle NO concentration and NOS activity through the method of nitrate reductase,determinate gastrocnemius muscle cGMP content through the method of radioimmunoassay;determinate gastrocnemius muscle eNOS mRNA,PGC-1αmRNA,NRF-1 Mrna,Tfam mRNA and COXIV mRNA expression through the method of RT-PCR;determinate gastrocnemius muscle COXIV protein content by Western-Blotting method.Results:E0 group gastrocnemius muscle NO concentration,cGMP content and NOS activity was increased,eNOS mRNA was decreased,E6 group NOS activity,eNOS mRNA and cGMP content all reached the peak.E0 group gastrocnemius muscle NRF-1mRNA,Tfam mRNA,PGC-1αmRNA and COXIVmRNA was increased.Conclusion:A highload exercise can regulate gastrocnemius muscle NO system with its NO-NOS-cGMP pathway,and NO activate sGC-cGMP signaling pathway,thus inspire mitochondrial biogenesis.
high-load exercise;gastrocnemius;NO;cGM P;mitochondria;biosynthesis
G804.7
A
1000-677X(2011)03-0058-05
2010-10-08;
2011-02-15
陈英杰(1972-),男,江苏连云港人,副教授,硕士,主要研究方向为运动人体科学,Tel:(0558)2591812,E-mail:fysfxycyj@sina.com;赵广高(1982-),男,河南周口人,助教,硕士,主要研究方向为运动人体科学,Tel:(0791)6990921,E-mail:haogg2002@163.com。
Fuyang Teacher College,Fuyan 236037,China;Nanchang University,Nanchang 330031,China.
