乳酸对外周血吞噬细胞呼吸爆发与吞噬功能影响的离体实验研究
2011-09-28董静梅陈佩杰于动震张亚军肖卫华
董静梅,陈佩杰,王 茹,于动震,张亚军,肖卫华
乳酸对外周血吞噬细胞呼吸爆发与吞噬功能影响的离体实验研究
董静梅1,2,陈佩杰1,王 茹1,于动震1,张亚军1,肖卫华1
运动作为一种应激可引起体内内环境的变化,包括温度,酸度、氧分压、电解质及其激素水平的变化,而内环境的变化必然会导致机体产生一系列级联反应,进而影响到机体的一系列生理功能的改变,如机体免疫功能的变化,有大量的研究报道表明,运动可引起吞噬细胞呼吸爆发与吞噬功能的改变[7,11,13]。这些研究往往基于某些运动项目的特异性和处于对机体不损伤的保护性考虑,难以对引起该功能变化的直接原因做出准确直接地判断和测定,其研究通常设计不同的运动类型训练模型,通过训练前后某种功能的改变和相应指标的变化来确定某种运动项目对免疫功能的影响,而就其运动对免疫功能改变的直接原因和机理难以做出判断,针对此问题,本实验针对运动可导致机体内环境乳酸堆积引起的胞外酸性环境的变化,设计乳酸处理来改变离体外周血酸度并进行全血孵育,利用流式仪和德国临床吞噬功能测定试剂盒,准确快速地测定外周血中性粒细胞(Polymorphonuclear neutrophil;PMN)和单核细胞的呼吸爆发和吞噬功能,利用免疫细胞化学与共聚焦技术的合并使用,进行NADPH氧化酶关键亚基的蛋白定位,探讨运动引起吞噬细胞功能改变的内环境改变的直接因素,为运动诱导免疫功能改变的研究提供一定的理论。
1 材料和方法
1.1 主要试剂与仪器
试剂:二联苯碘(Diphenylene iodonium,DPI)、乳酸(DL-Lacticacid,La)、二甲亚砜(Dimethyl Sulfoxide,DMSO)、DAPI染色液、胎牛血清 、RPMI-1640培养基均购自美国 SIGMA公司;氮蓝四唑(NBT)、台盼蓝染液(rypan Blue Stain)购自美国 GIBCO公司;多型核细胞分离液(PolymorphprepTM)购自挪威 AXIS-SHIELD公司。抗体:gp91-phox(H-60)、P47-phox(c-20)购自美国 Sant cruz公司;CYTM5 Confugate山羊抗兔、FITC兔抗山羊(H+L)购自美国ZYMED公司。
试剂盒:呼吸爆发试剂盒(Burst-test kit)、吞噬功能试剂盒(Phago-test kit)均购自德国 Glycotope Biotechnology公司。
仪器:流式细胞仪(美国BeckmanCoulter公司)、便携式运动血乳酸盐仪(美国金泉 YSI公司)、荧光显微镜(日本Olympus公司)、激光共聚焦显微镜(LSCM,德国蔡司公司)、酶标仪(美国伯乐公司)。
1.2 方法
1.2.1 乳酸的体积的量与血乳酸值回归方程的建立
取20名健康男性青年志愿者(年龄19~23岁)外周静脉血10 ml(肝素抗凝),分成均等的10组(每组1 ml),每组加入1 M乳酸(表1)混匀,取5μl与乳酸盐仪测定其乳酸值,并建立加入体积的量与血液乳酸测定值的回归方程,需要说明的是,在预备试验中进行了所用乳酸浓度梯度试验,观察不同浓度的乳酸对中性粒细胞的呼吸爆发和吞噬功能的适应试验浓度区间。
1.2.2 实验分组
回归方程建立后,另取10名健康男性青年志愿者(年龄19~23岁)外周静脉血 20ml(肝素抗凝)分 2组(Ctr组、E组),各组再均分10小组(每小组取1 ml全血分为 C0、C1、C2…C9及 E0、E2、E3…E9)。其中 E组按表1的量加入浓度为1 M乳酸,同时给Ctr组中每小组在加入同 E组等量的乳酸时再加入终浓度为2μMDPI(DPI浓度参考 Helmy[8])作为对照组后,2组同时在37℃水浴箱中孵育10 min后,分别去100μl全血用流式细胞仪测定呼吸爆发和吞噬功能的测定,剩余部分血液用于分离中性粒细胞的分离。
1.2.3 呼吸爆发与吞噬功能的测定
各取100μl全血于专用流式管中,分别按呼吸爆发与吞噬测定试剂盒各步骤加入刺激剂和裂解红细胞制备样液,由于萃取时间和温度对结果影响,所以,要特别注意各步骤时间和温度的精准度。激发波长488 nm,每样取50 000个中性粒细胞进行检测,利用荧光强度来表示呼吸爆发与吞噬功能的变化,全血流式测定方法参考Lyapina M(2004)[12]。
1.2.4 中性粒细胞的分离
按多型核细胞分离液说明取分离液1 ml与离心管中,将血液小心铺与分离液液面上后离心(450 g,35 min,18℃~22℃),取中性粒细胞后用0.45%NaCl低渗液洗2次,用 PBS洗1次后加入0.4%胎盼蓝染色计数,调细胞浓度为1×106个/L,活细胞数不低于96%后悬浮于预冷的适量RPMI-1640培养液中备用。
1.2.5 NADPH氧化酶活性的测定
每组取5×106个细胞悬浮于 NBT溶液中(4 mg/ml),37℃水浴锅中保湿孵育 20 min,加入 1 M HCl终止反应 ,离心(2 500 rpm、5 min、18℃~22℃)后加入400μl的DMSO稳定形成三苯基甲酯,移入酶标板在560 nm处测定吸光度(OD),OD值越大表明NADPH氧化酶活性越高。
作者单位:1.上海体育学院,上海200438;2.兰州城市学院体育学院,甘肃 兰州 730070
表1 各小组分组标号与加入乳酸的体积量一览表Table 1 The Volume of LA in Different G roup (μl)
1.2.6 激光共聚焦对NADPH氧化酶亚基p47-phox的定位
取分离好的中性粒细胞200μl(细胞浓度1×104个/L)加入1%的多聚甲醛溶液固定细胞30 min,之后用 TritonX-100和胎羊血清改变细胞通透性,再依次封闭,加一抗,二抗。最后爬片,在激光共聚焦显微镜观察染色定位结果,其中共聚焦显微镜物镜放大倍数为×200。激发波长488 nm,发散波长510 nm。
1.3 统计方法
2 结果
2.1 加入不同体积的乳酸测得的血乳酸的值及回归方程
根据表1测得的乳酸值可得出在1 ml外周血中加入的乳酸的体积的量与血乳酸值回归方程为:Y=0.0652X+3.5528(R2=0.9904)。
2.2 吞噬细胞的呼吸爆发和吞噬功能
2.2.1 吞噬细胞呼吸爆发与吞噬功能的流式细胞测定
按试剂盒制备流式细胞检测样品,每样锁定5 000白细胞进行检测,利用荧光强度来表示呼吸爆发与吞噬功能的变化,其流式图见图1。

表2 各小组加入乳酸的体积量对应测定的乳酸值一览表Table 2 The Volume of LA and Value of LA in Different G roup
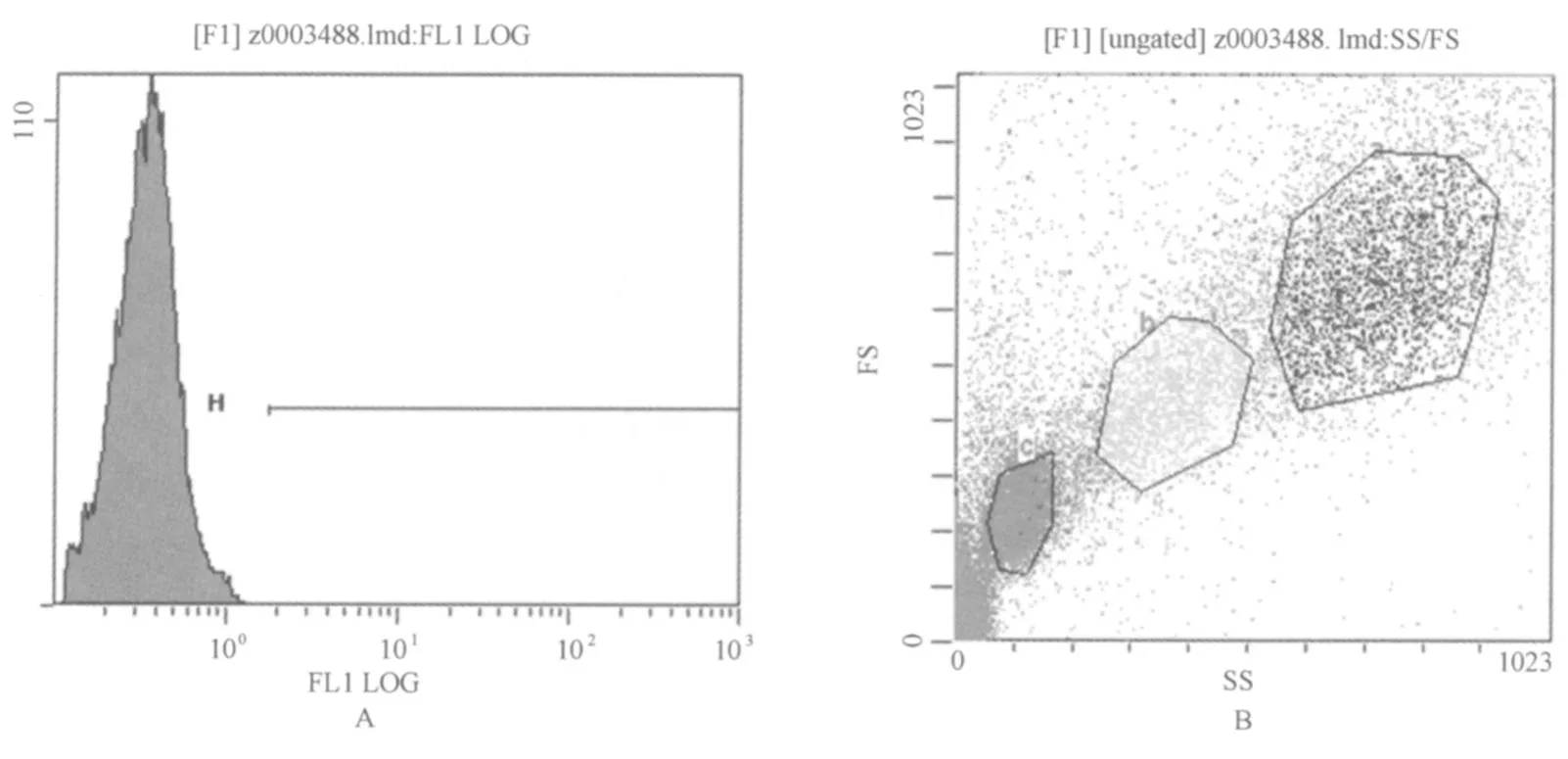
图1 流式细胞仪测定吞噬细胞的荧光强度示图与细胞选取示意图Figure 1 The Fluorescence Intensity and Cell in Flow Cytoneter
2.2.2 流式细胞仪测试不同酸度梯度对全血中中性粒细胞的呼吸爆发与吞噬功能的变化
图2表示,在每小组加入不同的酸度梯度时,全血中中性粒细胞爆发功能在最初的几个浓度梯度略有降低,根据前期的回归关系,可以对应的计算出在血液中乳酸浓度低于4.81 mmol/L时,而后则随着乳酸浓度梯度的增加,中性粒细胞的呼吸爆发功能则明显升高,但当血乳酸浓度达到8.14 mmol/L时,呼吸爆发功能却明显下降,出现急剧下降的拐点。
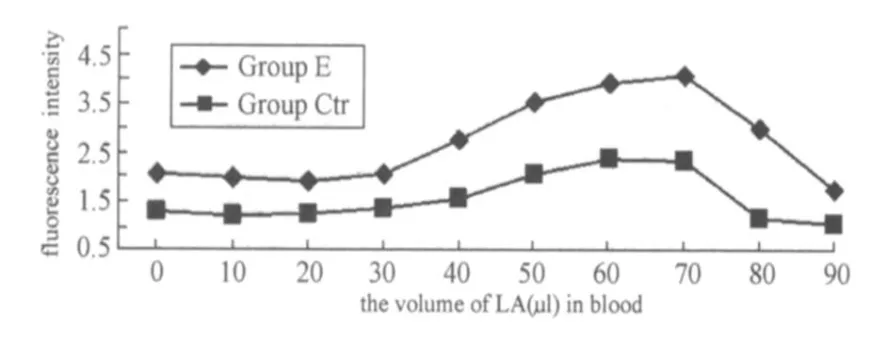
图2 不同浓度的乳酸梯度下对照组与实验组中性粒细胞呼吸爆发的变化曲线图Figure 2 The Change of Respiattory Burst of Neutrophil with Different LA and the Inhibition of DPI in Whole Blood
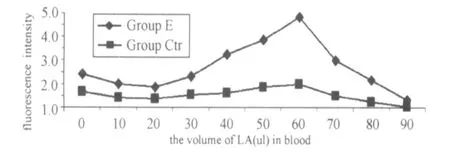
图3 不同浓度的乳酸梯度下对照组与实验组中性粒细胞吞噬功能的变化曲线图Figure 3 The Change of Phagocytosis Function of Neutrophil with Defferent LA and the Inhibiion of DPI in Whole Blood
图3表示,在不同的浓度梯度时全血中性粒细胞的吞噬功能,可以发现中性粒细胞的吞噬功能与呼吸爆发功能的变化趋势呈大致相似的变化,但其急剧下降的拐点的乳酸浓度要低于呼吸爆发的拐点7.69 mmol/L。图2、图3的对照组的呼吸爆发和吞噬功能虽有所变化,但与 E组相比,都低于同浓度乳酸的 E组的变化。
2.3 不同酸度梯度的乳酸处理对外周血单核细胞的呼吸爆发与吞噬功能的影响
图4、图5表明,不同梯度的乳酸浓度对全血单核细胞的呼吸爆发和呼吸功能与中性粒细胞的影响基本相似,即低浓度的乳酸抑制了单核细胞的呼吸爆发与吞噬功能的爆发,之后随着乳酸浓度的增加,其呼吸爆发和吞噬功能相应增加,但其呼吸爆发和吞噬功能分别在8.14 mmol/L、7.69 mmol/L时出现急剧下降的趋势。同时与 E组相比,对照组的单核细胞呼吸爆发和吞噬功能虽有所变化,但低于同浓度乳酸的E组的变化。

图4 不同乳酸浓度梯度下对照组与实验组单核细胞呼吸爆发的变化曲线图Figure 4 The Change of Respiratory Burst of Monocyte with Different LA and the Inhibition of DPI in Whole Blood
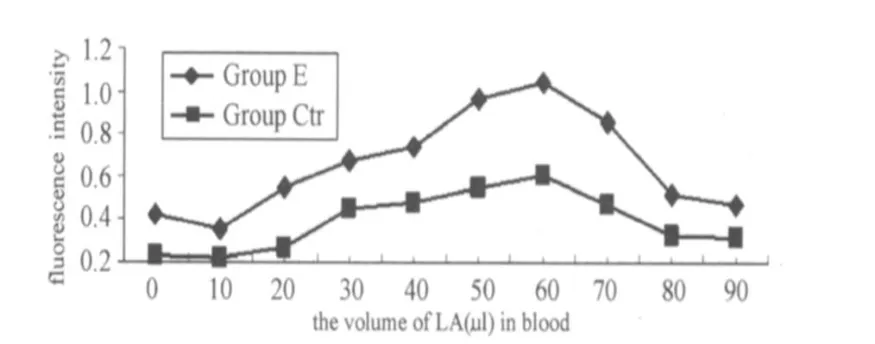
图5 不同乳酸浓度梯度下对照组与实验组单核细胞吞噬功能的变化曲线图Figure 5 The Change of Phagocytosis Function of Monocyte with Different LA and the Inhibition of DPI in Whole Blood
2.4 酸度变化对中性粒细胞中NADPH氧化酶活性的测定
根据NADPH氧化酶活性测定方法,通过分离提纯的中性粒细胞内NADPH氧化酶,采用分光光度法测得吸光度(OD)值如图6,OD值越高说明其NADPH氧化酶的活性越高。其NADPH氧化酶活性的变化也和中性粒细胞与单核细胞的呼吸爆发与吞噬功能的变化趋势吻合。
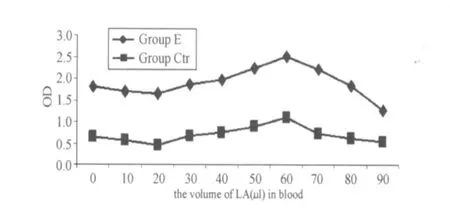
图6 不同乳酸浓度梯度下对照组与实验组NADPH氧化酶活性的变化曲线图Figure 6 The Value of OD for NADPH Oxidase in Neutrophil from Blood with the Different LA
2.5 吞噬细胞的呼吸爆发与NADPH氧化酶活性的相关性测定
从图2、图4的中性粒细胞与单核细胞的呼吸爆发随血乳酸浓度变化的曲线与图6反映NADPH氧化酶活性的OD值,随乳酸浓度变化的曲线不难看出其变化的相关性,为此我们做了不同乳酸浓度处理后中性粒细胞呼吸爆发的变化与NADPH氧化酶活性变化的相关性研究,图8表示不同乳酸浓度处理后单核细胞的呼吸爆发与NADPH氧化酶活性的相关性。
图7、图8分别是不同乳酸浓度处理后,中性粒细胞与单核细胞呼吸爆发功能与NADPH氧化酶活性关系的研究,其中图7、图8所示在不同浓度的乳酸处理后中性粒细胞与单核细胞呼吸爆发功能与NADPH氧化酶活性呈线性相关,其相关系数分别达到0.89和0.73。说明吞噬细胞的呼吸爆发与NADPH氧化酶活性具有一定的相关性,且中性粒细胞呼吸爆发功能与NADPH氧化酶的活性的相关程度要高于单核细胞呼吸爆发功能。
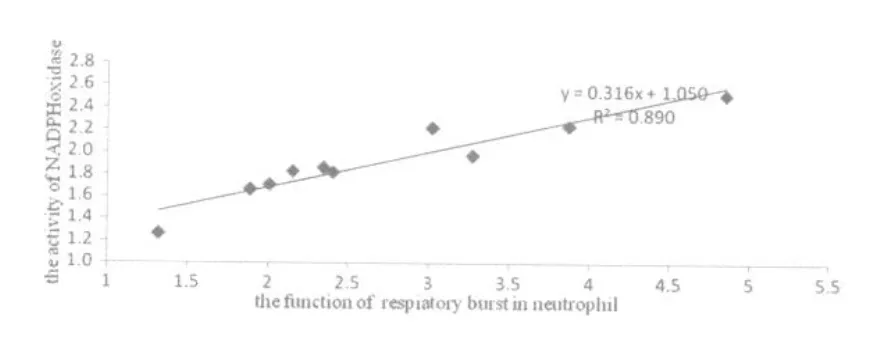
图7 不同乳酸浓度处理后中性粒细胞的呼吸爆发与NADPH氧化酶活性的相关性示意图Figure 7 The Correlation of between the Activity of NADPH Oxidase and the Function of Respiatory Burst in Neutrophil with Different LA treatment
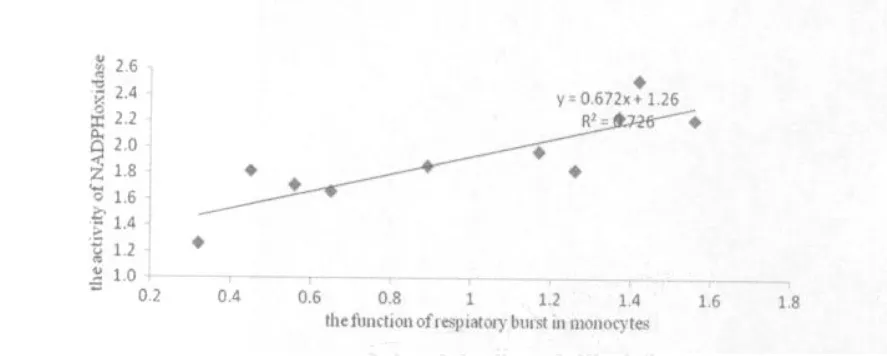
图8 不同乳酸浓度处理后单核细胞的呼吸爆发与NADPH氧化酶活性的相关性示意图Figure 8 The Crooelation of between the Activity of NADPH Oxidase and the Function of Respiatory Burst in Monocytes after Different LA Treatment
2.6 NADPH氧化酶激活的蛋白定位的细胞免疫化学的共聚焦实验
通过流式细胞仪对吞噬细胞的呼吸爆发和吞噬功能的检测和NADPH氧化酶的活性测定,我们发现不管是中性粒细胞和单核细胞,其呼吸爆发的最高点和最大NADPH氧化酶活性点的乳酸处理浓度相同,即同在血乳酸浓度为7.69 mmol/L时NADPH氧化酶活性与呼吸爆发功能上调至最高点,于是,我们在此浓度对2组的外周血孵育30 min后分别分离中性粒细胞,利用免疫细胞化学方法分别对中性粒细胞核染色和NADPH氧化酶关键亚基gp91phox与p47phox荧光染色的共定位,图9为对照组,图10为乳酸处理组,其中,A图为DAPI染色的蓝色细胞核显色、B图胞浆中p47phox绿色显色、C图为胞膜中的gp91phox红色显色、D图为融合后为gp91phox与p47phox蛋白共定位显色。从乳酸处理后的图10的D图中可以看出,出现了gp91phox与p47phox蛋白共定位黄色显色。而图9的D图中未出现gp91phox与p47phox蛋白共定位黄色显色。

图9 对照组中性粒细胞NADPH氧化酶关键亚基gp91-phox与p47-phox未定位示图(×200)
3 分析与讨论
3.1 外周血吞噬细胞的吞噬作用与NADPH氧化酶的活性调控
外周血中由中性粒细胞与单核细胞组成的吞噬细胞是机体重要的天然免疫细胞,其杀灭入侵病原微生物的方式是通过NADPH氧化酶介导“氧化爆发”产生大量活性氧(ROS,reactive oxygen species)而构成机体抵抗病原体的第一道防线,此过程也被称为 PMN的呼吸爆发,并认为是吞噬细胞能够进行宿主防御的主要机制,是机体进行非特异性细胞免疫的主要途径[14]。其中的NADPH氧化酶现已证明是细胞质膜上主要的 ROS来源途径,数年后,在非吞噬细胞的质膜上发现了NADPH氧化酶的同源物家族,即gp91phox的同源物,分别称其为 NOX1,NOX2,NOX3,NOX4,NOX5,DUOX1,DUOX2,后来被命名为NOX的蛋白家族[1]。人吞噬细胞NADPH氧化酶是由质膜结合成分gp91phox,p22phox,小 GTP酶结合蛋白 Rap1A,胞浆成分p47phox,p67phox,p40phox,小GTP酶结合蛋 Rac2,Cdc42,以及最新鉴定的p29peroxiredoxin组装成的一种高度调节的多亚基氧化酶复合体。

图10 实验组中性粒细胞NADPH氧化酶关键亚基gp91phox与p47phox共定位示图(×200)
当细胞受到胞内外环境的刺激后,胞浆内的p47phox磷酸化并与p67phox和Rac1/Rac2一起移位到质膜,与细胞色素b558结合,参与NADPH氧化酶的活化。活化后的NADPH氧化酶以NADPH为递氢体,催化反应:NADPH+2O2→NADP++H++2O-2,O-2在超氧化物歧化酶(superoxide dismutase,SOD)催化下生成过氧化氢(H2O2)。在中性粒细胞的嗜天青颗粒中存在着髓过氧化物酶(MPO),在有氯化物存在的条件下,该酶可将 H2O2还原生成次氯酸 HOCL·,HOCL·是强氧化剂和杀菌因子[10]。因此,吞噬细胞的呼吸爆发主要是通过NADPH氧化酶介导产生的ROS来实施对入侵病原微生物的吞噬作用。
现已证明,多种因素可激活NADPH氧化酶亚基,引起亚基磷酸化、转位,完成复合体的组装,涉及多种蛋白的相互作用和多种激酶、磷酸酶、脂肪酶的信号通路,其中每一细小环节对于NADPH氧化酶发挥正常功能都很重要,吞噬细胞NADPH氧化酶是受调节亚基、上游调节子等多重因素的调控下活化发生呼吸爆发,实现中性粒细胞在天然免疫系统中的杀菌行为和清除外源异物的重要功能[3]。
运动作为一种应激,可引起体内环境的变化,在运动应激状态下如胞外低氧、高温、高糖,胞质中高 H2O2和炎症性细胞因子白介素-1(IL-1)、和白介素-6(IL-6)和肿瘤坏死因子(TNF-a)都可能成为激活NADPH氧化酶产生ROS的激发因子,其中,胞质缺氧和乳酸堆积引起的酸性环境是运动训练尤其是过度运动时由于乳酸的生成最可能形成的细胞外环境[5],因此,本实验设计以乳酸引起血液的酸度变化,离体研究不同酸度对吞噬细胞呼吸爆发与吞噬功能的影响。
3.2 乳酸引起的血液酸度变化对吞噬细胞呼吸爆发与吞噬功能的影响
本实验的结果表示不同浓度的乳酸处理后的吞噬细胞的呼吸爆发功能和吞噬功能均发生一定的变化,其变化的共同特点是:外周血中低浓度(低于4.81 mmol/L)的乳酸处理可抑制中性粒细胞和单核细胞的呼吸爆发与吞噬功能,较高浓度的乳酸处理后吞噬细胞的呼吸爆发和吞噬功能发生了不同步的变化,其中当乳酸浓度为4.81 mmol/L~8.41 mmol/L之间处理后吞噬细胞的呼吸爆发随着乳酸浓度的增加而提高,之后急剧下降,而吞噬功能则在乳酸浓度4.81 mmol/L~7.69 mmol/L处理后随着乳酸浓度的增加而提高,但较呼吸爆发提前一个浓度梯度而急剧下降。
3.3 外周血乳酸引起的酸度变化对中性粒细胞NADPH氧化酶激活的直接证据
NADPH氧化酶活化后胞浆亚基p47phox,p67phox和p40phox转位到质膜与Cyto b558复合体结合,本实验在血乳酸浓度为7.69 mmol/L时,NADPH氧化酶的胞浆中的亚基p47phox移位至胞膜与gp91phox实现共定位,这是激活NADPH氧化酶的直接证据[17],而NADPH氧化酶的激活可介导产生大量的ROS是中性粒细胞产生呼吸爆发的一个显著特点,中性粒细胞正是通过其呼吸爆发产生ROS来实施吞噬功能的[4]。外周血酸度的变化可引起中性粒细胞NADPH氧化酶的激活并导致其呼吸爆发与吞噬功能的改变,从而影响其吞噬功能。
3.4 不同梯度的乳酸浓度引起外周血吞噬细胞呼吸爆发与吞噬功能变化的原因分析
吞噬细胞的呼吸爆发与吞噬功能的改变在很大程度上取决于细胞外的pH的变化及NADPH氧化酶的活性,而胞外pH变化影响PMN呼吸爆发有赖于离子交换系统的激活,其中一个主要的离子交换系统是膜上的Na+/H+ATP酶。Na+/H+ATP酶是以胞外Na+与胞内 H+交换,从而将 H+泵出去使 PMN胞内维持正常的酸碱平衡。细胞外酸性环境抑制了Na+/H+的交换,使细胞内持续在酸性pH下,不利于O-2的产生[18]。同时,胞外 H+的增加不利胞浆中Ca2+的摄取,而吞噬细胞胞浆Ca2+在NADPH氧化酶的活化调控中起着关键的作用,因为参与NADPH氧化酶活性调节的许多蛋白的活化都是Ca2+依赖的,如蛋白激酶C(Protein kinase C,PKC),促分裂素原活化蛋白激酶(mitogen-activated protein kinases,MAPK)和酪氨酸激酶,Ca2+的增多能触发氧化酶亚基的磷酸化、转位和组装必需的许多信号级联反应,抑制Ca2+的释放或内流就抑制了氧化酶的活化[9]。
因此,看似胞外酸性环境抑制了吞噬细胞的呼吸爆发,但在抑制PMN产生O-2的同时,却能促进 H2O2的产生和髓过氧化酶(MPO)的释放[2]。T onetti等(1991年)[19]报道用短链羧酸孵育PMN,胞内pH下降,O-2的产生明显减少,但 H2O2的产生则明显增加。而 H2O2的产生和MPO的增加却像扣动了NADPH氧化活化的扳机,触发了吞噬细胞NADPH氧化酶的激活的锁链,H2O2激活膜细胞中NF-κB,NF-κB又能上调单核细胞趋化蛋白-1的表达,单核细胞渗出引起的炎症反应,促进炎症性细胞因子IL-1、和 IL-6和 TNF-a的释放,扩大了炎症反应,而炎症细胞因子也能激活中性粒细胞NADPH氧化酶,进而扩大产生ROS[6].
因此,胞外低浓度的乳酸可轻度抑制中性粒及单核细胞的呼吸爆发,但随着乳酸浓度的增多引起的胞外酸性环境急剧变化,使其产生过多的 H2O2和 MPO,而使 NADPH氧化酶激活链的发生,这样过多的 ROS产生必将大幅度的上调了吞噬细胞的呼吸爆发,但NADPH氧化酶介导产生的ROS对吞噬细胞的分泌、分化、增殖和凋亡具有双向调节和信号转导的作用,可双向调节免疫细胞的生物学功能[16]。
因此,一方面,过多 ROS的产生可诱发吞噬细胞的凋亡甚至死亡;另一方面,细胞外酸性增加必会引起细胞的酸中毒而影响其生理功能,因此本实验中,吞噬细胞的呼吸爆发并不是随着胞外乳酸浓度的增加而持续加大,而是当胞外乳酸浓度达到7.69 mmol/L后就急剧下降,而吞噬细胞的吞噬功能因为过多ROS的产生并不是与呼吸爆发同步上升,而是较其呼吸爆发提前至胞外乳酸浓度在6.57 mmol/L时急剧下降。
4 结论
1.离体外周血酸度的变化可以通过激活或抑制吞噬细胞NADPH氧化酶的活性而影响中性粒细胞吞噬与呼吸爆发功能,并随着外周血酸度的变化,其呼吸爆发和吞噬功能呈现一定的变化规律。
2.伴随着外周血乳酸浓度的变化中性粒呼吸爆发于吞噬功能并不是非常同步的发生变化,表现为低浓度的乳酸浓度时,中性粒细胞呼吸与吞噬功能同步受到抑制,随着乳酸浓度的增加,中性粒细胞的呼吸爆发和吞噬功能开始上升,但随着乳酸浓度进一步增加,吞噬功能则提前呼吸爆发出现转折性下降。此正好验证了我们前期提出的假设,既由于中性粒细胞呼吸爆发产生大量的 ROS可能会影响使机体的过氧化使其吞噬功能减弱。
3.NADPH氧化酶的活性受多种因素多种因子的调节,每一细小环节都可能引起其活性的变化而调控呼吸爆发及吞噬功能,由于本实验是采用外周血的离体进行,血液自身的缓冲体系无法得以实施其对体液各成分的平衡作用.运动因为其运动形式和运动强度的变化而使体内环境呈现多变性,因而对于胞外乳酸引起的酸度变化对PMN的呼吸爆发和吞噬功能具有一定的局限性。要阐明运动引起的各种环境因子影响PMN呼吸爆发的规律和作用机理还需要进一步研究。
[1]李玲娜,周裕,易静.质膜上的活性氧制造者—NOX家族[J].生命科学,2005,17(5):414-418.
[2]李艳玲,刘承宜,段锐,等.胞外p H对中性粒细胞呼吸爆发的影响[J].中国病理生理杂志,2004,20(4):683-685.
[3]王威.吞噬细胞NADPH氧化酶活性的调控[J].国际病理科学与临床杂志,2009,29(4):318-323.
[4]ARRUDA MA,BARJA-FIDAL GO C.In the crossroad of neutrophil life and death[J].Front Biosci,2009,14(10):4546-4556.
[5]BOSQUET L,LEGER L,LEGROS P.Blood lactate response to overtraining in male endurance athletes[J].Eur J Appl Physiol,2001,84(1-2):107-114.
[6]GAUSS K A,NELSONOVERTON L K,SIEMSEN D W,et al.Role of NF-κB in transcrip tional regulation of the phagocyte NADPH oxidase by tumor necrosis factor-alpha[J].J Leukoc Biol,2007,82(3):729-741.
[7]GAVRIELI R,ASHLAGI-AMIRI T,ELIAKIM A,et al.the Effect of Aerobic Exercise on Neutrophil Functions[J].Med Sci Sport Exe,2008,40(9):1623-1628.
[8]HELMY M,SIRAGY,HUANGJ Q.Renal(pro)renin receptor up-regulation in diabetic rats through enhanced angiotensin AT1 receptor and NADPH oxidase activity[J].Exp Physiol,2008,93(5):709-714.
[9]IMAGAWA N,NAGASAWA K,NAGAI K,et al.Protein kinase C independent pathway forNADPH oxidase activation in guinea pig peritoneal polymorphonuclear leukocytes by cytochalasin D[J].Arch Biochem Biophys,2005,438(2):119-124.
[10]LAMBETH J D,KAWAHARA T,DIEBOLD B.Regulation of Nox and Nuox enzymatic activity and expression[J].Free Radic Biol Med,2007,43:319-325.
[11]LEANDRO C G,DE LIMA T M,ALBA-LOUREIRO T C,et al.Stress-Induced Down regulation of Macrophage Phagocytic Function Is Attenuated by Exercise Training in Rats[J].Neuroimmuno Modulation,2007,14(1):4-7.
[12]L YAPINA M,ZHELEZOVA G,PETROVA E,et al.Flow cytometric determination of neutrophil respiratory burst activity in workers exposed to formaldehyde[J].Int Arch Occup Environ Health,2004,77(2):335-340.
[13]MOCHIDA N,UMEDA T,YAMAMOTO Y,et al.The main neutrophil and neutrophil-related functions may compensate for each other following exercise-a finding from training in university judoists[J].Luminescence,2007,22(1):20-28.
[14]SAWYER D W,DONOVITZ G R,MANDELL G L,et al.Polymorphonuclear neutrophils:an effective antimicrobial force[J].Rev Infect,1989,11:1532-1544.
[15]SHEPPARD F R,KEL HER M R,MOORE E E,et al.Structural organization of the neutrophil NADPH oxidase:phosphorylation and translocation during priming and activation[J].J Leukoc Biol,2005,78(5):1025-1042.
[16]STEPHAN BLÜML,BERIT ROSC,AKOS LORINCZ,et al.The oxidation state of phospholipids controls the oxidative burst in neutrophil granulocytes[J].J Immunology,2008,181:4347-4353.
[17]USHIO-FU KAI M.Localizing NADPH oxidase-derived ROS[J].Sci STKE,2006,349(8):345-354.
[18]WEISMAN SJ,PUNZO A,FORD C,et al.Intracellular pH changes during neutrophil activation:Na+/H+antiport[J].J Leukoc Biol,1987,41(1):25-32.
[19]TONETTI M A,CAVALIERO G A,BOTTA R,et al.Intracellular pH regulates the production of different oxygen metabolities in neutrophils:effects of organic acids produced by anaerobic bacteria[J].J Leukoc Biol,1991,49(2):180-188.
Effect of Lactic Acid on the Function Phagocytosis and Respiratory Burst of Phagocytic Cell in Peripheral Blood in Vitro
DONG Jing-mei1,2,CHEN Pei-jie1,WANG Ru1,YU Dong-zhen1,ZHAN G Ya-jun1,XIAO Wei-hua1
目的:探讨乳酸引起的酸度变化对外周全血吞噬细胞呼吸爆发与吞噬功能的影响及发生机制。方法:1)取20名健康男性外周静脉血10 ml,分10份建立乳酸体积量与血乳酸值的回归方程;2)另取10名健康男性外周静脉血20 ml分为对照组(Ctr组)、乳酸处理组(E组),各组再分10小组,按照第一步建立的回归方程加入不同体积的乳酸,同时Ctr组给予DPI处理,2组同时孵育10 min后各小组每份取100μl全血用流式细胞仪测定呼吸爆发和吞噬功能;3)分别取Ctr组、E组第6小组的血液分离中性粒细胞,利用免疫细胞化学与共聚焦技术进行NADPH氧化酶关键亚基gp91phox与p47phox的共定位实验。结果:1)低浓度(低于4.81 mmol/L)的乳酸抑制吞噬细胞的呼吸爆发和吞噬功能,中度浓度(4.81 mmol/L~8.14 mmol/L)的乳酸浓度可引起吞噬细胞呼吸爆发依赖乳酸浓度的增加而增加,高于此浓度可引起吞噬细胞呼吸爆发与急剧下降,而吞噬功能提前急剧下降;2)吞噬细胞NADPH氧化酶活性的改变与呼吸爆发的变化呈高度的相关性;3)乳酸浓度为8.14 mmol/L时中性粒细胞 NADPH氧化酶关键亚基p47phox移为至质膜与gp91phox出现共定位。结论:乳酸引起的外周血酸度的变化可以通过调控NADPH氧化酶活性的改变影响其吞噬细胞呼吸爆发和吞噬功能。
乳酸;吞噬细胞;吞噬功能;呼吸爆发;活性氧;NADPH氧化酶
Objective:To investigate the impact of acidity change caused by lactic acid on the phagocytes cell respiratory burst and the phagocytic function in peripheral whole blood and mechanism.Method:1)10ml peripheral whole blood from 20 healthy male,was divided into 10 portions(1ml per portion)to establish the regression equation between concentration land the volume lactic acid.2)20ml peripheral whole blood from another 10 healthy male,was divided into group Ctr and E,each group was further separated into 10 portions and added in the different volume of lactic acid according to the first step,the group Ctr was treated with DPI additionally.The blood of two groups was incubated for 10 minutes and then 100ul whole blood was taken from each portion to detect the function of respiratory burst and phagocytosis of neutrophils and mononuclear cell respectively by flow cytometery.3.The neutrophils from the sixth portion blood of group Ctr and E were taken and observed the co-localization of the gp91phox and p47phox in NADPH-oxidase using immunocytochemistry and confocal technology.Result:1)Low concentration(less than 4.81mmol/L)of lactic acid can inhibit the function of phagocytosis and respiratory burst of phagocytic cells,moderate concentration(4.81 mmol/L~8.14mmol/L)of lactic acid can lead to the increase respiratory burst of phagocytic cells.The curve of respiratory burst can be declined sharply while above this concentration lactic acid and the curve of sharp decline of the function of phagocytosis was early than the curve of respiratory burst.2)It is a high degree of correlation between the activity NADPH oxidase and the respiratory burst in phagocytic cells.3)There is co-localization between the subunit p47phox and the gp91phox in NADPH-oxidase on the plasma membrane in neutrophils when the lactic acid concentration in blood is 8.14mmol/L.Conclusion:The acidity induced by lactic acid in peripheral blood can regulate the activity NADPH oxidase and lead to the change of the phagocytosis function and respiratory burst in phagocytic cells.
lactic acid;phagocytic cells;phagocytosis f unction;respiratory burst;radical;ROS;NA D P H-oxidase
G804.5
A
1000-677X(2011)03-0037-07
2010-12-10;
2011-01-18
国家自然科学基金资助项目(30971422);上海市重点学科建设资助项目(S30802)。
董静梅(1969-)女,甘肃庆阳人,副教授,在读博士研究生,研究方向为运动与健康促进,Tel:(021)35080378,E-mail:lzdjm119@sohu.com;陈佩杰 (1962-),男 ,浙江舟山人,教授,博士,博士研究生导师,研究方向为运动与免疫,Tel:(021)51253626,E-mail:chenpeijie1961@hotmail.com。
1.Shanghai Sports College,Shanghai 200438,China;
2.Institute ofPhysicalEducation,Lanzhou 730070,China.
