物理化学中的化学平衡内容*
2011-09-25岳可芬赵爽王小芳
岳可芬 赵爽 王小芳
(西北大学化学与材料科学学院 陕西西安 71006)
最近,我院对教育部高等学校化学与化工学科教学指导委员会为化学类专业本科教学制定的2010.2版本“化学类专业化学教学基本内容”的完成情况进行统计,发现有关化学平衡、标准平衡常数及化学平衡等温式在大一普通化学、大二物理化学中均有涉及[1-2]。另外,化学平衡和化学平衡移动原理也是高中化学中的重点和难点[3]。
作为物理化学的重要组成部分[4],化学平衡主要研究化学反应进行的程度以及影响化学平衡的因素,其一系列规律不仅在化学基础理论中占有极重要的地位,而且在实践中具有指导意义。在物理化学课程中讲授的内容不是对已有知识的简单重复,而是对已有知识的提高、深化。在讲授时应重点解决以下几方面的内容。
1 van′t Hoff等温方程的推导
根据物理化学课程前章所学化学势推导出化学反应的van′t Hoff等温式,即:
(1)
(2)
式(1)和式(2)在普通化学中只是提到和应用,没有推导。
通过KӨ与Q的相对大小判断化学反应的方向和限度,实质仍然是热力学第二定律中通过ΔrGm的正负号(即化学势的相对大小)判断化学反应的方向和限度。化学势的概念及其应用在物理化学中是第一次涉及,前行课程中均未提及。式(1)的推导也算是化学势在化学反应中的应用。
2 非均相体系平衡常数与活度
关于化学平衡的计算,除理想均相体系的平衡常数与热力学状态函数的相互求算、平衡常数及相关的平衡转化率的计算外,对非均相体系平衡常数的求算或由此求算活度等也是很有意义的[5]。
例题1求下列非均相反应在298K,标准压力pӨ下的平衡常数[5]:
2Ag(s)+Hg2Cl2(aq)=2AgCl(aq)+2Hg(l)
(Ⅰ)
已知Hg2Cl2(s)和AgCl(s)在水中的饱和浓度分别为6.5×10-7mol·dm-3和1.3×10-5mol·dm-3,其标准摩尔生成Gibbs自由能分别为-210.66kJ·mol-1和-109.72kJ·mol-1。设溶液为理想溶液。
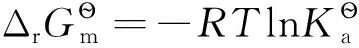
2Ag(s)+Hg2Cl2(cӨ)=2AgCl(cӨ)+2Hg(l)
(Ⅱ)



所以有:

可见,利用标准摩尔生成Gibbs自由能、化学势等热力学函数计算平衡常数是物理化学的优势。
3 外界条件对化学平衡的影响
在高中化学、大一普通化学中均谈到Le Chatelier原理,但都只有定性讨论而没有或少有定量计算。因此,物理化学中讲外界条件对化学平衡的影响时,应侧重于外界条件的改变对化学平衡移动的定量讨论。
3.1 温度对化学平衡的影响
若参加反应的物质均处于标准态,根据物理化学中的Gibbs-Helmholtz方程,则有:
(3)

(4)

(5)
大一普通化学中未提到式(3),仅用式(5)做一些计算[1]。而在物理化学中很自然引出式(3),进一步可推导出式(4)和式(5)[2]。
3.2 压力和惰性气体对化学平衡的影响
当参加反应的物质都是理想气体,体系总压力为p,体系达平衡时,有:

(6)

(7)
总之,通过学习物理化学中的化学平衡章节,要求学生不仅能定性地判断化学反应方向、化学平衡移动的方向,而且能定量地计算化学反应进行的程度及化学平衡移动的程度,解决实际工作中遇到的问题。
[1] 史启祯.无机化学与化学分析.北京:高等教育出版社,1998
[2] 傅献彩,沈文霞,姚天扬,等.物理化学(上册).第5版.北京:高等教育出版社,2006
[3] 汪毅.化学教与学,2010(4):44
[4] 张志红,赵秀峰.大学化学,2010,25(2):60
[5] 韩德刚,高执棣,高盘良.物理化学.北京:高等教育出版社,2001
