抓氢键的成键类型及其红外光谱研究简介
2011-09-25许兵王雪峰
许兵 王雪峰
(同济大学化学系 上海 200092)
1983年,Brookhart 和Green首先定义了有机金属化学中的C—H基团和中心金属M原子之间存在的一种新化学键,称为agostic bonding[1]。2005年周公度首次建议将其译为“抓氢键”[2-3]。这些键可用于描述C—Hσ键和过渡金属M中心d 轨道之间共价作用的结果。目前我们可以从众多文献中了解到这种抓氢键,它已经成为有机金属化学的一个重要研究课题[4-8]。Cotton[9]指出,抓氢键有两个基本结构特征:一是M—H之间的距离在1.9~2.4Å之间,二是金属—碳—氢(M—C—H)的夹角在90~140°之间。Brookhart将这种键定义为“有机金属化合物中C—H基团和过渡金属M中心之间的共价吸引力”,抓氢键具有三中心(C、H、M)和两电子特征(C—Hσ键上电子),其强弱与金属在周期表中的位置、金属的缺电子状况、金属的氧化态、σ键的类型,σ键和金属中心的距离等有关。本文将回顾近年来抓氢键的研究进展,总结利用光谱技术(主要是红外光谱),并结合理论计算研究,对抓氢键进行介绍。
1 抓氢键的类型
抓氢键的种类通常以被吸引的原子(通常是氢原子)和金属的远近关系而划分。如图1所示,目前主要有α、β和γ等抓氢键,下面分别叙述不同抓氢键的成键规律。
1.1 α-抓氢键
Goddard[10]第一个系统地研究了α-抓氢键的成键机理,他的工作为人们认识这种键开辟了新的视野。此前,人们认为是C—H键的电子占有轨道与缺电子的金属原子空轨道直接作用推动了抓氢键的形成,而Goddard用分子模型证明,在发生抓氢作用的时候,两种作用力都有可能发生:一种是C—Hσ键轨道与金属的最低未占轨道(LUMO)相互吸引,另一种是金属的最低未占轨道LUMO与CH2的最高占有轨道(HOMO)之间的相互作用,但前者两个轨道能量相差较大,成键稳定性不好,后者成键方式较为有利,即两个轨道之间能量相近,互相倾斜以便能够较大地重叠。
抓氢作用通常发生在空间较为拥挤的结构中,而在空间排列不拥挤的配合物中较少发生。所以有学者强调“抓氢构型”的重要性[11-12]。在Ti化合物中[13],增加的dmpe(磷脂酰乙醇胺) 配体迫使Ti进入八面体配位场,因此使得配合物结构扭曲以便让空的金属轨道有效地与CH3的HOMO发生相互作用。同样的化合物,如果没有dmpe作为额外配体,是四面体配位场,不存在抓氢作用。
1.2 β-抓氢键
α-抓氢键的成键机理也适用于β-抓氢键。主要来自金属空轨道与Cβ—Hσ键电子的相互作用[14]。
在化合物TpMe2NbCl(R′CCR″)(R)[15]中,存在竞争形成β-抓氢键的趋势(图2),Cl配体的π轨道电子和Cβ—Hσ键电子竞争Nb空的d轨道,在抓氢结构中,主要形成了Cβ—Hσ键与Nb之间的作用力,在非抓氢结构中,取而代之的是Cl的孤电子对与 Nb的d轨道之间的作用力。Nb—Cl键长度可以反映是否形成了抓氢键,短的Nb—Cl键(大约在2.42Å左右)说明形成抓氢键的趋势小, Cl竞争结合成功。长的Nb—Cl键(2.49Å)说明金属Nb和Cβ—H之间存在抓氢作用。
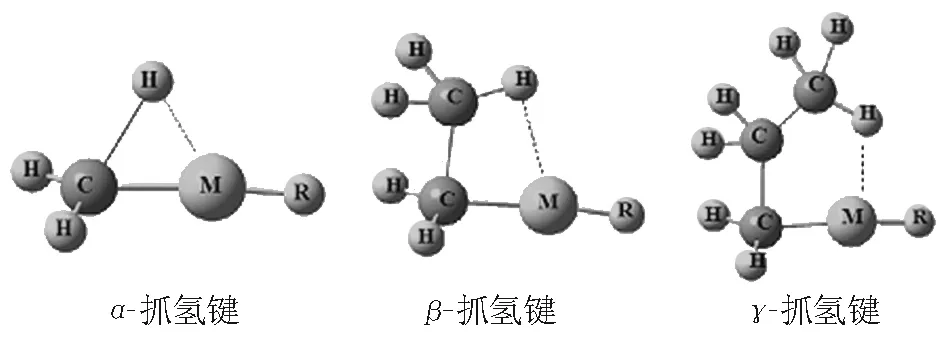
图1 抓氢键的3种类型
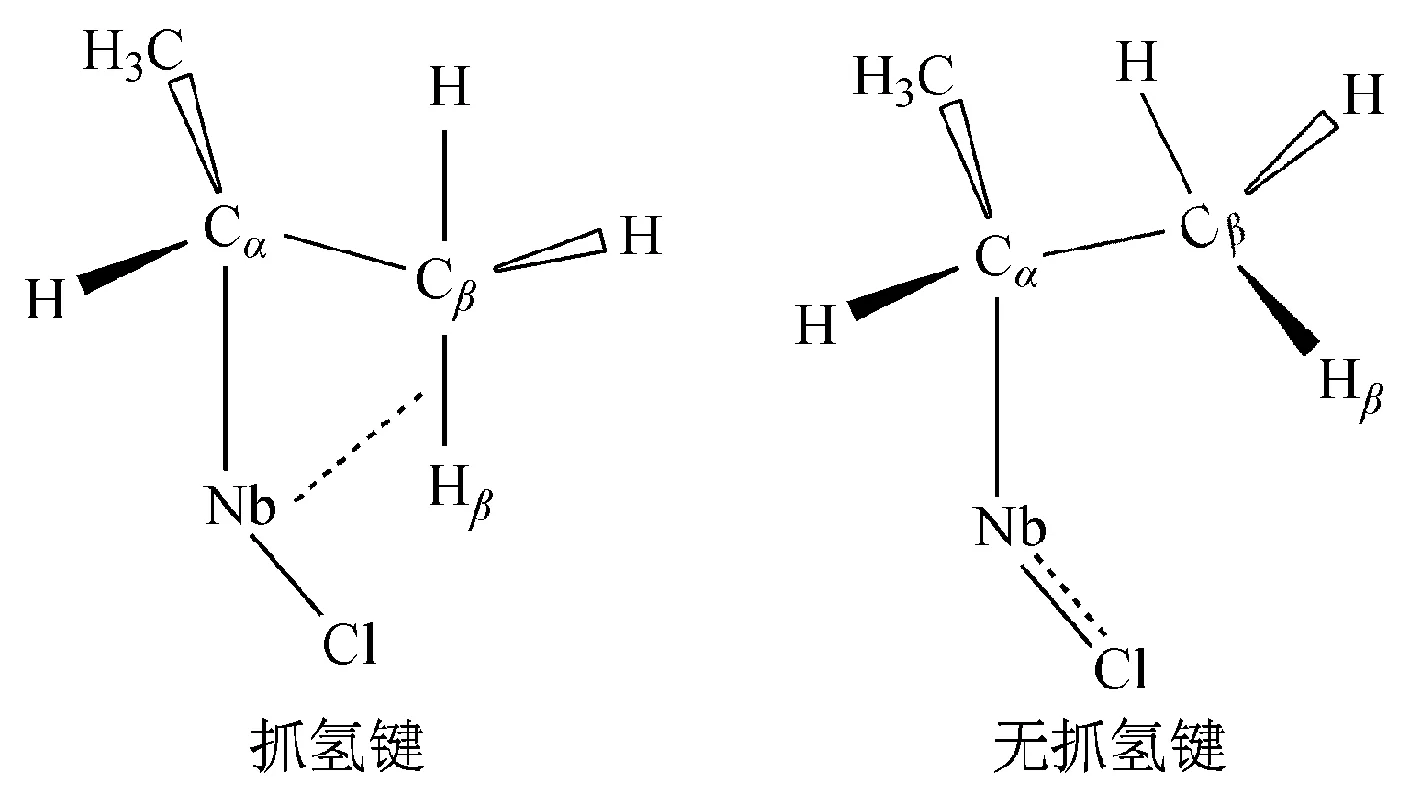
图2 TpMe2NbCl(R′CCR″)(R)中Cβ—H σ电子和Cl的p电子竞争Nb的d空轨道[15]
1.3 γ、δ以及更远的抓氢作用
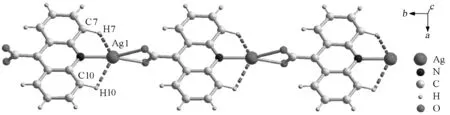
图3 {[AgL]·(H2O)2}n中的抓氢键[16]L=acridine-9-carboxylic
2 实验观测和理论计算研究抓氢键
由于在发生抓氢作用的时候,C—H键长显著增加,因此许多光谱性质也随之发生变化,如NMR1JCH耦合常数降低,C—H伸缩频率降低,波长增大等,为观察抓氢键提供了实验基础。在此本文着重介绍红外光谱观察的一些实验结果。
许多过渡金属烷烃化合物含有抓氢键,这些化合物提供了了解抓氢作用的最简单模型[18-26]。这些过渡金属元素主要分布在第4~6副族、镧系和锕系中。
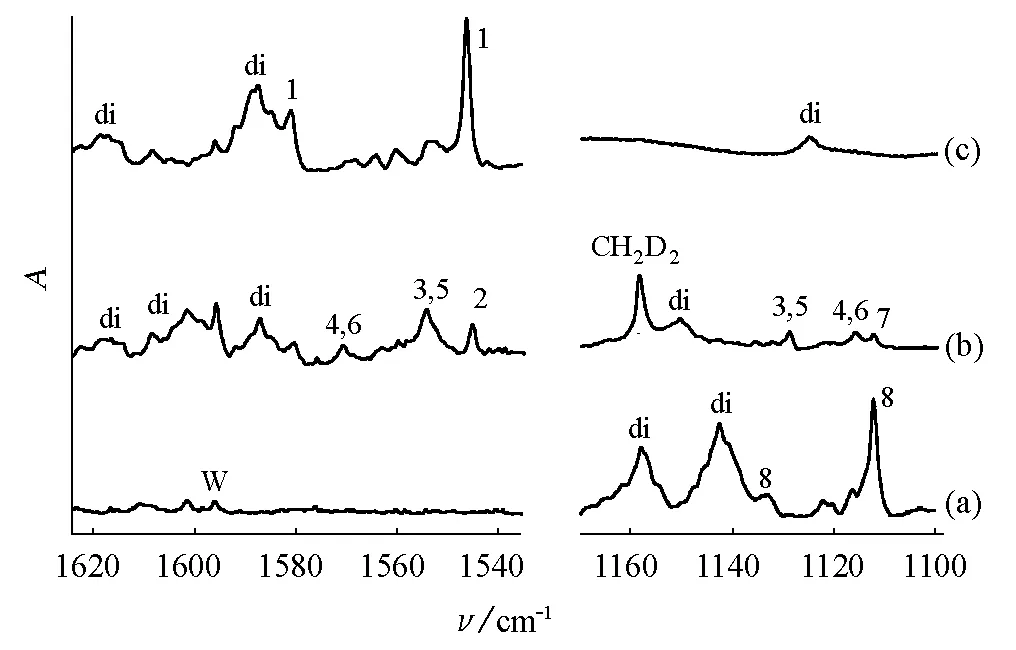
图4 红外光谱(a) Zr与CD4反应;(b) Zr与CH2D2反应;(c) Zr与CH4反应
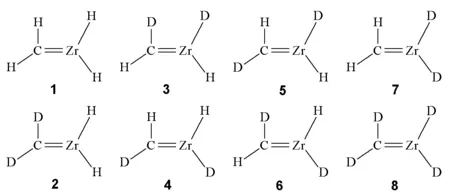
图5 Zr与CH4、CD4、CH2D2反应的产物示意图


图7 的一对旋光异构体
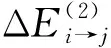
3 其他类型的agostic化学键
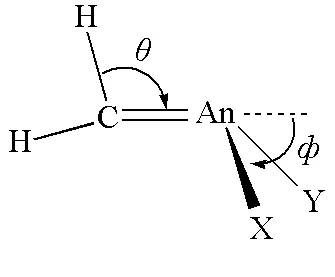
图6 抓氢键和金字塔结构
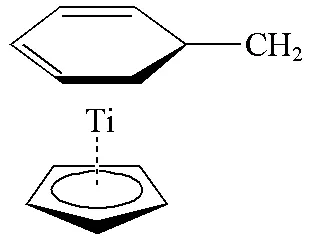
图8 Ti(C5H5)+和3-亚甲基-1,3-环己二烯相互作用[28]
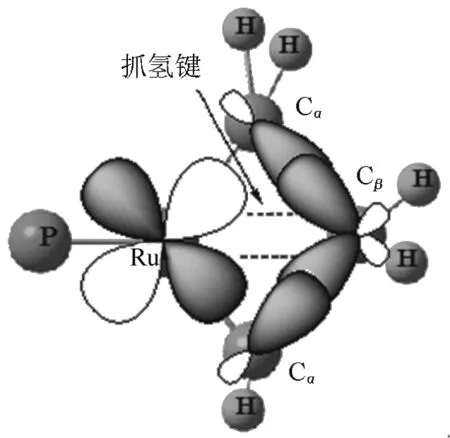
图10 Cl2RuPH3(CH3)3(C3H6)中的α,β-CCC 抓氢键
Cherumuttathu[30]报道了一种α,β-CCC抓“碳”键,在以Ru为金属原子的化合物中(图10),在金属和环丁烷配合物中只有Cβ没有直接与金属结合,Ru-Cβ距离为2.82Å。两个Cα和一个Cβ组成sp3杂化,金属Ru的dxy和两个Cα-Cβσ键之间存在肩并肩重叠相互作用,形成π型化学键,这是首次报道的Ru与Cβ之间存在的π型抓“碳”键。这种相互作用被命名为α,β-CCC抓氢键。

图9 CH2ClM(O)OH中Cl和Ta之间形成抓氢键
“agostic”一词来自希腊文,意思是“抓住紧靠其近旁的”。随着对agostic键的深入了解,人们发现了更多的抓氢键,在这些抓氢键中,金属原子并非与氢原子作用,而是与其他原子组成这样一种相互作用的关系,同样也属于抓氢键。因此我们认为用“抓氢键”这个词来解释这一类化学键具有一定的局限性,在此期待相关的学者能够提出一个更好的概括这个化学键的专门术语,重新对这个化学键进行科学合理描述。综上,近年来抓氢键获得了众多的研究和关注,关于它的成键机理仍需更进一步的探索,许多新的实验体系还有待于深入了解。
[1] Brookhart M,Green M L H.JOrganometChem,1983,250:395
[2] 周公度.结构术语研究,2005,7:39
[3] 周公度,段连运.结构化学基础.第3版.北京:北京大学出版社,2002
[4] Simoes J A M,Beauchamp J L.ChemRev,1990,90:629
[5] McGrady G S,Guilera G.ChemSocRev,2003,32:383
[6] Koga N,Morokuma K.ChemRev,1991,91:823
[7] Koga N,Obara S,Kitaura K,etal.JAmChemSoc,1985,107:7109
[8] Rothwell I P.Polyhedron,1985,4:177
[9] Cotton F A,LaCour T,Stanislowski A G.JAmChemSoc,1974,96:3
[10] Goddard R J,Hoffmann R,Jemmis E D.JAmChemSoc,1980,102:7667
[11] Vidal I,Melchor S,Alkorta I,etal.Organometallics,2006,25:5638
[12] Vidal I,Melchor S,Dobado J A.JPhysChemA,2008,112:3414
[13] Cooper A C,Clot E,Huffman J C,etal.JAmChemSoc,1999,121:97
[14] Scherer W,McGrady G S.AngewChemIntEd,2004,43:1782
[15] Dimitrios A,Pantazis J E,McGrady F M,etal.JChemTheoryComput,2007,3:1329
[16] Yu Q,Wei Z Z,Li J R,etal.JMolStr,2009,931:68
[17] Popelier P,Logothetis G.JOrganometChem,1998,555:101
[18] Schrock R R.ChemRev,2002,102:145
[19] Crabtree R H.ChemRev,1985,85:245
[20] Ujaque G,Cooper A C,Maseras F,etal.JAmChemSoc,2003,125:7035
[21] Cho H G,Wang X F,Andrews L.JAmChemSoc,2004,127:465
[22] Andrews L,Cho H G,Wang X F.AngewChemIntEd,2005,44:113
[23] Cho H G,Wang X F,Andrews L.Organometallics,2005,24:2854
[24] Andrews L,Cho H G,Wang X F.InorgChem,2005,44:4834
[25] Cho H G,Andrews L.JAmChemSoc,2004,126:10485
[26] Cho H G,Andrews L.ChemEurJ,2005,11:5017
[27] Tomaszewski R,Hyla-Kryspin I,Mayne C L,etal.JAmChemSoc,1998,120:2959
[28] Matthias L.CoordChemRev,2009,253:625
[29] Zhao Y Y,Huang Y F,Zheng X M,etal.JPhysChemA,2010,114:5779
[30] Suresh C H.JOrganometChem,2006,691:5366
