抗癌镇痛肽AGAP肺靶向融合体在毕赤酵母中的表达
2011-09-25马建荣余永红张景海
马建荣,余永红,张景海
(1.广东食品药品职业学院实验实训中心,广东广州510520;2.沈阳药科大学生命科学与生物制药学院,辽宁沈阳110016)
抗癌镇痛肽AGAP肺靶向融合体在毕赤酵母中的表达
马建荣1,余永红1,张景海2*
(1.广东食品药品职业学院实验实训中心,广东广州510520;2.沈阳药科大学生命科学与生物制药学院,辽宁沈阳110016)
利用构建好的质粒pPIC9K-RGD-4C-His Tag-AGAP(analgesic-antitumor peptide,抗癌镇痛肽)进行单酶切线性化,然后电转化毕赤酵母GS115,电转之后的菌落通过菌落PCR进行筛选,最终得到阳性菌落。阳性菌落经增菌培养,甲醇诱导后的上清SDS-PAGE电泳后经western blot检测证明,抗癌镇痛肽肺靶向融合体已经成功得到表达。
东亚钳蝎;抗癌镇痛肽;毕赤酵母;真核表达
蝎毒种类多,相对分子量小、稳定性好、活性强,具有广泛的生物学作用[1]。蝎毒蛋白一般是由20~80个氨基酸组成的多肽。AGAP是刘岩峰、张景海[2]于2003年由蝎毒中提取的具有抗肿瘤和镇痛活性的活性多肽,并且已经实现了在大肠埃希菌中的表达。但是在其表达中仍存在一些问题,例如分离纯化过程复杂,需要去除内毒素,活性受到一定影响等。巴斯德毕赤酵母(Pichia pastoris)基因表达系统经过近十年发展,已基本成为较完善的外源基因表达系统,且具有易于高密度发酵,表达基因稳定整合在宿主基因组中,能使产物有效分泌并适当糖基化,培养方便经济等特点。利用强效可调控启动子AOX1,用该系统成功表达的外源基因有30多种,其中大部分为医药制品,如人白介素-2、人血清白蛋白、肿瘤坏死因子、乙肝表面抗原、人巨细胞病毒(cytomegalovirus)抗原、抗凝血因子水蛭素衍生物(hirudin variants)、血管紧张肽-Ⅰ转换酶等,有些即将进入市场[3-4],证实该系统为高效、实用、简便,以提高表达量并保持产物生物学活性为突出特征的外源基因表达系统,而且非常适宜扩大为工业规模。与大肠埃希菌的表达相比,毕赤酵母具有利于蝎毒蛋白正确折叠、分离纯化简单方便等优点。因此本研究拟实现抗癌镇痛肽AGAP 肺靶向融合体在毕赤酵母中的表达。
1 材料与方法
1.1 材料
pPIC9K-RGD-4C-His Tag-AGAP、大肠埃希菌BL-21,沈阳药科大学构建保藏;毕赤酵母GS115,invitrogen公司;各种限制性内切酶、DNA连接酶、Taq酶及PCR反应缓冲液,TaKaRa(Japan)公司; Western Blot中使用的抗体(兔抗),本实验室制备保存;碱性磷酸酶标记山羊抗兔IgG(H+L)-Alkaline Phosphatase Goat Anti-Rabbit IgG(H+ L),北京中杉生物公司;显色液BCIP/NBT(0.48 mmol/L和0.51 mmol/L),Amresco产品。
1.2 方法
1.2.1 载体pPIC9K-RGD-4C-His Tag-AGAP线性化线性化的质粒与酵母基因组更容易发生重组整合,因此载体pPIC9K-RGD-4C-His Tag-AGAP首先进行SacⅠ单酶切,成为带有2个粘性末端的线性分子,以便转入毕赤酵母后与基因组同源重组。
1.2.2 毕赤酵母的电转化电转化步骤参考MicroPulserTM Electroporation Aparatus Operating Instructions and Applications Guide(MicroPulser TM电穿孔仪操作说明和应用指导,BIO-RAD)。
1.2.3 克隆筛选菌落PCR:用牙签挑取转化平板上长出的单菌落,涂抹到200 μL离心管底,微波1 min;-80℃冻5 min,再微波1 min。加入20 μL无菌水溶解,离心后取1~2 μL上清做模板,配制50 μL PCR体系。
1.2.4 表达产物的Western Blot检测挑取克隆筛选得到的阳性菌落于25 mL BMGY(Buffered glycerol complex medium)培养基30℃培养至OD600≈4.1。离心、收集菌体,用100 mL BMMY (Buffered methanol complex medium)培养基重悬培养。每日取样1 mL,并补加纯甲醇于培养基至终浓度为1%,诱导表达6 d,取样品加入2×SDS上样缓冲液在100℃沸水中变性处理3~5 min,离心去沉淀后,用于Tris-甘氨酸SDS聚丙烯酰胺凝胶电泳(5%分离胶80 V,5%积层胶120 V)。SDS-PAGE分离后,用电泳转移仪将蛋白转移至预处理的PVDF膜上,恒压94 V,转移30 min。取出PVDF,用蒸馏水漂洗5 min,将膜置于封闭缓冲液(TBST+5%BSA)中,室温轻摇2.5 h,取出,用TBST漂洗3次,每次5 min。1∶100加入一抗,4℃过夜反应。取出,用TBST漂洗3次,每次5 min。1∶1000加入二抗(碱性磷酸酶标记的山羊抗兔IgG),室温轻摇2 h。取出,用TBST漂洗3次,每次5 min。加入显色液BCIP/NBT,不断摇动,直到显出颜色条带,用蒸馏水漂洗中止染色[5]。
2 结果与分析
2.1 载体pPIC9K-RGD-4C-His Tag-AGAP线性化
如图1所示,右侧泳道样品为表达载体pPIC9K-RGD-4C-His Tag-AGAP,由于正/负超螺旋和线型分子的泳动速度不同而呈现多条谱带,中间泳道为表达载体pPIC9K-RGD-4C-His Tag-AGAP双酶切后解除正/负超螺旋结构,成线性,所以只有一条谱带出现。
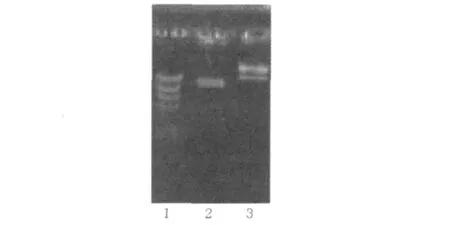
图1 质粒pPIC9K-RGD-4C-His Tag-AGAP线性化结果Fig.1Enzyme digestion of pPIC9K-RGD-4C-His Tag-AGAP Electrophoresis type is 1.0%agarose gel;Lane 1 is marker λDNA Hind III;Lane 2 is pPIC9K-RGD-4C-His Tag-AGAP digested by Sac I;Lane 3 is undigested pPIC9K-RGD-4CHis Tag-AGAP电泳采用1.0%的琼脂糖凝胶,1:分子量标准λDNA Hind III;2:经Sac I消化后的质粒RGD-4C-His Tag-AGAP;3:未经消化的RGD-4C-His Tag-AGAP
2.2 克隆筛选
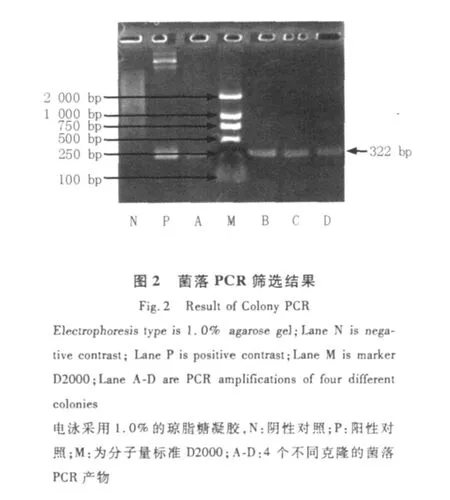
分别以菌落处理后的上清、pPIC9K转化的毕赤酵母处理后的上清和质粒pPIC9K-RGD-4C-His Tag-AGAP为模板进行PCR,作为阴性和阳性对照。电泳观察结果。如图2所示:A、B、C、D 4个菌株与阳性对照相同位置均有条带,为阳性转化子。
2.3 表达产物的western blot检测
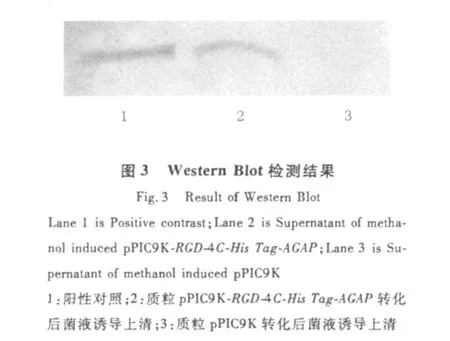
以菌液诱导后上清为样品,以pPIC9K转化的菌液诱导后上清为阴性对照,以原核表达的RGD-4C-His Tag-AGAP蛋白作为阳性,进行SDSPAGE电泳,9 V转硝酸纤维素膜30 min,BICP/ NBT显色观察实验结果。如图3所示,样品在与阳性对照相同位置有条带,证明RGD-4C-His Tag-AGAP在毕赤酵母中得到成功表达。
3 讨论
酵母作为单细胞真核生物,易于培养,生长繁殖速度快,具有比大肠埃希菌更加完备的基因表达调控机制、基因表达产物正确折叠的细胞内环境以及对产物的加工修饰及分泌能力。尤其是酿酒酵母,其基因测序已经于1996年完成,而且安全性高,因此酵母作为基因工程表达系统得到广泛的研究和应用。
Shao等[6]在酿酒酵母中成功表达了来源于东亚钳蝎的哺乳动物神经毒素BmK M1,并且分泌到培养基中,表达水平达到5 mg/L发酵液。虽然跟天然BmK M1相比,重组BmK M1在N端有2个额外的氨基酸残基,但是并没有影响活性。相比之下,当没有额外的氨基酸存在时,表达极不稳定。这种酵母表达蝎毒素基因工程产物时信号肽切除不完全的现象在Pang等[7]将化学合成的抗昆虫毒素短肽BeI5A的基因转入酵母菌中时就曾经有过。实验证明,当细胞内有大量外源蛋白质合成时,酵母氨肽酶的活力不足以切除它们氨基末端多余的氨基酸残基,酵母的自身平衡调节机制被破坏,就会出现信号肽切除不完全现象。
除了上述基因外,在酿酒酵母中表达的重组蝎毒素基因还有昆虫特异性蝎神经毒素AaH IT1[8]。但是只有很小的一部分重组蛋白被释放到培养基中。这也是由于酿酒酵母的分泌效率不太高造成的。而且酿酒酵母缺乏强有力的启动子,不适合高密度培养。
当利用酿酒酵母制备时,实验室的结果很令人鼓舞,但由实验室扩展到工业规模时,其产量迅速下降。原因是培养基中维持质粒高拷贝数的选择压力消失,质粒变得不稳定,拷贝数下降。拷贝数是高效表达的必备因素,因此拷贝数下降,也直接导致外源基因表达量的下降。同时,实验室用培养基成分复杂且昂贵,当采用工业规模能够接受的培养基时,导致了产量的下降。有鉴于此,人们发展了新一代的酵母表达系统—巴斯德毕赤酵母(Pichia pastoris)表达系统,即甲醇酵母表达系统[9]。
甲基营养型酵母包括:Pichia、Candida等,以Pichia pastoris(巴斯德毕赤酵母)为宿主的外源基因表达系统近年来发展最为迅速,应用也最为广泛,已利用此系统表达了一系列有重要生物学活性的蛋白质。毕赤酵母系统的广泛应用,原因在于该系统除了具有一般酵母所具有的特点外,还有以下几个优点[10-12]:具有目前最强,调控机理最严格的启动子;表达质粒能在基因组的特定位点以单拷贝或多拷贝的形式稳定整合;菌株易于进行高密度发酵,外源蛋白表达量高;存在过氧化物酶体,表达的蛋白贮存其中,可免受蛋白酶的降解,而且减少对细胞的毒害作用。
Pichia pastoris酵母菌体内无天然质粒,所以表达载体需与宿主染色体发生同源重组,将外源基因表达框架整合于染色体中以实现外源基因的表达[13],包括启动子、外源基因克隆位点、终止序列、筛选标记等。表达载体都是穿梭质粒,先在大肠埃希菌复制扩增,然后被导入宿主酵母细胞。为使产物分泌至胞外,表达载体还需带有信号肽序列。
毕赤酵母表达系统有多种分泌型表达质粒,有许多蛋白在毕赤酵母得到了高效分泌表达[14-16]。胞外表达需要在外源蛋白的N末端添加一段信号肽序列,引导重组蛋白进入分泌途径,可使蛋白质在分泌到胞外之后获得准确的构型。本课题采用的就是毕赤酵母分泌性表达载体pPIC9K。成功实现了抗癌镇痛肽肺靶向融合体在毕赤酵母中的分泌表达。目前国外尚无蝎毒在毕赤酵母中成功表达的报道,国内仅有2篇文献报道已成功表达蝎毒蛋白[17-18],但尚无人报道成功表达AGAP。本研究的成功对以后蝎毒在毕赤酵母中表达研究具有重要意义。
[1]吴虹雨,张威.蝎毒对离子通道的作用及应用[J].沈阳医学院学报,2001,3(1):56-57.
[2]Liu YF,Ma RL,Wang SL,et al.Expression of an antitumor-analgesic peptide from the venom of Chinese scorpion Buthus martensii karsch in Escherichia coli[J].Protein Expr Purif,2003,27(2):253-258.
[3]Cregg J M,Vedvick T S,Raschke W C.Recent Advances in the expression of foreign genes in Pichia pastoris[J].Bio/Technology,1993,11(8):905-910.
[4]Hollenberg C P,Gellissen G.Production of recombinant proteins by methylotrophic yeasts[J].Curr Opin Biotechnol,1997,8 (5):554-560.
[5]Sambrook J,Fritsch EF,Maniatis T.Molecular Cloning:A Laboratory Manual 2nd ed[M].New York:Cold Spring Harbor Laboratory Press,1989:366-373.
[6]Shao F,Xiong Y-M,Zhu R-H,et al.Protein Expr[J].Purif,1999,17(3):358.
[7]Pang S Z,Oberhaus S M,Rasmussen J L,et al.Expression of a gene encoding a scorpion insectotoxin peptide in yeast,bacteria and plants[J].Gene,1992,116:165-166.
[8]Martin-Eauclaire M F,Sogaard M,Rasmussen J L,et al.Production of active,insect-specific scorpion neurotoxin in yeast[J].European Journal JBiochem,1994,223(2):637.
[9]唐元家,余柏松.巴斯德毕赤酵母表达系统[J].国外医药抗生素分册,2002,23(6):346.
[10]李晶,赵晓祥,沙长青,等.甲醇酵母基因表达系统的研究进展[J].生物工程进展,1999,19(2):17-20.
[11]欧阳立明,张惠展,张嗣同.巴斯德毕赤酵母的基因表达系统研究进展[J].生物化学与生物物理进展,2000,27(2): 151-154.
[12]彭毅,杨希才,康良仪.影响甲醇酵母外源蛋白表达的因素[J].生物技术通报,2000,4:33-36.
[13]EasySelect Pichia Expression Kit,Catalog no.[M]K1740-01,Invitrogen.
[14]Adriaan van Kooij,a Jeena Middel,a Ferenc Jakab,et al.High level expression and secretion of truncated forms of herpes simplex virus type I and type II glycoprotein D by the methylotrophic yeast Pichia pastoris[J].Protein Expression and Purification,2002,25:400-408.
[15]Michiro Muraki.Secretory expression of synthetic human Fas ligand extracellular domain gene in Pichia pastoris:Influences of tag addition and N-glycosylation site deletion,and development of a purification method[J].Protein Expression and Purification,2006,50(2):137-146.
[16]Chen Z,Wang D,Cong Y,et al.Recombinant antimicrobial peptide hPAB-β expressed in Pichia pastoris,a potential agent active against methicillin-resistant Staphylococcus aureus[J].Appl Microbiol Biotechnol,2011,89(2):281-291.
[17]吕猛,王昆,曹志贱,等.东亚钳蝎毒素BmαTX14的基因组克隆、真核表达纯化及功能的初步研究[J].生物工程学报,2005,21(6):853-857.
[18]Feng Shao,Yu-Mei Xiong,Rong-Huan Zhu,et al.Expression and Purification of the BmK M1 Neurotoxin from the Scorpion Buthus martensii Karsch[J].Protein Expression and Purification,1999,17:358-365.
Expression of a Lung Targeted Fusion Protein AGAP in Pichia pastoris
MA Jian-rong1,YU Yong-hong1,ZHANG Jing-hai2
(1.Exp.Ctr.,Guangdong Food and Drug Vocat’l Coll.,Guangzhou 510520; 2.Sch.of Life Sci.&Biopharm.,Shenyang Pharm.Uni.,Shenyang 110016)
A constructed plasmid pPIC9K-RGD-4C-His Tag-AGAP(analgesic-antitumor peptide)was linearized with single enzyme digestion and electroporation transformed into Pichia pastoris GS115,the transformed colonies were screened through colony PCR and finally obtained positive ones.And they were proliferated,and the supernatant SDSPAGE after induced with methanol and tested proved with western blot that fusion protein of lung targeted RGD-4C-His Tag-AGAP was expressed successfully.
East Asian pincers scorpion(Buthus martensii Karsch);AGAP;Pichia pastoris;eukaryotic expression
Q786
A
1005-7021(2011)01-0015-04
国家自然科学基金(30772738);沈阳市科技局沈阳市药学生物技术重点实验室建设基金(1081102-1-00)
马建荣女,硕士。从事生物技术和生物信息学等方面研究。Tel:020-28854174,E-mail:ma_jianrong@yahoo.com.cn
*通讯作者。Tel:024-23986431,E-mail:Jinghaizhang2000@yahoo.com.cn
2010-10-26;
2011-01-20
