两种非对称芳基二噻吩并[2,3-b:3′,2′-d]噻吩的合成与光谱特性
2011-09-24王治华
王治华,王 振,王 华*
(1.河南大学化学化工学院,河南开封 475004; 2.河南大学特种功能材料教育部重点实验室,河南开封 475004)
两种非对称芳基二噻吩并[2,3-b:3′,2′-d]噻吩的合成与光谱特性
王治华1,2,王 振2,王 华1,2*
(1.河南大学化学化工学院,河南开封 475004; 2.河南大学特种功能材料教育部重点实验室,河南开封 475004)
合成了两种非对称芳基取代的并三噻吩化合物.以2-溴-5-三甲基硅-二噻吩并[2,3-b:3′,2′-d]噻吩为原料,经脱除四甲基硅烷(TMS)和Suzuki偶联两步反应制备了2-噻吩基二噻吩并[2,3-b:3′,2′-d]噻吩,总产率为67.4%;以2-苯基二噻吩并[2,3-b:3′,2′-d]噻吩为原料,经N-溴代琥珀酰亚胺(简称NBS)溴代和Suzuki偶联两步反应制备了2-苯-5-噻吩基二噻吩并[2,3-b:3′,2′-d]噻吩,总产率为27.8%.产物经核磁共振谱(1H NMR,13C NMR)和质谱(MS)分析确认;利用紫外-可见分光光度法(UV-Vis)分析了合成产物的荧光特性.结果表明,由于苯基的存在,2-噻吩-5-苯基二噻吩并[2,3-b:3′,2′-d]噻吩分子的共轭体系增大,导致其吸收峰红移、发光能力减弱.
芳基并三噻吩;合成;光谱特性
Abstract:Two asymmetric aryl dithieno[2,3-b:3′,2′-d]thiophenes were synthesized.Namely,2-(thiophen-3-yl)dithieno[2,3-b:3′,2′-d]thiophene was synthesized in a total yield of 67.4%with 2-bromo-5-trimethylsilanyl-dithieno[2,3-b:3′,2′-d]-thiophene as the starting material,viaremoval of tetramethylsilane(TMS)group and Suzuki reaction.Then another asymmetric aryl dithieno[2,3-b:3′,2′-d]thiophene,2-phenyl-5-(thiophen-3-yl)dithieno[2,3-b:3′,2′-d]thiophene was synthesized in a total yield of 27.8%with 2-phenyldithieno[2,3-b:3′,2′-d]thiophene as raw material,viabromination by N-bromosuccinimide(NBS)combined with Suzuki reaction.Two title compounds were characterized by means of magnetic resonance spectroscopy and mass spectrometry.Their fluorescent characteristics were evaluated by means of ultraviolet-visible light(UV-Vis)spectrophotometry.Results indicate that 2-phenyl-5-(thiophen-3-yl)dithieno-[2,3-b:3′,2′-d]thiophene bearing phenyl group has a stronger conjugation system,showing red-shifted absorption spectra and decreased fluorescent intensity.
Keywords:aryl dithieno[2,3-b:3′,2′-d]thiophene;synthesis;spectroscopic properties
噻吩的稠环化合物——并噻吩最近几年作为有机半导体材料已经在有机薄膜晶体管(OTFTs)[1-2],有机发光二极管(OLEDs)[3]和有机太阳能电池(OSCs)[4]等领域得到了广泛应用.噻吩的稠环化合物同线性的噻吩齐聚物相比,噻吩环与环之间稠合在一起,可以避免噻吩环在成膜过程中发生偏转而带来的共轭结构变差,有利于分子间π电子云相互作用,使其表现出较强的分子内以及分子间的π-π相互作用,另外噻吩单元容易进行化学修饰,调控分子的物理和化学性质.利用噻吩、苯、联苯、芴等单元对稠合低聚噻吩进行端基取代,可以有效地调节分子的能级结构,提高材料的热稳定性与电导特性[5-7].
2007年作者课题组报道了利用三甲硅基作保护基团改良了的二噻吩并[2,3-b:3′,2′-d]噻吩的合成[8],制备了一系列对称的二芳基并三噻吩衍生物,并研究了其在碱性条件下的开环现象[9].本文以2-溴-5-三甲基硅-二噻吩并[2,3-b:3′,2′-d]噻吩和 2-苯基二噻吩并[2,3-b:3′,2′-d]噻吩为原料 ,通过脱 TMS 基团、Suzuki偶联[10]以及NBS溴代等反应制备出噻吩单取代以及噻吩和苯双取代的两种非对称芳基并三噻吩化合物,利用核磁共振、质谱对目标产物进行了结构表征,并研究了它们的光谱性质.
1 实验部分
1.1 仪器与试剂
熔点使用显微熔点测试仪(XT4-100型,北京科仪电光仪器厂)获取,氢谱和碳谱使用Bruker AVANCE 400 MHz核磁仪测定,质谱由 Trace DSQⅡ(Finnigan)气质联用仪(电子轰击能量70 eV)测得.
无水四氢呋喃(经金属钠、钾处理新蒸馏),噻吩硼酸和苯硼酸来自Pacific Chem公司,三苯基膦钯催化剂来自Acros公司,2-溴-5-三甲基硅-二噻吩并[2,3-b:3′,2′-d]噻吩(3)根据文献[11]方法合成,2-苯基二噻吩并[2,3-b:3′,2′-d]噻吩(5)为本实验室自制.其余试剂皆为分析纯.
1.2 合成路线
目标化合物的合成路线见图1.
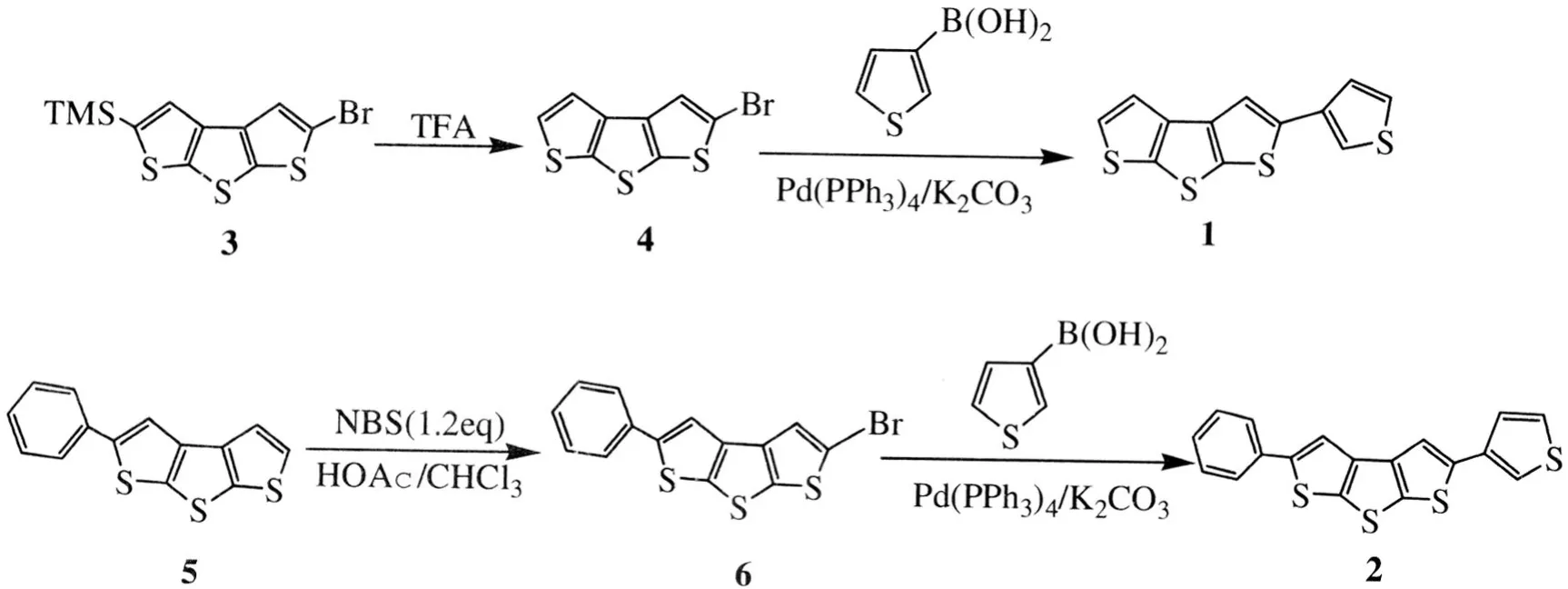
图1 化合物1和2的合成Fig.1 The synthetic route to 1 and 2
1.3 2-溴-二噻吩并[2,3-b:3′,2′-d]噻吩 (4) 的合成与表征
向50 mL 烧瓶中加入 2-溴-5-三甲基硅-二噻吩并[2,3-b:3′,2′-d]噻吩(280.0 mg,0.81 mmol)和CHCl3(10 mL),搅拌溶解.加入 TFA(0.6 mL,过量),反应30 min.加入水(15 mL)淬灭反应.水相用CHCl3(3×15 mL)萃取.有机相依次用水(20 mL)、饱和碳酸氢钠溶液 (20 mL)、水 (20 mL)洗涤.经无水硫酸镁干燥,再经硅胶柱层析分离(洗脱剂为石油醚)得白色固体,即化合物4,180 mg(产率81.4%).熔点108~110 ℃.1H NMR(400 MHz,CDCl3)δ:7.39(d,J=4.6 Hz,2H),7.31(d,J=5.2 Hz,1H);13C NMR(100 MHz,CDCl3)δ:138.56,138.09,137.66,137.37,127.97,122.04,118.62,112.72;MS(EI,70 eV):m/z=276(95)[M++1],274(91)[M+-1].
1.4 2-噻吩基二噻吩并[2,3-b:3′,2′-d]噻吩 (1)的合成与表征
将2-溴-二噻吩并[2,3-b:3′,2′-d]噻吩(75.0 mg,0.27 mmol)和三苯基膦钯催化剂(10 mg,0.008 mmol)溶于 THF(8 mL),室温下搅拌15 min后加入噻吩硼酸(40.0 mg,0.31 mmol)和碳酸钾溶液 (1.5 mL,2 mol/L).加热回流(油温100~110℃)过夜,TLC检测没有原料时降至室温加水淬灭反应.加入水(15 mL)和乙醚(15 mL)振荡分层,水相用乙醚(3×15 mL)萃取,合并有机相.有机相分别用饱和氯化钠溶液(15 mL)、水(2×15 mL)洗涤,经无水硫酸镁干燥,再经硅胶柱层析分离(洗脱剂为石油醚)得白色固体,即化合物1,63 mg(产率82.8%).熔点138~139 ℃.1H NMR(400 MHz,CDCl3)δ:7.46(s,1H),7.50(s,1H),7.42~7.34(m,5H);13C NMR(100 MHz,CDCl3)δ:141.51,138.62,138.60,138.42,137.13,135.78,127.66,126.53,125.84,119.71,118.75,114.74;MS(EI,70 eV):m/z=277.81(100)[M+].
1.5 2-溴-5-苯基二噻吩并[2,3-b:3′,2′-d]噻吩 (6)的合成与表征
向50 mL圆底烧瓶中加入2-苯基二噻吩[2,3-b:3′,2′-d]并噻吩(2)(43 mg,0.16 mmol)和12 mL CHCl3-HOAc(1∶2,V/V)溶剂,搅拌至完全溶解后分批缓慢加入N-溴代琥珀酰亚胺(NBS)(34 mg,0.19 mmol),室温反应2 h.向反应液中加入水 (10 mL)和CHCl3(10 mL),振荡分层,水相用CHCl3(10 mL)萃取,合并有机相,有机相分别用水(10 mL),饱和碳酸氢钠溶液(10 mL ×3),水(10 mL)洗涤.经无水硫酸镁干燥,再经硅胶柱层析分离(洗脱剂为石油醚)得化合物6,36 mg(产率64.9%).熔点146~149℃.1H NMR(400 MHz,CDCl3)δ:7.62(d,J=7.3 Hz,2H),7.50(s,1H),7.42(t,J=7.6 Hz,2H),7.39(s,1H),7.32(t,J=7.4 Hz,1H);13C NMR(100 MHz,CDCl3)δ:147.34,138.55,137.74,137.57,137.32,134.47,129.07,127.96,125.83,122.04,114.47,112.90;MS(EI,70 eV):m/z=351.79(100)[M++2].
1.6 2-苯-5-噻吩基二噻吩并[2,3-b:3′,2′-d]噻吩 (2)的合成与表征
将2-溴-二噻吩并[2,3-b:3′,2′-d]噻吩(97.0 mg,0.27 mmol)和三苯基膦钯催化剂(10 mg,0.008 mmol)溶于 THF(10 mL),室温下搅拌15 min后加入噻吩硼酸(38.8 mg,0.30 mmol)和碳酸钾溶液 (1.5 mL,2 mol/L).加热回流(油温100~110℃)过夜,TLC检测没有原料时降至室温加水淬灭反应.加入水(15 mL)和乙醚(15 mL)振荡分层,水相用乙醚(3×20 mL)萃取,合并有机相.有机相分别用饱和氯化钠溶液(15 mL),水(2×15 mL)洗涤,经无水硫酸镁干燥,再经硅胶柱层析分离(洗脱剂为石油醚)得白色固体,即化合物2,41 mg(产率42.8%).熔点205~206 ℃.1H NMR(400 MHz,d-DMSO)δ:7.91(s,1H),7.79(s,1H),7.78~7.77(m,1H),7.71~7.68(m,3H),7.50~7.45(m,3H),7.35(t,J=7.2 Hz,1H);13C NMR(100 MHz,d-DMSO)δ:145.97,141.24,138.63,138.25,137.93,137.04,135.24,134.06,129.23,127.82,127.69,125.69,125.16,120.28,115.23,115.21;MS(EI,70 eV):m/z=353.86(100)[M+].
2 结果与讨论
2.1 反应特点
化合物4的制备方法有两种:一是由化合物二噻吩并[2,3-b:3′,2′-d]噻吩在氯仿和醋酸的混合溶剂(V/V=1∶1)中与0.6 eq的NBS反应得到单溴代化合物4、双溴代化合物以及二噻吩并[2,3-b:3′,2′-d]噻吩的混合物,经用 G硅胶进行柱层析分离得化合物4.按 NBS量计算其产率达到80%左右,但是分离过程相当复杂,整个反应过程需 TLC监控.二是以作者实验室由2,5-二(三甲基硅)二噻吩[2,3-b:3′,2′-d]并噻吩高产率制备的化合物3为原料,与过量 TFA反应脱去 TMS基团.这种方法总产率也达到80%以上,分离比较简单.因此作者采用后一种方法制备化合物4.
目标化合物的制备是通过Suzuki偶联反应进行的,Suzuki偶联反应的形式主要有两种:芳基硼酸或其硼酸酯和卤代物在催化剂存在下形成新的碳碳键.Suzuki偶联反应的催化循环过程通常认为先是Pd(0)与卤代芳烃发生氧化-加成反应、金属转移反应,最后进行还原-消除而生成产物和Pd(0).
在参考相关文献[10]的基础上,经过实验条件摸索,发现该类反应对氧气较为敏感,而对水不敏感.反应需要无氧环境,即可用氩气保护;反应溶剂选择四氢呋喃效果较好;同时发现碳酸钾的催化活性明显好于碳酸钠;此外,适当延长反应时间对反应有利,一般要回流过夜.
2.2 化合物的光谱行为
由图2可知化合物1在250~350 nm范围内有两个吸收谱带.其峰位在274 nm与312 nm.其中在312 nm左右的吸收峰归属于整个分子共轭体系中的π-π*跃迁.和化合物1相比,由于苯环的取代,分子的共轭体系的增加,化合物2的吸收峰变得宽散,并且最大吸收峰明显红移,峰位为320 nm.
由图3可知化合物1和2在氯仿中的荧光发射峰强度均较弱,并且没有明显的精细结构,位置分别在374 nm与380 nm,峰位差异较小,说明苯基对并三噻吩母体的电子效应影响较小,激发态下没有出现显著的分子内电荷转移态.另一方面,与化合物1相比,化合物2的峰强度较弱说明了化合物2可能因为两侧取代基的单键旋转,使其激发态下因分子的转动而导致激发态分子能量的损耗大于化合物1,从而致使荧光发射强度减弱.
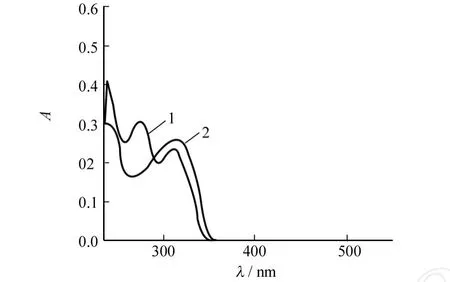
图2 室温下1,2的氯仿溶液的吸收光谱Fig.2 UV-Vis spectra of 1,2 in chloroform at room temperature
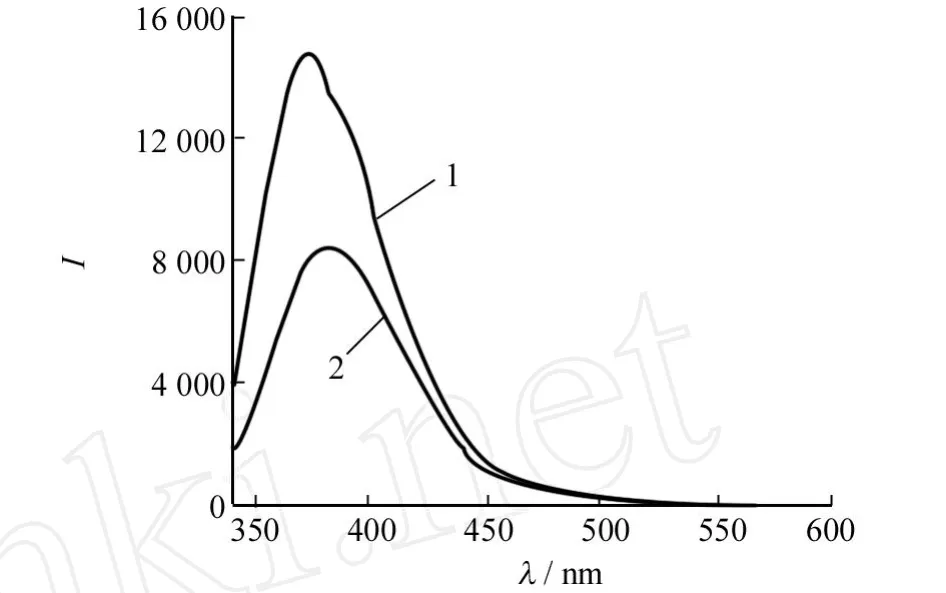
图3 室温下1,2的氯仿溶液的荧光发射光谱Fig.3 Fluorescence spectra of compound 1,2
结论:综上所述,采用Suzuki偶联反应成功制备了两种不对称的芳基二噻吩并[2,3-b:3′,2′-d]噻吩衍生物.通过UV-Vis和荧光光谱表征,发现分子的结构对光谱行为存在明显的影响,与化合物1相比,由于苯基的存在,化合物2分子的共轭体系增大,导致了吸收峰的红移与发光能力的下降.研究工作对该类化合物应用于有机功能材料提供了理论依据与素材.
[1]LI Xiao Chang.SIRRINGHAUS H,GARNIER F,et al.A highlyπ-stacked organic semiconductor for thin film transistors based on fused thiophenes[J].J Am Chem Soc,1998,120(9):2206-2207.
[2]XIAO Kai,LIU Yun Qi,QI Ting,et al.A highlyπ-stacked organic semiconductor for field-effect transistors based on linearly condensed pentathienoacenes[J].J Am Chem Soc,2005,127(38):13281-13286.
[3]MAZZEO M,VITAL E V,DELLA SALA F,et al.Bright white organic light-emitting devices from a single active molecular material[J].Adv Mater,2005,17(1):34-39.
[4](a)LIANG Yong Ye,FENG Dan Qin,WU Yue,et al.Highly efficient solar cell polymers developed via fine-tuning of structural and electronic properties[J].J Am Chem Soc,2009,131(22):7792-7799.(b)LIANG Yong Ye,WU Yue,FENG Dan Qin,et al.Development of new semiconducting polymers for high performance solar cells[J].J Am Chem Soc,2009,131(1):56-57.
[5]MENG Hong,ZHENGJie,LOVINGER A J,et al.Oligofluorene-thiophene derivatives as high-performance semiconductors for organic thin film transistors[J].Chem Mater,2003,15(9):1778-1787.
[6]TIAN Hong Kun,SHIJian Wu,HE Bo,et al.Naphthyl and thionaphthyl end-capped oligothiophenes as organic semiconductors:effect of chain length and end-capping groups[J].Adv Funct Mater,2007,17(12):1940-1951.
[7]SUN Yan Ming,MA Yong Qiang,LIU Yun Qi,et al.High-performance and stable organic thin-film transistors based on fused thiophenes[J].Adv Funct Mater,2006,16(3):426-432.
[8]WANG Yang Guang,WANG Zhi Hua,WANG Hua,et al.Efficient synthesis of trimethylsilyl-substituted dithieno[2,3-b:3′,2′-d]thiophene,tetra[2,3-thienylene]and hexa[2,3-thienylene]from substituted[3,3′]bithiophenyl[J].Synlett,2007,15:2390-2394.
[9]WANG Zhen,ZHAO Chun Mei,ZHAO Dong Feng,et al.The preparation of substituted bithiophenyl aldehydes via the ring opening of dithieno[2,3-b:3′,2′-d]thiophene in the presence of n-BuLi[J].Tetrahedron,2010,66:2168-2174.
[10]荣国斌.有机人名反应及机理[M].上海:华东理工大学出版社,2003:401.
[11]LI Chun Li,SHI Jian Wu,XU Li,et al.Syntheses and crystal structures of fused thiophenes:[7]helicene and double helicene,a D2-symmetric dimer of 3,3′-bis(dithieno[2,3-b:3′,2′-d]thiophene)[J].J Org Chem,2009,74(1):408-411.
Synthesis and spectroscopic properties of two asymmetric aryl dithieno[2,3-b:3′,2′-d]thiophenes
WANG Zhi-hua1,2,WANG Zhen2,WANG Hua1,2*
(1.College of Chemistry and Chemical Engineering,Henan University,Kaif eng475004,Henan,China;
2.Key L aboratory of Ministry of Education f or S pecial Functional Materials,Henan University,Kaif eng475004,Henan,China)
O 626.12
A
1008-1011(2011)01-0022-04
2010-08-19.
国家自然科学基金资助项目(20672028,50701016,50803015);教育部基金资助项目(NCET-05-0610).
王治华(1977-),女,讲师,博士,研究方向为有机功能材料.*
,E-mail:hwang@henu.edu.cn.
