几种益生菌对大菱鲆幼鱼生长及消化酶活性的影响
2011-09-24高凤祥胡发文菅玉霞张少春
高凤祥, 郭 文, 潘 雷, 胡发文, 菅玉霞, 张少春, 王 雪
(山东省海水养殖研究所, 山东 青岛 266071)
几种益生菌对大菱鲆幼鱼生长及消化酶活性的影响
高凤祥, 郭 文, 潘 雷, 胡发文, 菅玉霞, 张少春, 王 雪
(山东省海水养殖研究所, 山东 青岛 266071)
作者以初体质量为(4.80±0.11)g的大菱鲆(Scophthalmus maximus)为研究对象, 在循环水水族箱中进行 60 d饲喂实验, 研究饵料中添加单一益生菌和复合益生菌对大菱鲆生长及消化道酶活性的影响。以基础饲料为对照组, 在基础饲料中分别添加枯草芽孢杆菌(Bacillus subtilis)、地衣芽孢杆菌(Bacillus licheniformis)、复合芽孢杆菌组(1 : 1)、嗜酸乳酸杆菌(Lactobacillus acidophilus)、双歧杆菌(Bifidobacterium inopinatum)、复合乳酸菌组(1 : 1)、复合益生菌(1 : 1 : 1 : 1), 每克饲料约含菌3.0×109个/g干质量, 共配制 7种实验饲料。实验结果显示, 复合益生菌饲喂组大菱鲆的存活率和特定生长率显著高于对照组(P<0.05), 而单一益生菌饲喂组与对照组差异不显著(P>0.05)。饲料中添加益生菌能使大菱鲆消化道蛋白酶、脂肪酶和淀粉酶活力升高, 其中添加复合益生菌的实验组消化道酶活性显著高于对照组(P<0.05)。上述实验结果表明, 与饲喂单一益生菌相比, 添加复合益生菌对提高大菱鲆存活率, 促进大菱鲆的生长具有更显著的促进作用。
大菱鲆(Scophthalmus maximus); 益生菌; 生长; 消化酶活性
大菱鲆(Scophthalmus maximus)作为一种低温经济鱼类, 1992年被引入中国, 由于其生长速度快, 肉质好, 养殖和市场潜力大等优势, 近年来已成为中国北方沿海重要的养殖品种。但随着大菱鲆集约化养殖的迅猛发展, 由于片面的追求经济效益, 养殖密度过大, 养殖水体中自然生态体系的平衡被打破,自身污染严重。此外, 由于工业废水、生活污水的乱排乱放, 导致养殖水环境恶化, 养殖对象病害频发。
养殖业者目前多数依赖广谱性抗生素来控制病害的发生, 但由于抗生素本身不仅残留性强, 更会引起细菌抗药性, 从而进一步破坏养殖水域正常生物区系的平衡, 严重影响了大菱鲆产业的健康持续发展。事实上, 长期使用抗生素和其他化学药物防治养殖病害已引发了一系列环境和社会问题[1-2]。为解决养殖病害和食品安全等诸多矛盾, 寻找新的绿色环保的抗生素替代品是目前的研究热点。
益生菌(Probiotics)是指在一定浓度范围内可以增进健康的活体微生物制剂, 作为抗生素的替代品, 其应用在近几年已得到迅速发展。综合目前文献的报道,大多数益生菌的益生作用主要体现在防治消化道疾病、帮助消化吸收和刺激免疫系统3个方面[3-5], 非常适合做为水产品的饵料添加剂。将益生菌直接添加到养殖水体中, 可用于防止水产品被病原微生物感染、调节养殖水体的微生态环境, 改善局部水体环境,达到健康养殖、稳产高产的方法已初显成效。
益生菌一般由多种有益微生物组成, 主要包括芽孢杆菌(Bacillusspp.)、乳酸菌(Lactobacillusspp.)、弧菌(Vibriospp.)和酵母菌(Saccharomycesspp.)等。大多数的益生菌是从水生动物肠道内以及自然养殖水体中分离纯化得到的, 对养殖生物不具有生态危害性, 在目前的水产养殖中已经广泛应用[6-7]。
首例被用于水产养殖生产实践中的益生菌是芽孢杆菌, Laurent等[8]在1998年把它应用于日本鳗鲡(Anguilla japonica)养殖中, 将其投放到养殖水体中从而减少了由病原菌(Edwardsiellasp.)引起的鳗鱼大量死亡。芽孢杆菌是一种非致病菌, 可耐酸、耐碱、耐高温和挤压, 是所有益生菌中稳定性最强的一种。芽孢杆菌以内孢子的形式存在于肠道微生物群落中,孢子在生长过程中能产生乙酸、丙酸、丁酸等挥发性脂肪酸, 可降低消化道内 pH和氨的含量, 同时还能产生大量的维生素B和维生素C[9]。
水产养殖生产实践中另一种常用益生菌是乳酸菌, 厌氧或兼性厌氧, 不能形成芽孢, 稳定性较低。乳酸菌如果在鱼肠道系统大量定植, 可以抵抗革兰氏阴性致病菌(Vibrio anguillarum), 增强机体抗感染能力, 增加肠黏膜的免疫调节活性, 促进鱼类生长,提高抗病力[10]。从牙鲆(Paralichthys oliuaceus)肠道分离的乳酸菌, 可以降低水中和肠道中有害菌的数量, 提高成活率, 促进生长[11]。
石军等[12]指出, 乳酸菌能分泌细菌素、H2O2、有机酸等物质, 可降低消化道环境pH值而抑制肠道有害微生物的生长和繁殖, 这与 Ring[13]和 Lewus等[14]的结论相似, 也与陆生动物益生菌细菌素的研究结论相似。
作者以大菱鲆幼鱼为研究对象, 旨在探讨大菱鲆苗种培育养殖生产实践中, 在饲料中直接添加单一及复合种类的常见益生菌对大菱鲆幼鱼的生长以及对部分免疫指标的影响, 从而为益生菌在大菱鲆养殖中的直接应用提供理论依据。本次实验选用的芽孢杆菌种类为枯草芽孢杆菌(Bacillus subtilis)和地衣芽孢杆菌(Bacillus licheniformis), 选用的乳酸菌种类为嗜酸乳酸杆菌(Lactobacillus acidophilus)和双歧杆菌(Bifidobacterium inopinatum)。
1 材料与方法
1.1 实验用鱼及分组
实验于2008年4月15日至6月15日在山东省海水养殖研究所中试基地实验室进行, 实验用大菱鲆体质健康, 体长5~6 cm。在海水良种繁育中心实验室暂养一周后随机分为8组: 对照组、枯草芽孢杆菌组、地衣芽孢杆菌组、地衣芽孢杆菌+枯草芽孢杆菌(质量比为1∶1)、嗜酸乳酸杆菌组、双歧杆菌组、嗜酸乳酸杆菌+双歧杆菌(质量比为1∶1)组、地衣芽孢杆菌+枯草芽孢杆菌+嗜酸乳酸杆菌+双歧杆菌(质量比为组。每组3个重复, 每个重复100尾鱼, 养殖在循环水水族箱中。
1.2 实验用饲料
基础饲料以鱼粉、豆粕为主要原料配制饲料, 8组实验组除分别添加了不同菌种及比例的菌液外,各种营养成分均相同(实验中枯草芽孢杆菌及地衣芽孢杆菌单菌菌液购自山东济南大吉饲料有限公司,菌含量不小于 1010CFU/mL; 嗜酸乳酸杆菌及双歧杆菌干粉购自江苏沃尔德实业有限公司, 菌含量不小于 1010CFU/g)。
实验组是把菌液直接加入饲料中, 制成湿颗粒,于 40℃烘至半干, 然后在−20℃冰箱保存, 以备投喂。饲料约含菌3.0×109个/g干质量。
日投喂量为体质量的5%~10%, 分2次投喂。
1.3 饲养管理
分组后的实验用鱼养殖在循环水水族箱中, 每天换水 2次, 每次换水 1/2。每天投饵两次, 分别为7:30~8:30, 16:30~17:30, 投喂量以饱食为标准。每箱鱼投喂的饲料于投喂前和投喂后称质量。每次投喂前先吸取粪便, 投喂后吸取残饵, 将残饵过滤烘干保存, 以备计算摄食量。饲养条件恒定(水温17℃±1℃, 盐度32±0.2), 实验共进行60 d。
1.4 生长指标测定
实验起始、实验中期(第30天)和实验结束(第60天)时分别对各组幼鱼进行称质量。饲料常规成分分析参照AOAC[15]的方法。
特定生长率(special growth rate, 简称SGR)计算公式如下:
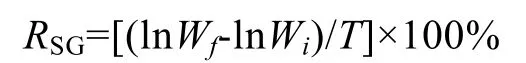
Wf、Wi分别表示平均终体质量(g)、平均初体质量(g);T表示饲养时间(d);
1.5 消化道酶活性的测定
1.5.1 粗酶液制备
第30天时, 每养殖箱各取3尾鱼测定酶活性。将活的大菱鲆鱼置于预先准备好的冰盘上解剖, 从鱼的肛门处剪开, 使其内脏暴露, 拉出整个消化道,截取胃至肛门前2~3 mm的消化道, 分别剪取胃、幽门盲囊, 将肠的非膨胀部分一分为二, 分为小肠前段, 小肠后段。具体作法如下: 每克组织加入灭菌的10 mL pH7.5的磷酸缓冲液, 在冰浴中匀浆。匀浆液于4℃静置1 h, 取上清液部分, 于 4℃、4 000 r/min离心30 min, 取上清液测定酶活性。
1.5.2 蛋白酶活性的测定
参照中山大学[16]Folin-酚法进行, 用上海分析仪器有公司生产的7230型分光光度计测定。蛋白酶活力单位定义为:在pH值7.5(测胃蛋白酶pH2.5), 底物酪蛋白浓度为5 g/L, 37 ℃条件下, 保温15 min, 以每克组织蛋白酶每分钟水解酪蛋白产生 1μg酪氨酸为一个活力单位(U)。
1.5.3 脂肪酶活性的测定
参照中山大学[16]和周玉言等[17]方法。用聚乙烯醇橄榄油乳化液水解法。脂肪酶活性定义为在pH7.5时, 37 ℃保温60 min, 以每克组织蛋白酶每分钟催化聚乙烯醇橄榄油产生1μmoL脂肪酸为1个脂肪酶活性单位(U)。
1.5.4 淀粉酶活性的测定
参照上海市医学化检所碘—淀粉显色法[18]。淀粉酶活性定义为在pH7.0时, 37 ℃条件下, 保温15 min内, 以每克组织蛋白酶每分钟完全水解1 mg可溶性淀粉为1个淀粉酶活性单位(U)。
在进行生物辐射影响评价时,经常会用到分级的评价结构。较低层级的评价颇为保守,但只需要极少的数据输入,多用于初步筛选;较高层级的评价则更为接近现实情况,结果更加准确,但相应的也需要更多的数据,尤其是当地的测量数据。在进行生物辐射影响评价时,通常会先采用较低层级的方法来进行筛选,对于可能出现影响的情况再进行高层级地仔细评价。
2 实验结果
实验数据采用SPSS16.0软件进行单因素方差分析。当差异显著时, 用Duncan检验法进行多重比较,差异显著度P为0.05,P<0.05说明有显著差异。
2.1 对大菱鲆幼鱼生长情况的影响
实验中期(第 30天)各实验组与对照组大菱鲆生长情况见表1。饲料中添加益生菌能不同程度地促进大菱鲆生长, 其中饲喂复合益生菌能显著提高大菱鲆的存活率和特定生长率(P<0.05), 其中地衣芽孢杆菌+枯草芽孢杆菌+嗜酸乳酸杆菌+双歧杆菌的复合益生菌组与对照组差异显著(P<0.05), 存活率也显著提高。
实验末期(第 60天)各实验组与对照组大菱鲆生长情况见表2。在饲料中添加复合益生菌仍能显著提高大菱鲆幼鱼的存活率和特定生长率, 其中嗜酸乳酸杆菌+双歧杆菌组和地衣芽孢杆菌+枯草芽孢杆菌+嗜酸乳酸杆菌+双歧杆菌的复合益生菌组与对照组差异显著(P<0.05)。
整个实验阶段各实验组与对照组大菱鲆生长情况见表3。添加益生菌的各实验组存活率, 特定生长率都有不程度的提高。其中使用复合益生菌的 3组特定生长率与对照组差异显著(P<0.05)。 嗜酸乳酸杆菌+双歧杆菌组和地衣芽孢杆菌+枯草芽孢杆菌+嗜酸乳酸杆菌+双歧杆菌的复合益生菌组的存活率,特定生长率与对照组相比均有显著提高(P<0.05)。
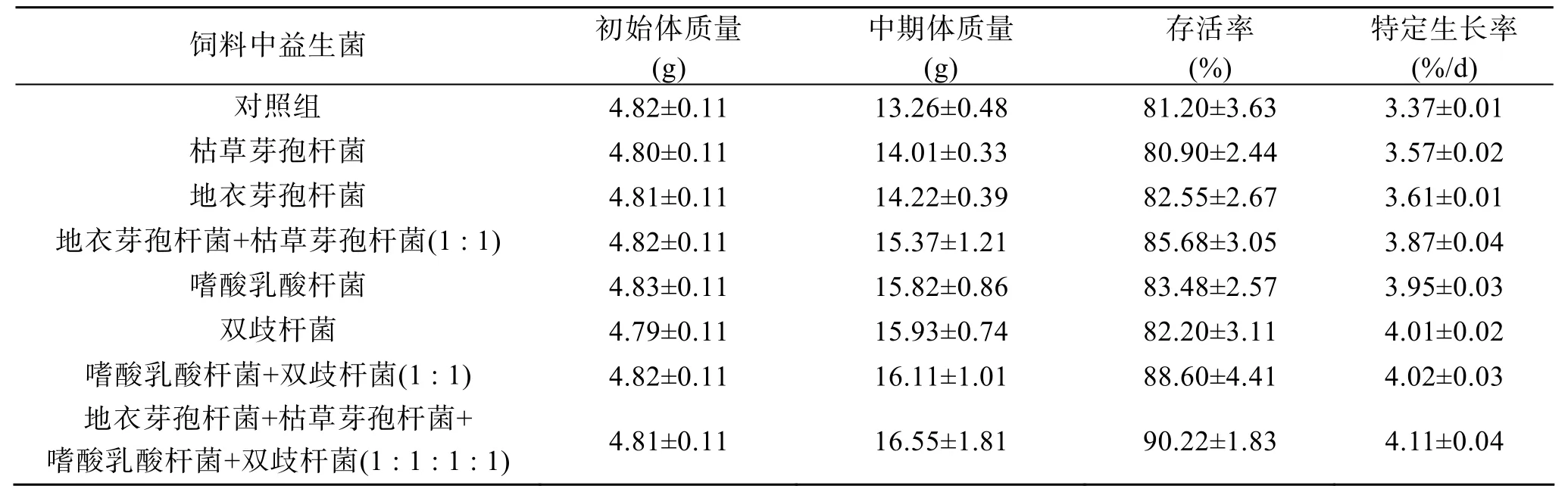
表1 实验中期大菱鲆存活率及特定生长率(第0~30天)Tab. 1 Survival and special growth rates ofScophthal musmaximusafter different dietary administrations of probiotics (0~30day) n=3; X±SE
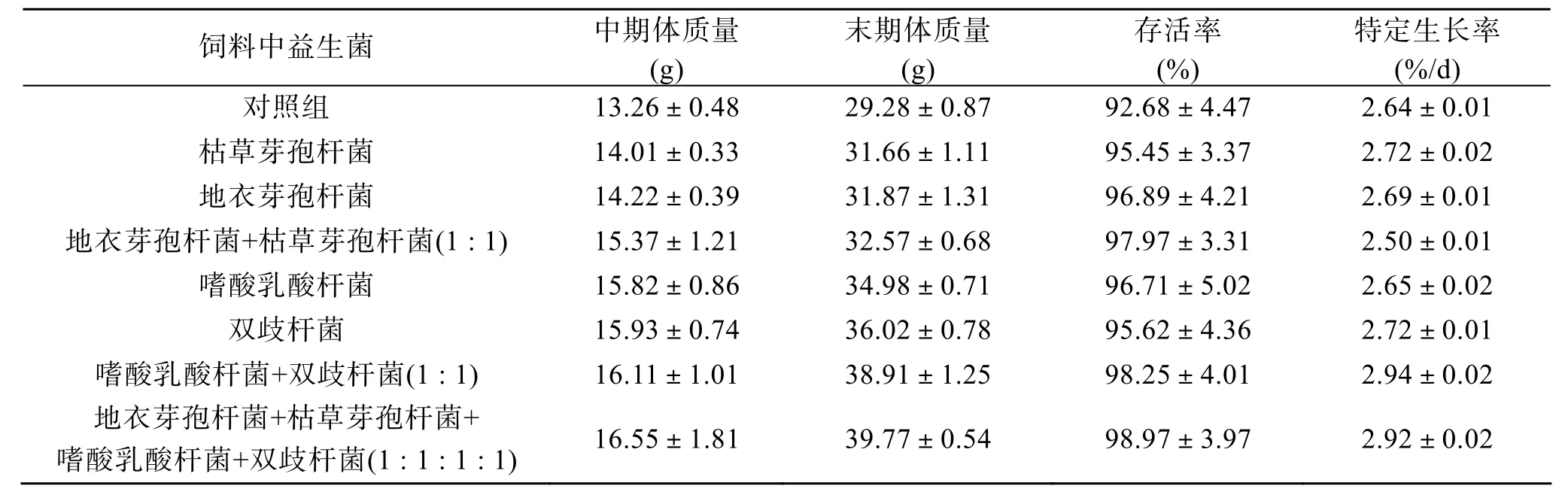
表2 实验末期大菱鲆存活率及特定生长率(第30~60天)Tab. 2 Survival and special growth rates ofScophthal musmaximusafter different dietary administrations of probiotics (30~60 day) n=3; X±SE
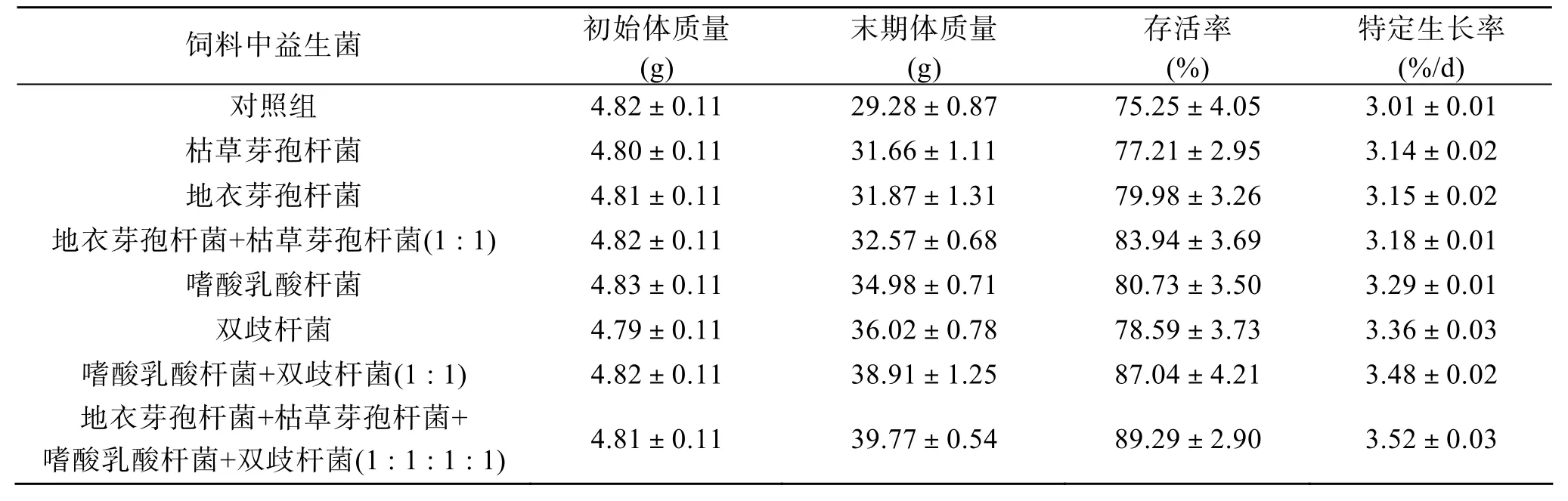
表3 实验全期大菱鲆存活率及特定生长率(第0~60天)Tab. 3 Survival rate (SR) and special growth rate (SGR) ofScophthal musmaximusafter different dietary administrations of probiotics (0~60day) n=3; X ±SE
2.2 对消化道蛋白酶活性的影响
添加了益生菌的各实验组均能提高大菱鲆幼鱼消化道中蛋白酶活性见表4, 其中添加了地衣芽孢杆菌+枯草芽孢杆菌和地衣芽孢杆菌+枯草芽孢杆菌+嗜酸乳酸菌+双歧杆菌的两个复合益生菌实验组与对照组相比差异最为显著(P<0.05), 效果最好。

表4 不同益生菌成分对大菱鲆消化道蛋白酶活性的影响Tab. 4 Effect of different dietary administrations of probiotics on the proteases activity in digest tract ofScophthal Musmaximus n=3; X±SE
2.3 对消化道脂肪酶活性的影响
添加了益生菌的各实验组均能提高大菱鲆幼鱼消化道中脂肪酶活性见表5。整体来看, 添加乳酸菌益生菌的实验组在提高消化道脂肪酶活性方面效果要好于添加芽孢杆菌的实验组。添加单一及复合乳酸菌的实验组之间差异不大(P>0.05)。
2.4 对消化道淀粉酶活性的影响
添加益生菌的各实验组与对照组的消化道淀粉酶活性见表6。其中添加单一芽孢杆菌的两个实验组与对照组相比无显著差异(P>0.05)。其他实验组与对照组差异较为显著(P<0.05), 但其他实验组之间差异不显著(P>0.05)。
3 讨论
在本研究中, 饲料中添加益生菌均能促进大菱鲆幼鱼生长, 与 Gatesoupe[19]的研究结果相似, 此外, 其他在水产动物的饲料中添加益生菌的相关研究也取得了相似的结论, 如斑节对虾(Penaeus monodon)[20]、凡纳滨对虾(Litopenaeus vannamei)[21]、鲤鱼(Cyprinus carpio)[22]、银鲫(Carassius auratus)[23]以及牙鲆(Paralichthys olivaceus)[24]。
Smoragiewicz等[25]发现定居于胃肠道的菌群可以作为营养成分被宿主吸收, 同时宿主也可以把一些环境中的有毒物质以及食物中的无营养成分分解为养料吸收。Douillet等[26]研究认为肠道菌可提供幼体生长所必需的营养物质, 促进动物生长, 提高成 活率。
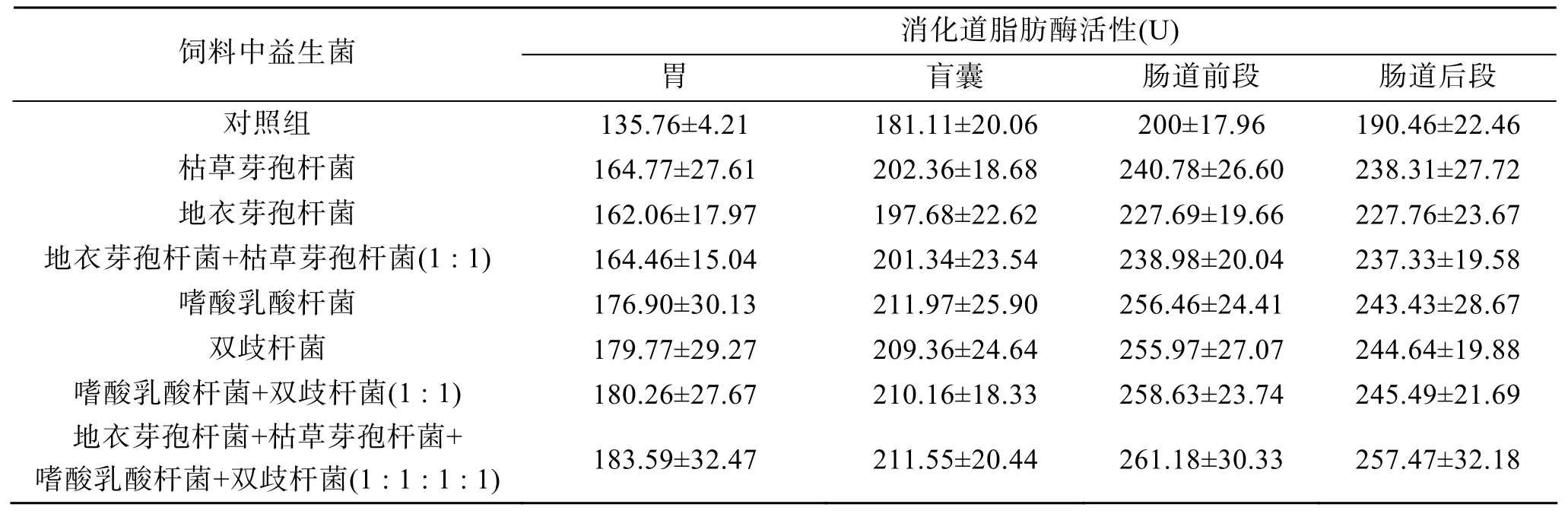
表5 不同益生菌成分对大菱鲆消化道脂肪酶活性的影响Tab. 5 Effect of different dietary administrations of probiotics on the lipase activity in digest tract ofScophthal musmaximus n=3; X ±SE
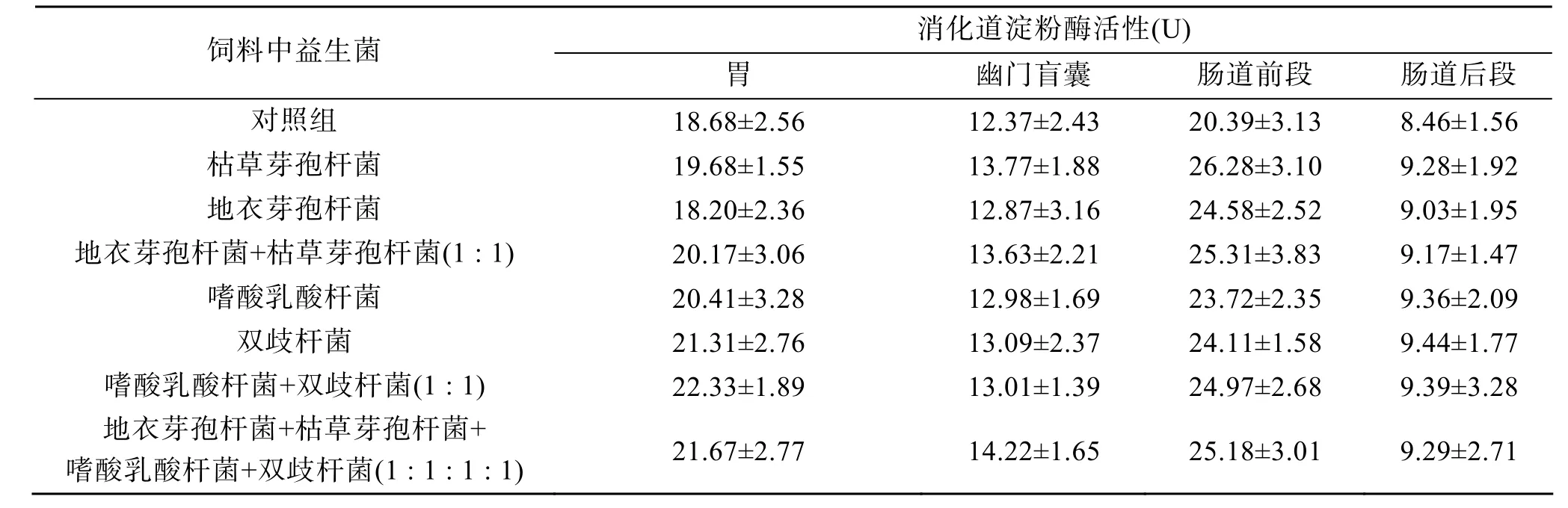
表6 不同益生菌成分对大菱鲆消化道淀粉酶活性的影响Tab. 6 Effect of different dietary administrations of probiotics on the amylase activity in digest tract ofScophthal musmaximus n=3; X±SE
相关研究表明, 作为饵料添加剂的许多益生菌,除了本身可以帮助动物对食物进行消化, 提高饲料的利用效率之外, 其菌体本身就含有大量的营养物质, 如酵母菌、光合细菌等含有丰富的菌体蛋白和多种维生素等微量营养物质、可以供给动物生长需要[27]。虽然益生菌的作用更多在于其对体内微生态的调节, 并改善宿主动物的健康状况, 但它的营养作用也是值得注意的。
益生菌对大菱鲆幼鱼的促生长机理可能与饲喂益生菌后对大菱鲆肠道消化酶活性的提高有关[11]。本研究结果表明, 饲料中添加各种益生菌均能提高大菱鲆幼鱼消化道酶活性, 其活性大小与生长表现为一定的相关性。复合芽孢杆菌在提高大菱鲆幼鱼消化道蛋白酶活性方面效果更为显著, 而乳酸菌在提高大菱鲆幼鱼消化道脂肪酶及淀粉酶方面效果更为明显。
在本实验中复合益生菌组有比单一益生菌更好的生长效果, 这一结果与 Salinas等[28]在乌颊鱼(Sparus auratus)中发现芽孢杆菌和乳酸菌的复合菌比单一的芽孢杆菌和乳酸菌有更好的添加效果相似。这可能是因为不同细菌在肠道微生物区系中占有不同的生态位, 相互之间制约、平衡而不至于某一菌种成为优势种而破坏肠道微环境的平衡, 因而添加复合益生菌组有比添加单一益生菌更好的免疫及生长效果。
4 结论
本实验条件下, 饲料中添加益生菌可促进大菱鲆幼鱼生长, 提高消化道酶活性, 并且添加复合益生菌的效果要好于单一益生菌, 这一结果对实际养殖生产和商业饵料中益生菌的添加均有指导作用。在实际应用中, 可将几种益生菌复合使用, 关于使用的最佳比例, 还有待于进一步的研究。
[1] 许兵, 纪伟尚, 张鹏, 等. 对虾病原菌抑菌药物的研究[J]. 青岛海洋大学学报, 1993, 23(2): 43-51.
[2] Boyd C E, Massaaut L. Risks associated with the use of chemicals in pond aquaculture[J]. Aqua Engin, 1999,20(2): 113-132.
[3] 李海斌, 宋晓玲, 等. 水产动物益生菌研究进展[J].动物医学进展, 2008, 29(5): 94-99.
[4] 张艳, 李秋芬, 王印庚, 等. 益生菌的研究现状及其在海水养殖中的应用[J]. 海洋水产研究, 2005, 26(6):83-87.
[5] 周国勤, 陈树桥, 茆建强, 等. 益生菌在水产养殖方面的研究进展[J]. 安徽农业科学, 2006, 34(11): 2 421-2 425.
[6] 俞勇, 俞会荣, 李筠, 等. 益生菌制剂在水产养殖中的应用[J]. 中国水产科学, 2001, 8(6): 92-96.
[7] 马悦欣, 吴垠, 刘长发, 益生菌做为生物控制剂在水产养殖中的应用[J]. 大连水产学院学报, 2003, 18(3):180-185.
[8] Laurant Verscuere, Geert Rombaut, et al. Probiotic bacteria as biological control agents in aquaculture[J].Microbiology and Molscular Biology Reviews, 64 (4):655-671.
[9] 邱宝生, 林炜铁, 杨继国, 等. 益生菌在水产养殖中的应用[J]. 水产科学, 2004, 23(7): 39-41.
[10] Gildberg A, Mikkelsen H, Sandaker E, et al. Probiotic effect of lactic acid bacteria in the feed on growth and survival of fry of Atlantic cod(Gadus morhua)[J]. Hydrobiologia, 1997, 352(123): 279-285.
[11] 王福强. 牙鲆肠道益生菌的分离鉴定及其应用研究[D]. 北京: 中国农业大学, 2004.
[12] 石军, 陈安国, 邵明丽. 益生菌在水产养殖中应用的研究进展[J]. 粮食与饲料工业, 2002, 4 :29-31.
[13] Ring E, Gatesoupe F J. Lactic acid baceria in fish: A review[J]. Aquaculture, 1998, 160(324): 177-203.
[14] Lewus C B, Kaiser A, Montville T J. Inhibition of food-borne bacterial pathogens by bacteriocins from lacticacid bacteria isolated from meat[J]. Appl Environ Microbiol, 1991, 57(6): 1 683-1 688.
[15] AOAC. Official methods of analysis of official analytical chemists international[M]. 16th ed. Arlington,VA: Association of offcial chemists, 1995: 43-45.
[16] 中山大学生物系生化微生物学教研室. 生化技术导论[M]. 北京: 人民教育出版社. 1978: 53-54.
[17] 周玉言, 饲用酶制剂及其应用[J]. 饲料工业, 1992,13(7): 12-15.
[18] 周德庆, 微生物学实验手册[M]. 上海: 上海科学技术出版社, 1986: 12.
[19] Gatesoupe F J, Arakawa T, Watanabe T. The effect of bacterial additives on the production rate and dietary value of rotifers as food for Japanese flounder,Paralichthys olivaceu[J]. Aquaculture, 1989, 83: 39-44.
[20] Moriarty D J W. Control of luminous vibrio species in penaeid aquaculture ponds[J]. Aquaculture, 1998, 164:351-358.
[21] 胡毅, 谭北平, 麦康森, 等. 饲料中益生菌对凡纳滨对虾生长、肠道菌群及部分免疫指标的影响[J]. 中国水产科学, 2008, 15(2): 244-251.
[22] 张锦华, 倪学勤, 何后军, 等. 不同益生素对鲤鱼肠道蛋白酶、淀粉酶活力的影响[J]. 江西农业大学学报,2005, 27(4): 297-310.
[23] 沈锦玉, 沈智华, 尹文林, 等. 饲喂枯草芽孢杆菌对银鲫等水生动物肠道菌群及消化酶活性的影响[J].水产学报(增刊), 2004, 28: 297-310.
[24] Gatesoupe F J. The effect of three strains of lactic bacteria on the production rate of rotifers, Brachionus plicatilis, and their dietary value for larval turbot,Scophthalmus maximus[J]. Aquaculture, 1991, 96:335-342.
[25] Smoragiewicz W, Bielecka M, Babuchawowski A, et al.Les probiotiques[J]. Canadian Journal of Microbiology,1993, 39: 1 089- 1 095.
[26] Douillet P A. Bacterial additives that consistently enhance rotifer growth under synxenic culture conditions use of single and multiple bacterial probiotics[J]. Aquaculture, 2000, 182: 241-248.
[27] Stutz M W, Lawton G S. Effect of diet and antimicrobial on growth, feed efficiency, intestinalClostridium perfringens, and ileal weight of broiler chicks[J]. Poultry Sci, 1984, 63: 2 036-2 042.
[28] Salinas I, Cuesta A, Esteban M. Dietary administration ofLactobacillus delbrueckiiandBacillus subtilis, single or combined, on gilthead seabream cellular innate immune responses[J]. Fish and Shellfish Immunology,2005, 19: 67-77.
Received: Jan., 15, 2010
Key words:Scophthal musmaximus; probiotics; growth; digestive enzyme activity
Abstract:Experiments were conducted to determine the effects of different dietary administration of Probiotics on growth (SR: survival rate; SGR: special growth rate) and digestive enzyme activitis (including proteases、lipase and amylase) ofScophthal musmaximus.The initial body weight was(4.80±0.11), and the period of the experiment was 60 d. Basic diet was made of fish meal and defatted soybean meal as main protein sources. These juvenile turbots were fed with eight different diets: basic diet as control, and basic diet supplemented with 3.0×109CFU/g single probiotics (Bacillus subtilis,Bacillus licheniformis, Lactobacillus acidophilus, Bifidobacterium inopinatum) or 3.0×109CFU/g compound probiotics (B.licheniformis + B.subilis1 : 1;B. inopinatum + L. acidophilus1 : 1;B.licheniformis + B.subilis + B. inopinatum + L. acidophilus1 : 1 : 1 : 1). Each diet was randomly fed to triplicate groups of 300 turbots reared in circulating water aquarium. The water temperature was 17℃±1℃ and the salinity was 32±0.2 during the experimental period. The results showed that turbot fed compound probiotics showed relatively higher growth rate compared with those fed control diet (P<0.05). However, no significant differences in growth were observed between single probiotic groups and the control group. Diet with supplementation of probiotics could improve the protease、lipase and amylase activities in digest tract of turbot, that is, the activities of protease was significantly higher in turbots fed the compound probitics (P<0.05) than those in turbots fed control diet. The present results indicate that the diet with supplementation of probiotics can improve growth and digestive enzyme activities, and that compound probiotics groups show better effects than single probiotics groups.
(本文编辑:谭雪静)
Effects of dietary probiotics on growth and digestive enzyme activities of juvenileScophthal musmaximus
GAO Feng-xiang, GUO Wen, PAN Lei, HU Fa-wen, JIAN Yu-xia, ZHANG Shao-chun, WANG Xue
(Mariculture Institute of Shandong Province, Qingdao 266071, China)
S963.21+1
A
1000-3096(2011)01-0010-07
2010-01-15;
2010-06-06
国家海洋局公益性专项项目(200705023)
高凤祥(1981-), 男, 山东青岛人, 硕士, 主要从事海洋生物学研究, 电话: 0532-86513001, E-mail: ouqdgf@gmail.com
