食管鳞状细胞癌组织中HIF-1α、CCR7和VEGF-C蛋白的表达
2011-09-18赵富周杨鲲鹏庞志刚
赵富周,杨鲲鹏,庞志刚,张 典,谷 博
郑州大学第二附属医院胸外科郑州450014
(2011-01-07收稿 责任编辑 徐春燕)
食管癌是消化道常见的恶性肿瘤之一,早期即可发生淋巴管转移[1]。迄今为止,关于食管癌淋巴管的生成和淋巴结转移的具体机制尚不十分清楚。缺氧是不同来源的实体肿瘤的常见现象,缺氧环境下肿瘤细胞可通过缺氧诱导因子(hypoxia inducible factor,HIF)提高其对缺氧的耐受性并刺激下游基因血管内皮生长因子(vascular endothelial growth factor,VEGF)的表达,从而促进血管淋巴管的生成;趋化因子受体(chemokine receptor,CCR)与其配体结合可以促进肿瘤细胞的增殖,肿瘤血管、淋巴管的生成以及肿瘤细胞定向迁移[2-4]。作者应用免疫组化法检测了食管鳞状细胞癌(esophageal squamous cell carcinoma,ESCC)组织及癌旁正常食管黏膜组织中HIF-1α、CCR7及VEGF-C的表达,探讨3者与ESCC侵袭和淋巴结转移的关系。
1 材料与方法
1.1 材料 45例ESCC标本均为郑州大学第二附属医院手术切除且经病理证实。45例患者中男24例,女21例;年龄41~73岁,中位年龄58.3岁。肿瘤直径<3 cm 23例,≥3 cm 22例;高、中分化24例,低分化和未分化21例;病理分期:Ⅰ、Ⅱ期14例,Ⅲ、Ⅳ期31例;伴有淋巴结转移30例。每例标本均同时取癌旁正常食管黏膜组织作为对照。
1.2 2种组织中 HIF-1α、CCR7和 VEGF-C 蛋白的检测 采用免疫组化SP法。鼠抗人HIF-1α单克隆抗体购自BD公司,羊抗人CCR7多克隆抗体购自Santa Cruz公司,兔抗人VEGF-C多克隆抗体购自北京中杉金桥生物技术有限公司,SP试剂盒和DAB显色试剂盒购自福州迈新生物技术开发有限公司。切片常规脱蜡,微波抗原修复,HIF-1α抗体和CCR7抗体按1-100稀释,VEGF-C抗体按1-200稀释,操作按试剂盒说明进行。用已知的ESCC阳性切片作阳性对照,以PBS代替一抗作阴性对照。
1.3 结果判定 ①HIF-1α和 CCR7:参照 Zhong等[5]的方法,HIF-1α 以胞质和(或)胞核出现棕黄色颗粒为阳性细胞。CCR7以胞质和(或)胞膜中出现黄色或棕黄色颗粒为阳性细胞。先按整张切片中阳性细胞百分比评分,阳性细胞百分比为0%、1% ~ 、5% ~、25% ~及75% ~100%分别计为0、1、2、3和4分。再按整张切片中细胞染色深度评分,无色、浅黄色、棕褐色分别计为0、1、2分。2项评分相乘,积分 <4分判为阴性,≥4分判为阳性。②VEGF-C:以胞质中出现黄色或棕黄色颗粒为阳性细胞。每张切片于高倍镜下选取5个视野,每个视野计数200个细胞,计算阳性细胞百分比,<20%为阴性,≥20%为阳性[6]。
1.4 统计学处理 采用SPSS 10.0进行分析。应用配对χ2检验比较2种组织中3种蛋白表达的差异,应用χ2检验分析ESCC组织中3种蛋白的表达与临床病理特征的关系,采用列联系数分析ESCC组织中3指标的关联性,检验水准α=0.05。
2 结果
2.1 2种组织中 HIF-1α、CCR7和 VEGF-C 蛋白的表达 见图1,表1~3。ESCC组织中 HIF-1α、CCR7及VEGF-C蛋白的阳性表达率分别为55.6%、71.1%和64.4%,高于癌旁正常食管黏膜组织的11.1%、17.8%和 35.6%。

图1 癌旁正常食管黏膜(A)和ESCC(B)组织中HIF-1α、CCR7和VEGF-C蛋白的表达(SP,×400)1:HIF-1α蛋白;2:CCR7蛋白;3:VEGF-C蛋白。
2.2 ESCC 组织中 HIF-1α、CCR7 和 VEGF-C 蛋白的表达与临床病理特征的关系 见表4。
2.3 ESCC 组织中 HIF-1α、CCR7 和 VEGF-C 蛋白表达的关联性 见表5。

表1 2种组织中HIF-1α蛋白的表达 例
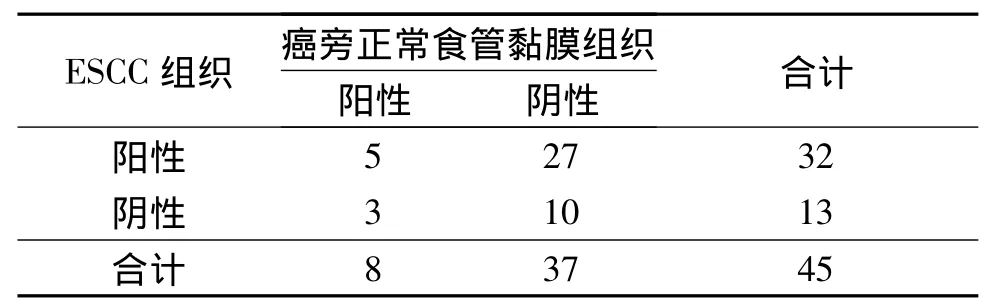
表2 2种组织中CCR7蛋白的表达 例

表3 2种组织中VEGF-C蛋白的表达 例
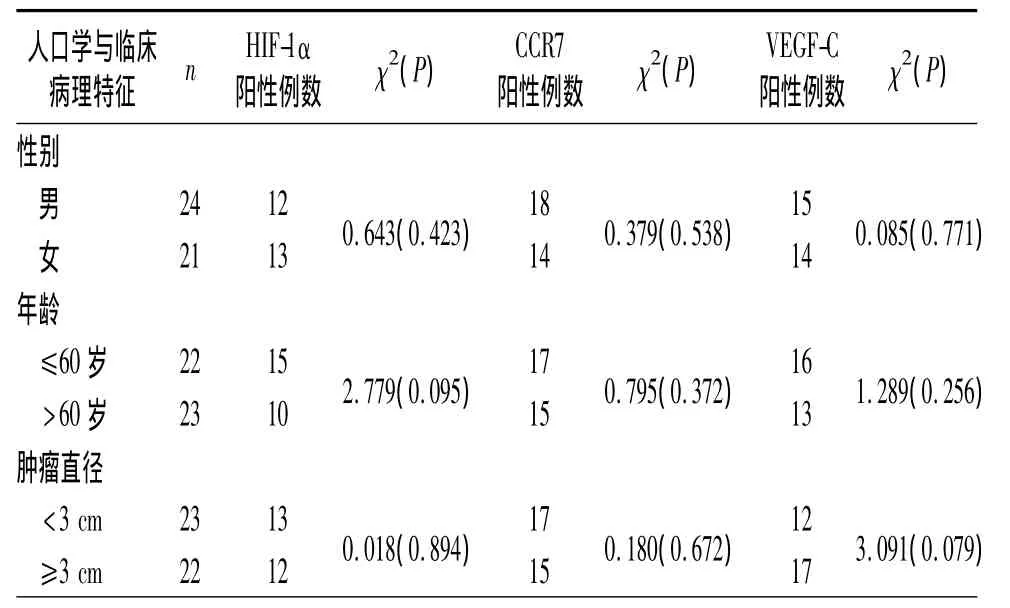
表4 不同人口学与临床病理特征的ESCC组织中HIF-1α、CCR7和VEGF-C蛋白的表达比较

续表4

表5 ESCC组织中HIF-1α、CCR7和VEGF-C蛋白表达的关联性 例
3 讨论
侵袭转移是恶性肿瘤的生物学特征之一,是肿瘤患者死亡的主要原因。肿瘤细胞通过诱导HIF的合成来适应缺氧。CCR7是CC类趋化因子受体的成员之一,研究[7]证实CCR7在多种不同类型的肿瘤组织中有表达,并且CCR7与其配体相互作用与这些肿瘤的淋巴结转移密切相关。有学者[8]发现,胃癌细胞产生的VEGF-C可诱导肿瘤淋巴管增生和扩大。动物模型[9]也证实VEGF-C参与肿瘤淋巴管生成的重要环节。在许多人类肿瘤中,肿瘤细胞可以通过表达VEGF-C诱导淋巴管生成,促进肿瘤细胞发生淋巴转移[10]。
该结果证实,与癌旁正常食管黏膜组织相比,ESCC组织中HIF-1α、CCR7和VEGF-C蛋白的表达明显增高,且ESCC组织中HIF-1α、CCR7和VEGFC蛋白的表达与肿瘤病理分期和淋巴结转移关系密切,而与性别、年龄、肿瘤大小及分化程度无关。关联性分析的结果显示ESCC组织中CCR7和HIF-1α蛋白的表达及CCR7和VEGF-C蛋白的表达有关联性,说明3者在肿瘤淋巴管的形成及淋巴结的转移中可能有协同作用。
总之,HIF-1α、CCR7和 VEGF-C蛋白在 ESCC组织中高表达,调控ESCC的侵袭和淋巴结转移,它们可能成为新的预测ESCC淋巴结转移的指标和淋巴转移途径干预治疗的靶点。
[1] Rubbia-Brandt L,Terris B,Giostra E,et al.Lymphatic vessel density and vascular endothelial growth factor-C expression correlate with malignant behavior in human pancreatic endocrine tumors[J].Clin Cancer Res,2004,10(20):6919
[2]赵华锋,于振涛,齐大亮,等.缺氧诱导因子在食管鳞癌中的表达研究[J].天津医科大学学报,2008,14(1):90
[3] Brand S,Dambacher J,Beigel F,et al.CXCR4 and CXCL12 are inversely expressed in colorectal cancer cells and modulate cancer cell migration,invasion and MMP29 activation[J].Exp Cell Res,2005,310(1):117
[4] Matsumoto M,Natsugoe S,Okumura H,et al.Overexpression of vascular endothelial growth factor-C correlates with lymph node micrometastasis in submucosal esophageal cancer[J].JGastrointest Surg,2006,10(7):1016
[5] Zhong H,De Matzo AM,Laughner E,et al.Overexpression of hypoxia-inducible factor l alpha in common human cancers and their metastases[J].Cancer Res,1999,59(22):5830
[6]师秀琴,徐嵩龄,李醒亚.新辅助化疗对食管鳞状细胞癌组织中趋化因子受体-7和血管内皮生长因子-C表达的影响[J].郑州大学学报:医学版,2009,44(4):706
[7] Muller A,Homey B,Soto H,et al.Involvement of chemokine receptors in breast cancer metastasis[J].Nature,2001,410(6824):50
[8]龙志强,李简.食管鳞癌患者组织和血清中VEGF-C的表达[J].郑州大学学报:医学版,2006,41(2):362
[9] Paavonen K,Puolakkainen P,Jussila L,et al.Vascular endothelial growth factor receptor-3 in lymphangiogenesis in wound healing[J].Am JPathol,2000,156(5):1499
[10]李中信,贾漪涛,崔宏伟,等.大肠癌VEGF-C、Flt-4表达在淋巴管生成及淋巴结转移中的意义[J].中国肿瘤临床,2004,31(6):319