养阴清热法对放疗后食管癌大鼠c-myc蛋白表达和细胞凋亡的影响*
2011-09-18洪永贵郑玉玲王俊生
洪永贵,黄 涛,郑玉玲,王俊生
1)安阳市肿瘤医院内科安阳455000 2)黄河科技学院医学院郑州450005 3)河南中医学院郑州450008
(2010-12-23收稿 责任编辑 姜春霞)
食管癌放疗后,中医病机则以阴津不足、热邪内留为主,痰淤互结为辅,治疗上当以养阴清热为主,辅以化痰散结、祛淤解毒。作者选用放疗后大鼠食管癌模型,以养阴清热立法,应用地黄管食通口服液治疗,探讨养阴清热法对放疗后食管癌大鼠细胞凋亡及相关蛋白c-myc表达的影响,报道如下。
1 材料与方法
1.1 实验动物 选用Wistar大鼠,体质量(120±10)g,2个月龄,雌雄各半,由河南省实验动物中心提供,合格证号:0001645。在该中心清洁级(SPF)环境下常规饲料(消毒后)喂养。
1.2 实验药品 甲基戊基亚硝胺(MANA)由华西医科大学提供,用玉米油配成体积分数0.2%的液体。地黄管食通口服液(以下简称管食通,为郑玉玲教授经验方,主要由熟地黄、山茱萸、山药、泽泻、牡丹皮、茯苓、冬凌草和山豆根等组成):10 mL/支,河南中医学院第一附属医院制剂室提供,含生药比例为1-1。实验浓度依次为低剂量含生药0.5 kg/L(为临床用药剂量的10倍)、中剂量含生药1.0 kg/L、高剂量含生药1.5 kg/L,均为混悬液。六味地黄丸(由熟地黄、山茱萸、山药、泽泻、牡丹皮和茯苓等组成):河南宛西制药股份有限公司生产,批号:050114,临床用量9 g/d,用羧甲基纤维素钠配成含生药0.45 kg/L的混悬液(为临床用药剂量的30倍)。戊巴比妥钠:上海第一制药厂生产。盐酸氯胺酮注射液:上海第二制药厂生产。
1.3 主要试剂和仪器 鼠抗c-myc单克隆抗体为Santa Cruz公司产品,批号G2205;免疫组织化学试剂盒为美国 Zymed公司产品,批号50181263(鼠抗);DAB显色试剂盒,批号50281313,购于北京中杉金桥生物技术有限公司。细胞凋亡检测试剂盒为华美生物工程公司产品,批号106055。DT-300A型电子天平,上海医用激光仪器厂;双目光学显微镜和显微照相机,日本Olympus公司;Co60照射治疗机,上海医疗设备厂生产;DQP-9001电脑切片机,上海医用仪器厂。
1.4 动物模型的建立、分组及给药 健康Wistar大鼠130只,按随机数字法抽取20只作为空白对照组(空白组)。其余110只动物均皮下注射MANA 5 mg/(kg·d),1次/周,连续20周,末次注射MANA后,按随机数字法抽取20只大鼠作为食管癌造模组(食管癌组),并将空白组、食管癌组每组随机选取2只,戊巴比妥钠腹腔注射麻醉(1 g/kg,4 mL/kg)处死。取食管纵切置于40 g/L多聚甲醛缓冲液固定后,石蜡包埋,常规制片,HE染色,食管癌组抽取大鼠经病理学检查均证实为食管癌,造模成功。剩余90只造模大鼠经氯胺酮腹腔注射麻醉[0.1 g/(kg·d),2 mL/(kg·d)],应用 Co60放射治疗机进行大鼠食管局部照射,剂量为2 Gy/d,共5 d。末次照射24 h后,将放疗动物随机均分为5组,单放组[蒸馏水10 mL/(kg·d)]、六味组[六味地黄丸4.5 g/(kg·d)]、低剂量组[地黄管食通口服液5 g/(kg·d)]、中剂量组[地黄管食通口服液10 g/(kg·d)]和高剂量组[地黄管食通口服液15 g/(kg·d)],各组动物每周测体质量,根据体质量变化调节给药剂量。实验结束,所有大鼠用戊巴比妥钠腹腔注射麻醉(30 mg/kg)处死,行相关检查。放疗后用药期间,食管癌组和单放组各有2只大鼠死亡,六味组有1只死亡;管食通各组均无大鼠死亡。
1.5 检测指标 所有标本离体后1 h内采集,取大鼠咽至胃的食管切成纵条,每例标本经40 g/L多聚甲醛固定,石蜡包埋,常规切片制片,用SP法测定cmyc蛋白表达以及TUNEL法检测细胞凋亡,并计算凋亡指数。c-myc表达的测定主要步骤:常规脱蜡至水,体积分数3%H2O2甲醇溶液消除内源性过氧化物酶,高压修复抗原,滴加正常山羊血清封闭液,室温20 min,不洗;滴加一抗 c-myc,4℃过夜,PBS漂洗,滴加二抗37℃20 min,滴加S-A/HRP 37℃20 min,DAB显色,苏木素轻度复染,透明封片,显微镜观察。结果判定标准:c-myc蛋白阳性反应均位于细胞核或细胞质内,均呈棕黄色颗粒,每张切片观察5个200倍视野,每个视野计数500个细胞,根据显色有无及阳性细胞多少可分为4个等级。阴性(-),整个切片未见阳性染色;弱阳性(+),阳性细胞数<25%;中度阳性(),阳性细胞数25% ~50%;强阳性(),阳性细胞数>50%。TUNEL法主要步骤:石蜡切片梯度乙醇脱蜡至水和蛋白酶K室温湿化,滴加TUNEL反应混合液,DAB显色,苏木素轻度复染,封片,显微镜观察。全部操作按试剂盒说明书操作。结果判定标准:凋亡细胞核呈棕黄色;每张切片观察5个200倍视野,每个视野计数500个细胞,计算凋亡细胞百分比,即为凋亡指数(apoptotic index,AI)。
1.6 统计学处理 采用SPSS 13.0进行统计分析。各组c-myc表达水平的比较采用Kruskal-Wallis秩和检验;AI比较采用单因素方差分析,两两比较采用Dunnett法。检验水准α=0.05。
2 结果
2.1 各组大鼠c-myc蛋白表达情况 空白组仅见散在细胞核棕色着染,且颜色较淡;食管癌组大多数细胞核呈棕黄色,着色深,尚可见棕褐色的细胞核;中剂量组胞核呈棕黄色,着色明显比食管癌组浅。见图1和表1。
2.2 各组大鼠细胞凋亡检测结果 空白组可见少数细胞核棕色着染,大部分细胞核呈浅蓝色;食管癌组仅见散在细胞核呈棕黄色,着色浅;中剂量组胞核呈棕黄色,着色明显较深。见表2和图2。
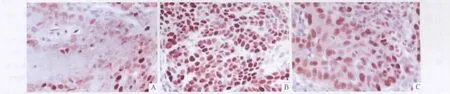
图1 各组大鼠c-myc蛋白表达情况(SP,×200)A:空白组;B:食管癌组;C:中剂量组。
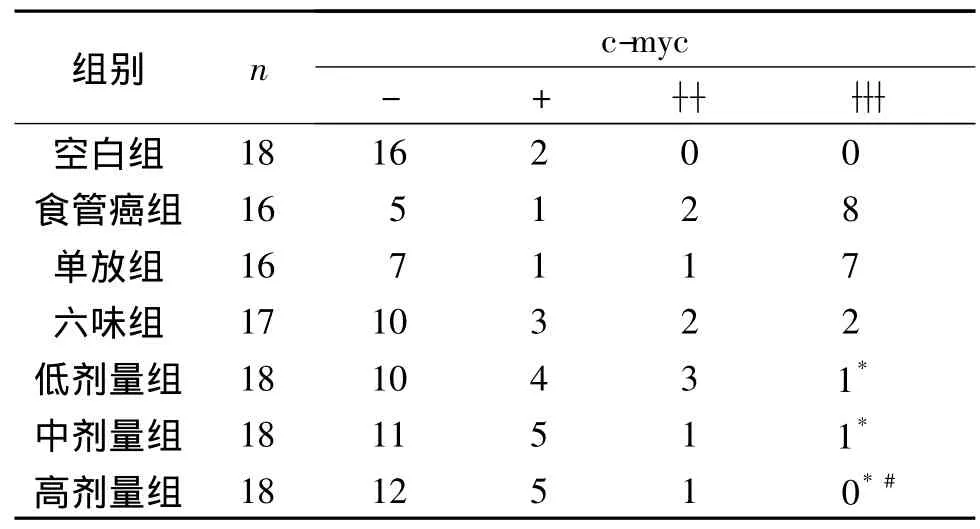
表1 各组大鼠c-myc表达比较 例
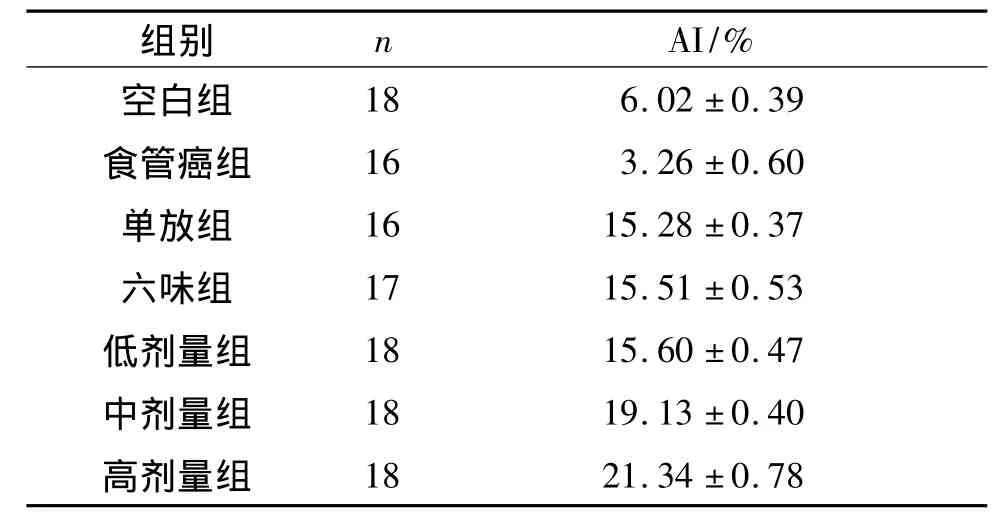
表2 各组大鼠AI比较

图2 各组大鼠细胞凋亡情况(TUNEL,×200)A:空白组;B:食管癌组;C:中剂量组。
3 讨论
细胞凋亡最早由Kerr等[1]提出,是为维持内环境稳定由基因控制的细胞程序性死亡。肿瘤的发生与细胞凋亡有密切关系。很多抗癌药是通过诱发肿瘤凋亡来发挥作用的。
c-myc是一个具有多种功能的癌基因,位于人的第8号染色体上,编码2个磷酸蛋白(P62和P67),定位于线粒体内水溶性蛋白质,稳定地结合于线粒体内膜,不能通过内膜[2],是参与正常细胞增殖、转化和分化的一个原癌基因,能调控细胞周期,具有诱导增殖和凋亡的双重作用[3],在肿瘤的发生及转移等过程中可发挥重要作用,是与食管病变程度相关的蛋白之一[4]。近年有学者[5]开展了c-myc与核糖体蛋白反馈调控的研究,确认核糖体蛋白L11是m-cyc的负反馈调控物,可以抑制细胞内c-myc的转录活性,作为转录因子,myc有与大量基因组座位结合的能力[6]。李晟磊等[7]认为c-myc过度表达可能是食管癌发生发展过程中的早期事件,对食管癌患者预后的判断有重要参考价值。吴名耀等[8]通过观察70例食管癌切除新鲜标本的上切缘正常黏膜、癌旁食管黏膜上皮和食管原位癌组织中hTERT和c-myc蛋白的表达情况,认为癌旁黏膜上皮c-myc的上调促进了hTERT的表达。
依据养阴清热法组方的地黄管食通口服液主要用于治疗食管癌放疗中或放疗后患者,经多年应用,能减轻放射线的不良反应,并与放疗起协同作用[9]。
该实验结果显示,c-myc蛋白表达,与空白组比较,高剂量组差异无统计学意义;与食管癌组比较,地黄管食通口服液各组差异均有统计学意义;与单放组比较,只有高剂量组差异有统计学意义。各组均见有细胞凋亡,且放疗组和各药物治疗组与空白组及食管癌组比较差异均有统计学意义;六味组与单放组、低剂量组比较差异均无统计学意义;地黄管食通中剂量组及高剂量组与单放组和六味组比较差异均有统计学意义;中剂量组与低剂量组比较差异均有统计学意义,高剂量组与中剂量组及低剂量组比较差异均有统计学意义。
综上所述,养阴清热法(地黄管食通口服液)可降低食管癌放疗后大鼠c-myc蛋白表达水平,并能诱导肿瘤细胞凋亡,提示其防治食管瘤放疗后复发的机制可能是通过降低c-myc表达水平,诱导肿瘤细胞凋亡所实现。
[1] Kerr JF,Wyllie AH,Currie Ar.Apoptosis:a basic biological phenomenon with wide-ranging implication in tissue kinetic[J].Br J Cancer,1972,26(4):239
[2] Dai MS,Jin Y,Gallegos JR,et al.Balance of Yin and Yang:ubiquitylation-mediated regulation of p53 and c-myc[J].Neoplasia,2006,8(8):630
[3] Junttila MR,Westermarck J.Mechanisms of MYC stabilization in human malignancies[J].Cell Cycle,2008,7(5):592
[4]王立东,任景丽,宋昕,等.食管癌变过程中肿瘤相关蛋白的表达[J].郑州大学学报:医学版,2009,44(1):13
[5] Dai MS,Lu H.Crosstalk between c-Myc and ribosome in ribosomal biogenesis and cancer[J].J Cell Biochem,2008,105(3):670
[6] Kim J,Chu J,Shen X,et al.An extended transcriptional network for pluripotency of embryonic stem cells[J].Cell,2008,132(6):1049
[7]李晟磊,崔晶,陈俊涛,等.c-myc和p27在食管鳞状上皮癌变过程中的表达及其意义[J].新乡医学院学报,2004,21(3):168
[8]吴名耀,吴贤英,庄楚香.hTRT和C-myc的表达在食管上皮增生和癌变过程中的意义[J].癌变·畸变·突变,2003,15(1):17
[9]郑玉玲,王新杰.放疗联合地黄管食通口服液治疗食管癌的临床观察[J].中国中医药信息杂志,2003,10(8):47