纳洛酮对大鼠肾脏缺血-再灌注损伤的保护作用
2011-09-17黄黎芳
黄黎芳
(四川省自贡市第四人民医院药剂科,四川 自贡 643000)
纳洛酮是一种特异性阿片受体拮抗剂,对心肌缺血-再灌注损伤有一定的保护作用[1-2],但对肾脏的缺血-再灌注损伤是否有保护作用目前尚未见报道。本研究利用大鼠肾脏缺血-再灌注损伤模型,观察纳洛酮对肾脏缺血-再灌注后血液中丙二醛(MDA)、超氧化物歧化酶(SOD)及肾组织中Na+-K+-ATP酶和Ca2+-ATP酶变化的影响,观察组织病理学变化,探讨纳洛酮对肾脏缺血-再灌注损伤的保护作用。
1 材料与方法
1.1 仪器与材料
UV-2101PC型紫外分光光度计(日本岛津公司)。盐酸纳洛酮注射液(军事医学科学院毒物药物研究所研制,北京四环制药厂生产,批号为950525);丙二醛(MDA)、超氧化物歧化酶(SOD)及ATP酶试剂盒均购自南京建成生物工程研究所,批号为960726。Wistar大鼠60只,雌雄不拘,体重为210~270 g,平均(239±19)g,购自山东医科大学实验动物中心。
1.2 分组与试验方法
将Wisfar大鼠随机分为5组,即正常对照组(假手术组,A组)、肾缺血60 min组(B组)、肾缺血60 min再灌注20 min组(C组)、纳洛酮低剂量组和高剂量组(D1组和D2组),D1组和D2组分别于术前1 h腹腔注射纳洛酮2 mg/kg与4 mg/kg,每组12只。大鼠肌肉注射30%戊巴比妥钠(30 mg/kg)麻醉,腹部正中切开后,切除右侧肾脏,以无损伤动脉夹夹闭左肾动脉,制成肾缺血模型。手术结束后从下腔静脉取血,用以测定MDA及SOD。切取左肾,用冷生理盐水冲洗除去血液,滤纸拭干称重(称取0.5 g),用玻璃匀浆器制成2%的组织匀浆,按试剂盒说明测定Na+-K+-ATP酶和Ca2+-ATP酶活力,同时做蛋白定量测定[3]。留取部分肾组织,用甲醛溶液固定,制成石蜡切片,HE染色,光镜检查。
1.3 统计学方法
2 结果
2.1 对血中MDA含量和SOD活力的影响
B组与A组血浆MDA含量及全血SOD活力均无显著性差异(P<0.05);C组MDA的含量明显升高,SOD活力显著降低,与A组和 B 组比较有显著性差异(P <0.01,P <0.05)。D1组和 D2组与C组比较,MDA含量明显下降,SOD活力明显升高,与B组及A组无显著差异。结果见表1。
表1 各组观察指标比较(±s,n=12)
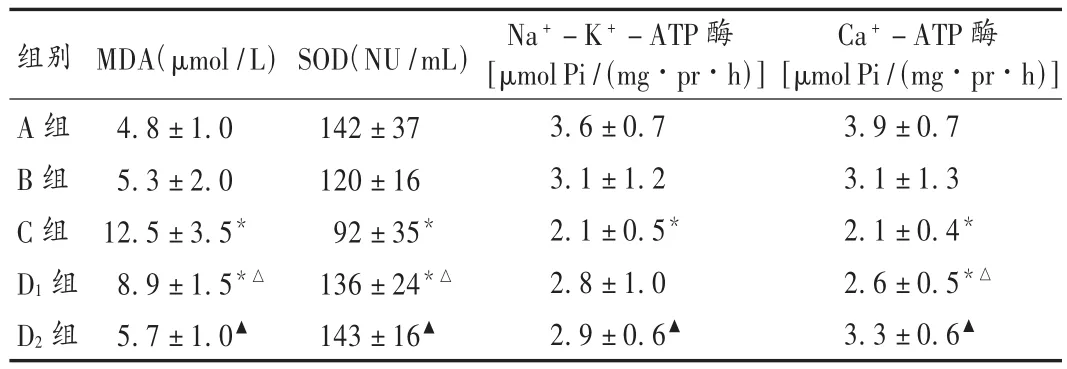
表1 各组观察指标比较(±s,n=12)
注:与 A 组比较,*P<0.01;与 C 组比较,△P <0.05,▲P<0.01。
组别A组B组C组D1组D2组MDA(μmol/L)4.8 ± 1.0 5.3 ± 2.0 12.5 ± 3.5*8.9 ± 1.5*△5.7 ± 1.0▲SOD(NU/mL)142±37 120±16 92±35*136 ±24*△143±16▲Na+-K+-ATP酶[μmolPi/(mg·pr·h)]3.6 ± 0.7 3.1 ± 1.2 2.1 ± 0.5*2.8 ± 1.0 2.9 ± 0.6▲Ca+-ATP酶[μmolPi/(mg·pr·h)]3.9 ± 0.7 3.1 ± 1.3 2.1 ± 0.4*2.6 ± 0.5*△3.3 ± 0.6▲
2.2 对肾组织中Na+-K+-ATP酶和Ca2+-ATP酶活力的影响
B组Na+-K+-ATP酶和Ca2+-ATP酶活力与A组间无显著性差异(P<0.05);C组酶活力明显下降,与上述两组相比有显著性差异(P<0.01)。D1组中 Na+-K+-ATP酶活力有所升高,但与C组相比无显著性差异(P<0.05);D2组与C组相比有显著性差异(P<0.1)。各组 Ca2+-ATP酶的变化与 Na+-K+-ATP酶的变化基本相同。结果见表1。
2.3 肾脏组织病理学检查结果
缺血60 min后,大鼠肾脏变为暗红色,明显水肿;再灌注20 min后,肾脏外观与缺血组(B组)比较无明显变化,预先给予纳洛酮的大鼠肾脏缺血-再灌注后外观明显好转,颜色接近正常,仅有小范围的暗红色区域。光镜下见缺血组(B组)部分肾小管上皮水样变性,并见蛋白管型,肾间质局部出血伴水肿;再灌注组(C组)肾小管上皮细胞明显水样变性,肾间质局部出血伴水肿,并见蛋白管型;纳洛酮低剂量组(D1组)肾小管上皮轻度水样变性,肾间质轻度水肿,偶见管型;高剂量组(D2组)仅见部分肾小管上皮轻度水样变性。各组肾小球均无明显变化。
3 讨论
许多研究表明,肾脏缺血-再灌注造成肾组织损伤的主要机制是:缺血时血管内皮细胞的黄嘌呤脱氢酶转变为黄嘌呤氧化酶,再灌注时催化ATP降解产物次黄嘌呤氧化生成尿酸,这个过程可产生大量氧自由基,可导致脂肪损伤,产生脂质过氧化物,破坏生物膜的结构,使细胞变性、坏死[4]。本研究发现,单纯肾缺血60 min时MDA无明显改变,再灌往20 min后其值明显升高;而SOD在缺血时变化不明显,再灌注时显著下降,这与文献报道结果一致[5]。应用纳洛酮后MDA下降,SOD升高,表明纳洛酮能抑制脂质过氧化物升高,增强清除自由基的能力,高剂量比低剂量作用更明显。
肾小管细胞的基侧膜内有Na+-K+-ATP酶,在离子转运过程中起重要作用。该酶的主要功能是泵出细胞内Na+,泵入细胞外K+,维持机体内环境的稳定。Na+-K+-ATP酶减少,将导致细胞内Na+蓄积和K+丢失,同时Ca2+浓度升高,从而导致线粒体肿胀,氧化一磷酸化脱偶联,进而引起肾组织的一系列损伤[6]。本研究结果表明,纳洛酮能防止肾脏缺血-再灌注损伤时组织中Na+-K+-ATP酶活力的降低。
有研究表明,肾缺血后肾组织中Ca2+-ATP酶活力降低,细胞内Ca2+浓度升高。高度Ca2+可激活细胞内Ca2+依赖性蛋白酶和磷酸脂酶,引起蛋白、磷脂水解,游离脂肪酸释放,细胞膜结构和骨架破坏。本研究发现,肾缺血时Ca2+-ATP酶活力较对照组降低,但无统计学意义,再灌注时Ca2+-ATP酶活力明显降低,应用纳洛酮后可使此酶活力明显升高。
综上所述,纳洛酮对大鼠肾脏缺血-再灌注损伤有一定的保护作用。
[1]Caldwell RW,Nagarijan R,Chryssanthis A,et al.Action of the opioid antagonists,Nalosxne and congeners on reperfustion cardiac arrythmias and regional left coronary bolld flow[J].Pharmacology,1990,41(3):61-63.
[2]Huang XD,Lee AYS,Wong TM,et al.Naboxone and reperfustion in annestheized dogs[J].BR J Pharmac,1986,87:475 -477.
[3]郑军华,魏 武,闵志廉.器官保存领域的新进展[J].国外医学·泌尿系统分册,1995,15(65):216 -218.
[4]王 凤,邵国兴,秦荣良,等.氧自由基及其清除剂VitE、辅酶Q10在肾缺血中作用的实验研究[J].中华器官移植杂志,1994,15(1):28-30.
[5]Burke TJ,Schrier RW.Angioltensin converting enzyme inhibition and acute tubular necrosis[J].Kidnecy Int,1987,31(s23):s143.
[6]Cohen JJ,Harrington JT,Madias NE,et al.Mechanisms of ischemic acute renal failure[J].Kidney Lnt,1993,43:1 160.
