对三水合乙酸钠和无水乙酸钠试剂国家标准一些问题的商榷
2011-09-14薛建军孙百亚吴敏峰陈惠丽陈明雷
薛建军 孙百亚 吕 坚 吴敏峰 陈惠丽 陈明雷
GB/T 693—1996《化学试剂 三水合乙酸钠(乙酸钠)》和GB/T 694—1995《化学试剂 无水乙酸钠》都是20世纪90年代中期出台的试剂类国家标准,是由原化学工业部提出,北京化学试剂总厂归口的两份标准。
这些标准的修订与发布,对当时这些试剂的生产、检验、销售和使用都起到了很好的指导作用。但是,随着时代的变迁、分析技术的改进、人们对标准认识的提高,可以看出这些标准现在也到了要更新的地步了。
作者将在下文阐述对这两份标准一些问题的看法,和化学试剂标准领域的专家进行商榷。
1 等效采用国际标准的问题
GB/T 693—1996在其前言中讲明了其优级纯等效采用ISO 6353-2:1983《化学分析试剂 第2部分:规格 第一批》中R29“三水合乙酸钠”的有关内容。但它实际上没有符合“等效采用”的要求。该标准在前言中就坦承了与ISO 6353-2:1983中R29的不同之处:
a)在设立的试验项目方面,“本标准比国际标准多澄清度试验和水不溶物两项”;
b)在指标方面,“优级纯的含量、氯化物、磷酸盐、钾、钙、铁等6项指标严于国际标准”;
c)在试验方法方面,“本标准含量的测定方法与国际标准不同,国际标准用非水滴定法,本标准采用易于掌握的离子交换法测定,实验表明,两种方法结果无显著差异。其他项目均引用我国已制定的一套化学试剂通用试验方法标准中相应的标准。这套标准基本上是采用ISO 6353-1:1982《化学分析试剂 第1部分:通用试验方法》制定的。”
GB/T 694—1995虽然也是对1981年版本的修订,但是却连前言也没有,说明当时制修订国家标准还不是很规范。
2001年国家质量监督检验检疫总局以第10号令的形式发布了《采用国际标准管理办法》,同年国家质量监督检验检疫总局在ISO/IEC1999年颁布的标准化工作指南《采用国际标准为区域或国家标准》的基础上发布了GB/T 20000.2—2001《标准化工作指南 第2部分:采用国际标准的规则》,从那时起将我国标准与国际标准的一致性程度区分为“等同”、“修改”和“非等效”3种形式,并且明确规定一致性程度为“非等效”的,不属于采用国际标准。现在GB/T 20000.2已经有了2009年的新版本,新版标准对于我国标准与国际标准的一致性程度的划分仍然是“等同”、“修改”和“非等效”3种形式。
在2001年之前,我国标准与国际标准的关系用“采用国际标准程度”(简称“采标程度”)表示,划分为等同(代号为id t)、等效(代号为eqv)和非等效(代号为neq)3种程度[1]。当时“等效”程度的含义是:主要技术内容相同,技术上只有很小差异,编写方法不完全对应。国家标准与国际标准间小的技术性差异是指在技术内容上只容许存在下述不同:在国际标准中可以接受的技术内容在国家标准中也不至于不被接受,或者在国家标准中可以接受的技术内容在国际标准中也不至于不被接受。
如果说如 GB/T 693—1996前言中指出与ISO 6353-2:1983中R29的不同之处的c)点所述,因为非水滴定法与离子交换法测得的主含量结果无显著差异,又如a)点指出的国家标准多了澄清度试验和水不溶物两个项目也许是无关紧要的,符合ISO 6353-2:1983中R29要求的三水合乙酸钠也能通过这两个项目的试验,GB/T 693—1996和ISO 6353-2:1983中的 R29仅存在小的技术性差异,那么两者不同之处的b)点指出的GB/T 693—1996几个项目的指标变严了就不是“在国际标准中可以接受的技术内容在国家标准中也不至于不被接受”了,有些达到国际标准要求的试样就不能达到国家标准的优等品要求了。因此就属于技术内容有重大差异了,就明显是“非等效”的采标程度了。
其实在2001年之前,对于采标程度为“非等效”的情况,并没有像2001年以后一样,将“非等效”明确规定为不属于采用国际标准,也就是说当时也可以把“非等效”作为采用国际标准的一种形式。但是国人可能有一种盲从心理,认为采用国际标准就比不采用国际标准先进,“等效”采用国际标准就比“非等效”采用国际标准的水平高,结果正如GB/T 693—1996标准的情况一样,明明标准的技术水平已经在各方面都比国际标准的技术水平高了,但为了体现出“更高程度”的采标,硬是把自己的技术水平拉低到与国际标准的技术水平一致的程度,结果反而妄自菲薄,反映出明显的矛盾。
实际上这都是受国内标准界对国内标准水平评定依据的影响。国内标准界多年来评定标准水平形成的约定俗成的潜规则是:国内标准只有和某项国际标准、甚至仅是某个区域性标准化组织的标准搭上边,在某些指标上严于国际标准,评出来的技术水平才能达到“国际先进水平”,否则试验方法再先进、指标要求再严格,没有国际标准作为参照,只能属于“国内先进水平”。由于国人普遍认为“国际先进水平”就比“国内先进水平”更先进,能够得到的奖励更多,就养成了国内标准界喜欢妄自菲薄,在前言等处的描述刻意降低水平,争相搭上采标的界。
实际上这是一种很不好的现象。因为国际标准为了达成更广范围内的认识一致,其更新比较慢。譬如:ISO 6353-1和ISO 6353-2分别于1982年和1983年发布以后,至今都还没有修订过。国内在10多年后还要以“等效采用”等形式去挂靠这样的国际标准,又要申明比这些国际标准更先进,实际上是多此一举。这样的标准最终能够通过层层审批,得以发布,也说明国内标准界对采标程度或与国际标准一致性程度认识的混乱。
2 关于主含量的试验方法
关于乙酸钠含量的试验方法,ISO 6353-2:1983中的R29采用的是非水滴定法,该方法采用0.1%的1-萘酚苯的乙酸溶液作为指示液,用0.1 m ol/L的高氯酸在乙酸中滴定0.4 g的三水合乙酸钠试样。实际上,在非水溶剂中直接测定含水的试料是不利的,会导致滴定终点时的突跃变小,终点不易判定。合理的做法需要对三水合乙酸钠实验室样品先进行烘干等形式的预处理,除去其中的水分后,再用非水滴定法来测定乙酸钠的含量。ISO 6353-2:1983中的R29提到的方法还没有像我国的GB/T 601—2002《化学试剂 标准滴定溶液的制备》一样,明确要在高氯酸标准滴定溶液的配制过程中加入乙酸酐来除去高氯酸中的水分,而且应该先加乙酸进行稀释,再滴加乙酸酐除去水分,以免乙酸酐和水反应的过程过热引起高氯酸的爆炸。实际上在配制高氯酸标准滴定溶液时去除掉高氯酸(市售高氯酸的含量只有70%~72%)中的水分,对于测定结果的准确性至关重要。而且乙酸钠试样用乙酸稀释、加热溶解后,还要加入少量的乙酸酐,防止试样在放置、冷却过程中再吸潮。另外,该方法所用的指示液1-萘酚苯现在在非水滴定中已经基本上不用。所以,可以看出国际标准ISO 6353-2:1983中的R29对于非水滴定法测定三水合乙酸钠的方法描述得非常简单。如果盲目按照这样的描述来测定三水合乙酸钠的含量是会出问题的,不值得盲从。
GB/T 693—1996标准对于三水合乙酸钠的测定则采用强酸性阳离子交换树脂的办法来交换出H+,再用氢氧化钠标准滴定溶液滴定H+。该方法处理和再生强酸性阳离子交换树脂的步骤非常繁琐,所用的(1+3)盐酸溶液、100 g/L的氢氧化钠溶液等都具有腐蚀性,比较危险,树脂注入强酸性阳离子交换树脂后,需要分别收集交换液和多次洗涤的液体,也比较繁琐,所以并不像GB/T 693—1996前言中所说的那样,是“易于掌握”的方法。
GB/T 694—1995标准对于乙酸钠含量的测定则采用了更加繁琐的方法,需要对试样先进行炭化和灼烧,这个过程就需要3 h左右。灼烧残渣冷却后溶于热水中,然后以溴甲酚绿-甲基红作为指示液,用0.5m ol/L的盐酸标准滴定溶液滴定至溶液由绿色变为暗红色,再要煮沸2 min,冷却后继续用盐酸标准滴定溶液滴定至溶液呈暗红色。做过分析试验的人都知道,在对试料进行炭化、灼烧的过程中极易引起试料的溅失,造成平行试验的结果精密度较差。因此,这也不是测定乙酸钠含量的好方法。
近年来,业界对于无水乙酸钠或三水合乙酸钠含量的测定渐渐趋向于采用以结晶紫为指示液的非水滴定法,或直接用电位滴定仪进行非水滴定。相比于用电位滴定仪测得的滴定终点,用结晶紫作为指示液来进行非水滴定测得的结果往往会略偏大。这主要是因为结晶紫在乙酸溶液中会随着酸性的增强由紫→蓝→绿→黄变化,而且是一种渐变的过程,各个操作者对终点变色判断的灵敏程度不一样。不同资料上对于以结晶紫为指示液进行非水滴定的终点表述也不同,有的要求以紫色变为蓝色(微带紫色)为终点[2],有的以蓝紫色变为绿色为终点[3]。根据作者进行的对比试验发现:如果以电位滴定仪非水滴定测定乙酸钠含量时滴定突跃的最大值(单位体积电位值变化最大时)作为终点,则滴定时加入的结晶紫还没有明显变色。也就是说以结晶紫作为在非水体系中用高氯酸滴定乙酸钠的终点指示液,实际上结晶紫指示的终点是滞后的,得出的乙酸钠或三水合乙酸钠含量的结果也是偏高的。
顺便说一下,用非水滴定法来测定乙酸钠的方法虽然是在无水的环境下进行的,但是该方法也可以用来测定三水合乙酸钠。测定三水合乙酸钠时往往要先测定其含水量或干燥失重的比例,也就是要先将三水合乙酸钠烘干,然后对烘干后的无水乙酸钠进行非水滴定,再将非水滴定的结果换算成三水合乙酸钠的含量。
采用乙酸这样的非水溶剂,用高氯酸这种在乙酸溶剂中也能体现出强酸特性的标准滴定溶液来滴定乙酸钠,甚至在待滴定的溶液中加入一些乙酸酐以把试验过程中可能引入的水分及时反应掉,目的就是为了加大滴定终点时的突跃,能够使某些与滴定终点时的酸度相匹配的显色剂在较小的体积误差范围内变色,使操作人员能够凭眼睛观察到的变色现象来判断滴定的终点就在附近。
在水溶液中,乙酸钠是一种弱碱,Ac-在水中的水解常数为5.7×10-10,用强酸在水溶液中滴定乙酸钠,几乎看不到滴定突跃,也就难以用合适的指示液等方式来判断滴定的终点。只有当溶液中加入一些盐,提高溶液的离子强度后,测定溶液的pH值或电位值随加入的强酸溶液体积数的变化情况,并绘制曲线,才可以勉强看到滴定突跃[4]。为了改善在水溶液中用强酸也不能滴定乙酸钠的状况,就需要采用乙酸这样的非水溶剂来代替水。
一般在水中为弱碱的物质,在乙酸中都能被拉平为强碱。而高氯酸是一种在乙酸这样的溶剂中也能完全离解的强酸,所以在乙酸溶剂中用高氯酸来滴定乙酸钠就相当于在水中用强酸来滴定强碱,就能使“中和”完全,显示出滴定突跃来。当非水滴定体系中还能形成沉积时,临近终点时的滴定突跃就更大。譬如:在乙酸溶剂中,用邻苯二甲酸氢钾来标定高氯酸的浓度时,就会生成溶解度很小的高氯酸钾沉淀,临近终点时的滴定突跃比起用高氯酸标准滴定溶液滴定乙酸钠时的滴定突跃更大。
以滴入反应体系的单位体积的高氯酸标准滴定溶液引起最大电位变化时的体积作为非水滴定的终点,是一种比较合适的判定方法。如果有全自动的电位滴定仪,在多次试验的基础上了解了滴定终点时的准确pH值或电位以后,甚至还可预设pH或电位作为滴定终点后,以“终点滴定(SET)”模式来进行滴定。这样就能使测定过程达到既快速又节省标准滴定溶液的效果。
如果有些单位或实验室因为条件所限,买不起昂贵的全自动电位滴定仪,也可以用pH计、一支玻璃电极、一支参比电极、一根酸式滴定管和一只放在电磁搅拌器上的烧杯来组成一台简易的电位滴定仪。只需将pH计的选择开关置于“m V”档,就能用来测定滴定过程中电位的变化情况。当用饱和甘汞电极作为参比电极时,为了确保滴定体系处于一个非水的环境,应将饱和甘汞电极套管内的氯化钾饱和水溶液更换为氯化钾的饱和无水甲醇溶液。
3 对于试样pH值指标的商榷
GB/T 693—1996和GB/T 694—1995标准对于各个等级的三水合乙酸钠或无水乙酸钠都设置了一个25℃时50 g/L水溶液的pH值的项目,并且都依据 ISO 6353-2:1983中的 R29的要求,将pH值的指标定在7.5~9.0之间。这似乎让人难以理解:为什么设置在这样一段范围内?
我们只要大概想一想,就不难发现问题:乙酸钠是强碱弱酸盐,Ac-在水中不能使水完全离解成OH-,其水解后形成的[OH-]与[Ac-]有一定关系。虽然同样是50 g/L的水溶液,三水合乙酸钠溶液中和无水乙酸钠溶液中的[Ac-]是不同的,所以Na+和A c-或结晶水呈理想摩尔配比的三水合乙酸钠和无水乙酸钠的pH值应该有所不同,对它们设置的合理的pH值指标也就应该不完全相同。因此也就可以合理地怀疑,设定该指标的制标人员可能没有理解为什么要设置这样一个范围,就稀里糊涂地照着国际标准照搬照抄了。
按照作者的理解,pH值的设置指标应该涵盖各种离子和分子符合理想摩尔数配比的三水合乙酸钠或无水乙酸钠的理论pH值。
让我们先来估算一下三水合乙酸钠和无水乙酸钠的理论pH值。
从公开资料上可以查得25℃时乙酸的离解常数为1.75×10-5,Ac-在水中的水解常数kb为5.7×10-10。
Ac-在水中的水解方程式为:

水的离子积常数为:
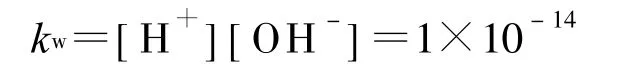
也即:
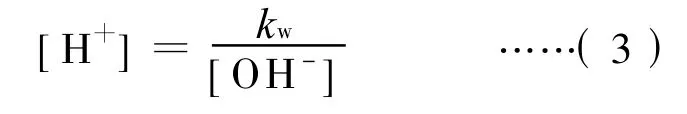
乙酸钠水溶液中的质子条件为:
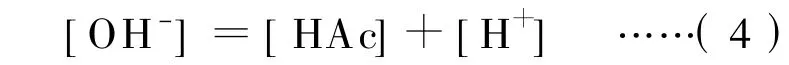
将(2)和(3)式代入(4)式,得:
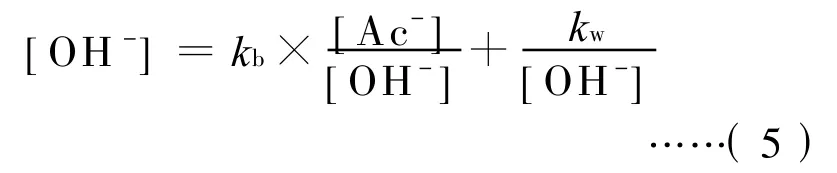
如果各种离子和分子呈理想摩尔配比的三水合乙酸钠配制成50 g/L水溶液后的乙酸钠的摩尔浓度为,由于Ac-在水中会部分水解成OH-,所以在水中剩余的Ac-的浓度可表示为:
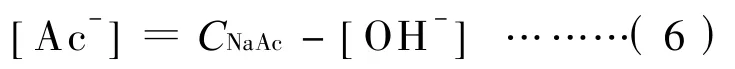
这样(5)式又可表示为:

∵Ac-在水中的水解常数很小,
∴CNaAc≫[OH-]
这样,(7)式又可简化为:
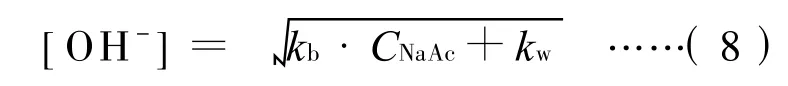
50 g/L的三水合乙酸钠溶液中乙酸钠的摩尔浓度CNaAc为0.37m ol/L
∴(8)式的计算结果为1.45×10-5mol/L
pOH=-log[OH-]=4.84
pH=14-pOH=9.16
同样,50 g/L的无水乙酸钠溶液中乙酸钠的摩尔浓度C NaA c为0.61mol/L
(8)式的计算结果为1.86×10-5mol/L
pOH=-log[OH-]=4.73
pH=14-pOH=9.27
也就是说,无论是三水合乙酸钠,还是无水乙酸钠,各种离子和分子呈理想摩尔数配比时,估算出来的50 g/L水溶液的pH值实际上是超过9.0的。标准中pH指标的上限应该设置得比9.0更高才对。
实际上由于各个生产厂家生产工艺的不同,制得的三水合乙酸钠或无水乙酸钠有的还残留或吸附一点酸,有的还残留或吸附一点碱,导致它们50 g/L水溶液的pH值会不一样。通过制修订标准,给这些试剂的pH值设置一个合理的指标,实际上就是要控制生产过程中这些产品酸碱度的调节,使所得产品的 pH值尽量接近理想配比时的pH值。
但是我们不难发现市场上现在销售的一些三水合乙酸钠或无水乙酸钠试剂的pH值实际上并没有控制好。譬如,作者单位从市场上购得的某批产自天津某化学试剂公司的三水合乙酸钠,其标称含量不小于99%,达到了分析纯等级的含量要求,但是用该批三水合乙酸钠配制成50 g/L的水溶液后,测得其pH值居然>12。这反映了我国的一些试剂生产企业并没有按照国家标准的有关要求来控制产品的质量。
4 结束语
通过上文的剖析,我们可以看到国际标准更新得很慢,提出的一些试验方法不见得严谨,代表的水平也不见得高,我国的标准不应该盲从于国际标准,更不应该为了迎合国内的评定标准水平,去刻意“采标”。
GB/T 693—1996和GB/T 694—1995这些标准在采标程度的描述、主含量的试验方法、pH值指标的设置等方面都还存在着值得修改的地方。希望化学试剂标准领域的专家能够在此基础上进行广泛的讨论,在今后修订这些标准的时候能够把这些标准修订得更好。
[1] 白殿一,等.标准的编写[M].北京:中国标准出版社,2009.
[2] 黄玩丽.用电位滴定法测定无水乙酸钠的含量[J].化工标准·计量·质量,2001(6):30-31.
[3] 李志就,郭有刚.无水乙酸钠含量的快速测定[J].2002(15)、(16):23-24,27.
[4] 张志伟,孙云泉.pH-V双点电位滴定法确定醋酸钠滴定终点[J].山东理工大学学报(自然科学版),2009,23(6):68-71.
