应用高速逆流色谱一次性分离白豆蔻中5-羟基-3,7,4'-三甲氧基黄酮
2011-09-14朱云霞张继全沈平孃王玲玲
朱云霞, 刘 雯, 张继全, 沈平孃*, 王玲玲, 卓 超
(1.华东理工大学药学院,上海200237;2.国家中药制药工程技术研究中心,上海201203)
白豆蔻又名白蔻、豆蔻,为姜科植物白豆蔻Amomum kravanh Pierre ex Gagnep或爪哇白豆蔻Amonum compactum Soland.ex Maton的干燥成熟果实,按产地不同分为“原豆蔻”和“印尼豆蔻”。其性温、味辛,归肺、脾胃经,有温中止呕、化湿行气之功效。主治湿阻所滞、脾胃不和、脘腹胀满、不思饮食、湿温初起、胸闷不饥、胃寒呕吐、食积不消,白豆蔻是临床常用的芳香化湿药[1]。
白豆蔻和爪哇白豆蔻多以果实入药,含挥发油和黄酮类成分,普遍认为主含挥发油,白豆蔻挥发油中主要成分为 1,8-桉叶素,此外,含有 β-蒎烯,α-蒎烯,丁香烯,龙脑乙酸酯,α-松油醇、芳樟醇、葛缕酮、金合欢醇、及对聚伞花素等。白豆蔻中黄酮类成分主要是指甲基化的黄酮醇类化合物,包括5-羟基-3,7,4'-三甲氧基黄酮、5-羟基-3,7,3',4'-四甲氧基黄酮、3,7-二羟基-5,4'-二甲氧基黄酮、3-羟基-5,7,4'-三甲氧黄酮、5,4'-二羟基-3,7-二甲氧基黄酮、3,5,7,4'-四甲氧基黄酮、3,7-二羟基-5,3',4'-三甲氧基黄酮、5,3'-二羟基-3,7,4'-三甲氧基黄酮、3,5-二羟基-7,3',4'-三甲氧基黄酮、3,5,3'-三羟基-7,4'-二甲氧基黄酮、3,5,7,3',4'-五甲氧基黄酮等[2-3]。据药理学表明,5-羟基-3,7,4'-三甲氧基黄酮具有防癌、抗癌、抗氧化、抗过敏、抗病毒、抗真菌等多种生物活性。可见,研究此类化合物的分离纯化具有较重要的意义[4],化学结构式如图1所示。
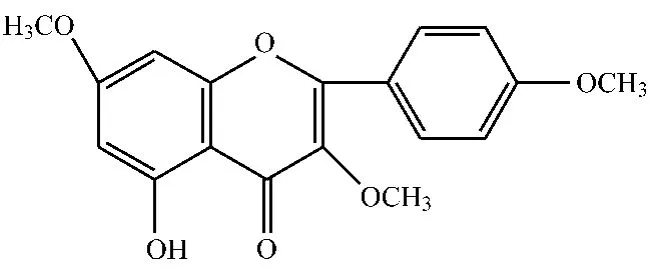
图 1 5-羟基-3,7,4'-三甲氧基黄酮Fig.1 Chem ical structures of 5-hydroxy-3,7,4'-trim ethoxyflavone
黄酮醇类化合物的分离纯化方法很多,常见的有柱层析、薄层层析、铅盐沉淀、硼酸络合、pH梯度萃取、溶剂萃取等,近年来,高速逆流色谱技术在天然黄酮醇类活性成分的分离与纯化领域中应用越来越多[5]。
高速逆流色谱(High-Speed Countercurrent Chromatography,HSCCC)技术是近年来迅速发展的一种新型液-液分离技术,它避免了样品的不可逆吸附、损失和污染。由于使用的是溶剂体系,其组成和配比可以无限多,从理论上讲可以适合于任何极性范围的样品分离,具有很好的适应性;它对样品的预处理要求较低,一般的粗提物即可分离,分离效率高、重现性好[6-7]。由于其分离的快速性及被分离物质回收的便捷性使得分离、纯化、制备可同步完成,近年来,HSCCC已经广泛应用于生物工程、天然产物、食品和化妆品等各领域的分离制备,如黄酮类化合物、生物碱、木脂素、蒽醌、大环内脂类、抗生素和胡萝卜素类等天然活性成分的分离制备,并将HSCCC与质谱(HSCCC/MS)联用,分析鉴定生物碱、木脂素及三萜类化合物等,均取得了满意的结果[8-9]。本实验首次采用HSCCC,选择出合适的溶剂体系,从白豆蔻中分离出黄酮醇类成分,且用此方法一次性制备得到了高纯度的5-羟基-3,7,4'-三甲氧基黄酮纯品。
1 实验部分
1.1 仪器与试剂
TBE-300A型高速逆流色谱仪(上海同田生化有限公司),ÄKTA purifier P-900泵,UV-900紫外检测器(美国 GE Healthcare),HX-1050恒温循环器(北京博医康),Agilent 1100型高效液相色谱仪,包括DAD检测器(美国Agilent公司)。
正己烷、乙酸乙酯、甲醇为分析纯,水为超纯水,HPLC所用甲醇为色谱纯试剂,白豆蔻药材由上海康桥饮片有限公司提供。
1.2 白豆蔻粗提物的制备
将白豆蔻粉碎为粗粉,取200 g粗粉加入1600 mL甲醇,回流提取3 h后,过滤,旋转蒸干,得棕黄色浸膏16.3 g,作为进样物备用。
1.3 HSCCC的分离操作
两相溶剂体系选用正己烷-乙酸乙酯-甲醇-水(4∶4∶8∶4)进行HSCCC分离操作,使用前用分液漏斗分开上下相,过滤,超声处理20 min。将体积比为4∶1的上、下相溶液以10 mL/min的体积流量泵入管路,约20 min后停泵,启动并调整主机转速为900 r/min,然后以1.2 mL/min的体积流量将下相泵入柱内,待上下相建立动态平衡,记录上相被推出的体积,得上相保留着为67.5%[10];白豆蔻粗提物用下相溶解,由进样阀进样;设定紫外检测波长为274 nm,接收目标成分,减压蒸干,TLC、HPLC分析分离结果。
1.4 HPLC 分析条件
色谱柱:CAPCELL PAK C18柱(4.6 mm ×250 mm,5μm);流动相:甲醇-水(78∶22);体积流量1.0 mL/min;柱温:室温;紫外检测波长:274 nm;进样量为10μL。
2 实验结果
2.1 HSCCC条件的选择与优化
本实验目标化合物为中等偏弱极性,因此选用了三个体系进行选择与优化,即正己烷-乙酸乙酯-甲醇-水、三氯甲烷-甲醇-水及环己烷-甲醇-水。分配系数K值[11]由HPLC分析测定:将适量的粗提物放入等体积混合的上下相混合均匀,用HPLC分别检测上、下相中目标化合物的峰面积,分别记为AU和AL,则K=AU/AL。最终K值取三次测定的平均值,结果列于表1。

表1 样品组分在各溶剂体系中分配系数测定结果Tab.1 K values of two components in some two-phase solvent systems
综合K值和实际分离情况,发现正己烷-乙酸乙酯-甲醇-水(4∶4∶8∶4)对目标化合物的分离度最高,且出峰时间合适,上相保留大,因而采用该体系作为HSCCC分离的体系条件。
实验还研究了转速、体积流量及温度对分离效果的影响,最终选用转速为900 r/min、体积流量为1.2 mL/min、温度为室温。HSCCC-UV图谱如图2所示,进样30min后开始出峰,3 h内出4个峰,分别对应收集流出液进行相关检测。
采用薄层色谱对4号峰进行分析,展开剂为三氯甲烷-丙酮(16∶4),用香草醛-浓硫酸溶液(5%香草醛乙醇溶液与浓硫酸以4∶1比例混合)显色,为单一的橙红色斑点[12]。
采用上述方法,对4号峰经多次分离、富集后,将收集所得组分蒸干后最终得到3.41 g的淡黄色针状结晶,所得收率为1.71%。
2.2 结构鉴定
2.2.1 核磁共振(NMR)对HSCCC分离峰的结构分析 1H-NMR(500 MHz,CDCl3)δ:12.68(1H,s,5-OH),8.08(2H,d,J=11,H-2',H-6'),7.03(2H,d,J=11.5,H-3',H-5'),6.45(1H,d,J=2.5,H-8),6.36(1H,d,J=2.5,H-6),3.92(3H,s,OCH3),3.89(3H,s,OCH3),3.87(3H,s,OCH3)。13C-NMR(125 MHz,CDCl3)δ:178.8(C-4),165.4(C-7),162.0(C-4'),161.68(C-5),156.76(C-9),155.97(C-2),138.87(C-3),130.17(C-2',C-6'),122.82(C-1'),114.06(C-3', C-5'),106.06(C-10),97.82(C-6),92.16(C-8),60.1(3-OCH3),55.8(4'-OCH3),55.4(7-OCH3)。对比参考文献[13-15],可确定为 5-羟基-3,7,4'-三甲氧基黄酮。
2.2.2 质谱(ESI-MS)对HSCCC分离峰的结构分析 ESI-MS:m/z(%):328([M]+,100),329(15),327(85),309(12),285(32)。以上数据与5-羟基-3,7,4'-三甲氧基黄酮的相对分子质量吻合。
2.3 纯度分析
将目标成分按照上述HPLC色谱条件进行分析,根据面积归一化法,纯度达到98%以上,结果见图3所示。
2.4 回收率计算
采用外标法可以计算得到药材中5-羟基-3,7,4'-三甲氧基黄酮的实际含有量,取三次计算的平均值为1.79%。将分离得到的相对标准品的量(1.71%)除以1.79%,即可得到5-羟基-3,7,4'-三甲氧基黄酮的回收率为95.5%。
3 讨论
常规的分离技术,HSCCC技术预处理简单方便,耗时短,分离纯度高,回收率高。在以后的应用过程中,可采用HSCCC与常规分离方法相结合,进一步提高分离效率,使其更广泛的应用于中药分离领域。

图3 白豆蔻粗提物(A)及HSCCC分离峰4(B)的HPLC图谱Fig.3 HPLC chrom atogram s of crude extract from A.kravanh Pierre ex Gagnep(A)and HSCCC peak fractions4(B)
[1]吴惠勤,黄晓兰,林晓珊,等.白豆蔻挥发油GC-MS指纹图谱研究[J].中药材,2006,29(8):88-791.
[2]Fraga B M,Henandez M G,Fernandez C,et al.A chemotaxonomical study of nine Canarian Sideritis species[J].Phytochemistry,2009,70(8):1038-1048.
[3]Sripanidkulchai B,Tattawasart U.Proceeding of the 10th World Congress on clinical nutrition[M].Phuket Mar Biol Res Bull,Thailand.2004:61.
[4]Yenesew A,Derese S,Midiwo JO,et al.Two prenylated flavonoids from the stem bark of Erythrina burttii[J].Phytochemistry,2003,63(4):445-448.
[5]唐德智.黄酮类化合物的提取、分离、纯化研究进展[J].中药与天然药物,2009,21(12):101-104.
[6]陈苏伟,潘勇琴,蔡纪青,等.高速逆流色谱法及其在中药分离中的应用[J].天津药学,2008,20(1):74-76.
[7]孙媛媛,唐玉海.高速逆流色谱技术在中草药有效成分分离中的应用[J].西北药学杂志,2003,18(6):282-283.
[8]赵碧清,段更利.高速逆流色谱法在中药有效成分分离中的应用[J].中成药.2007,29(9):1347-1349.
[9]沈平孃.高速逆流色谱(HSCCC)技术与色谱指纹谱[J].中成药,2001,23(5):313-315.
[10]Yoichiro Ito.Golden rules and pitfalls in selecting optimum conditions for high speed counter-current chromatography[J].J Chromatogr A,2005,1065(2):145-168.
[11]Li A F,Sun A L,Liu RM.Preparative isolation and purification of costunolide and dehydrocostuslactone from Aucklandia lappa Decne by high-speed counter-current chromatography [J].J Chromatogr A,2005,1076(1-2):193-197.
[12]张仲平,邵 林.香椿中多酚类化合物的TLC研究[J].山东中医杂志,2000,19(4):237-238.
[13]Jang D S,Han A R,Jhon G J,et al.Flavonoids and aromatic compounds from the rhizomes of Zingiber zerumbet[J].Arch Pham Res,2004,27(4):386-389.
[14]Maria H R,Massayoshi Y,et al.Neolignans,styrylpyrones and flavonoids from an aniba species[J].Phtochemistry,1997,45(6):1263-1269.
[15]Consolacion Y R,Maria C L,Jadz JL,etal.Secondarymetabolites from Tectona philippinensis[J].Nat Prod Res,2008,22(9):820-824.
