葡萄糖调节蛋白78 在复合致病因素诱导的大鼠肝肺综合征中的作用*
2011-12-23贾建桃张慧英田小霞冀菁荃张丽丽吕敏丽王黎敏赵中夫韩德五CHENGJi
贾建桃, 张慧英△, 田小霞, 冀菁荃, 张丽丽, 吕敏丽,王黎敏, 封 明, 赵中夫, 韩德五, CHENG Ji
(1 长治医学院病理生理学教研室,3 长治医学院机能综合实验室,4 长治市人民医院神经外科,5长治医学院肝病研究所,山西 长治046000;2 山西医科大学附属第一人民医院神经内科,6山西医科大学肝病研究所,山西 太原030001;7 美国南加州大学KECK 医学院肝病研究中心,加利福尼亚州 洛杉机90089)
肝肺综合征(hepatopulmonary syndrome,HPS)是指在急慢性肝病、特别是肝硬化基础上发生的呼吸功能障碍,其病理特征为弥漫性肺血管病变以及由此导致的低氧血症。肠源性内毒素血症(intestinal endotoxemia,IETM)在HPS 的发病中发挥重要作用[1]。内毒素是诱导内质网应激(endoplasmic reticulum stress)、导致其标志分子葡萄糖调节蛋白78(78 kD glucose- regulated protein,GRP78)表达增高的重要因素[2]。研究发现,内质网应激在酒精性和非酒精性肝损伤以及由CCl4诱导的动物肝硬化发病中发挥重要作用,GRP78 的表达也明显增高[3,4]。由此,我们推测GRP78 很可能也参与了HPS 的发病过程,而且可能与肠源性内毒素血症之间存在密切联系。本研究通过检测复合致病因素诱导的肝硬化合并HPS 大鼠不同时点肺组织中GRP78 的表达,并且观察其与血浆内毒素变化之间的相关关系,旨在探讨GRP78 在HPS 发病中的作用。
材 料 和 方 法
1 材料
1.1 动物 Wistar 清洁级大鼠,由山西医科大学动物实验中心供应。
1.2 主要试剂 兔抗大鼠GRP78 多克隆抗体购自Sigma;辣根过氧化物酶标记山羊抗兔IgG 购自北京中杉金桥生物技术有限公司;鼠抗兔3 -磷酸甘油醛脱氢酶(glyceraldehyde -3 -phosphate dehydrogenase单克隆抗体,GAPDH)单克隆抗体和辣根过氧化物酶标记山羊抗小鼠IgG 均购自碧云天生物技术研究所;SuperECL Plus 超敏发光液和BCA 法蛋白定量试剂盒购自普利莱基因技术有限公司;Trizol 试剂盒和RT- PCR 试剂盒购自Gibco;TaqDNA 聚合酶购自Promega;GRP78 和GAPDH 引物由中山大学达安基因诊断中心合成;内毒素显色基质鲎试剂盒购自厦门市鲎试剂实验厂有限公司;丙氨酸氨基转移酶(alanine aminotransferase,ALT)、丙二醛(malondialdehyde,MDA)试剂盒和考马斯亮蓝法蛋白定量试剂盒均购自南京建成生物工程研究所;肿瘤坏死因子(tumor necrosis factor alpha,TNF -α)放射免疫分析药盒购自北京华英生物技术研究所。
2 方法
2.1 动物分组与模型建立 雄性Wistar 大鼠,体重200 -240 g,随机分为4 周、6 周和8 周3 个组,每个组随机分为正常对照组和模型组。对照组动物给予标准饲料和自来水,模型组动物用复合致病因素法复制肝硬化合并HPS 模型[5,6]:以掺入胆固醇(占饲料总重量的0.5%)的玉米面作饲料(前2 周掺入猪油20%);以5% -15%(体积比)乙醇作为唯一饮用水,首次皮下注射CCl4原液(5 mL/kg BW),以后改为每隔3 d 皮下注射40% CCl4油溶液(大豆油稀释,剂量3 mL/kg BW)。分别于各时点,全麻、无菌、无内毒素条件下经腹主动脉采集血液,3 000 r/min离心15 min,吸取血浆,-70 ℃保存备用;取部分肝脏右叶组织和左侧肺脏组织立即置于液氮中保存备用,其余组织10%中性甲醛固定,用于组织学研究。
2.2 生化检测 (1)血浆标本:采用赖氏法测定ALT 活性、鲎实验法测定内毒素水平、放免法检测TNF-α 水平,均依照试剂盒说明进行操作。(2)肺组织标本:肺组织经超声匀浆后,考马斯亮蓝法进行蛋白定量,遵照试剂盒说明书采用硫代巴比妥酸法测定MDA 含量,放免法测定TNF-α 含量。
2.3 肝和肺组织HE 染色 以石蜡包埋的肝和肺组织标本制备4 μm 切片,HE 染色,光学显微镜下观察病理学改变。
2.4 Western blotting 法检测肺组织中GRP78 蛋白的表达 取肺组织超声裂解后,BCA 法蛋白定量。取50 μg 蛋白,变性,上样,经10%SDS -PAGE 凝胶电泳后,电转移至硝酸纤维素膜,封闭后加入兔抗大鼠GRP78 多克隆抗体(1∶1 000 稀释)4 ℃过夜,洗涤后加入辣根酶标记山羊抗兔IgG(1∶1 000 稀释)室温1 h,洗涤后加ECL 超敏发光液,X 线胶片曝光、显影。以GAPDH 为内参照。采用分子生物学图像分析系统进行定量扫描测定条带灰度值,将每个样本的灰度值与相应GAPDH 的灰度值相比,计算蛋白的表达水平。
2.5 RT-PCR 法检测肺组织中GRP78 mRNA 的表达 取肺组织100 mg,提取总RNA,紫外分光光度计检测波长为260 nm 和280 nm 的吸光度(A),两者的比值代表RNA 纯度及浓度。取50 μg 总RNA 按照说明书进行逆转录和扩增。GRP78 引物序列:上游引物5' -GGA GGA TGT GGG CAC GGT GGT C-3',下游引物5' - GTC ATT CCA AGT GCG TCC GAT GAG G -3',扩增片段长度385 bp;GAPDH 为内参照,其引物序列,上游引物5' -GGT CAT CAA CGG GAA ACC C-3',下游引物5' -TCT GAG TGG CAG TGA TGG CA -3',扩增片段长度450 bp。扩增参数:95 ℃预变性2 min,95 ℃30 s,58 ℃30 s,72 ℃30 s,进行30 个循环,最后72 ℃5 min。DNA 标准(D12000)确定PCR 产物大小,经2%琼脂糖凝胶电泳,于凝胶成像分析仪上进行吸光度扫描并采用Quantity One 凝胶分析系统(Bio -Rad)测定目的条带与GAPDH 条带的吸光度,以两者的比值表示目的mRNA 的相对含量。
3 统计学处理
采用SPSS 13.0 软件分析,计量资料数据以均数±标准差(±s)表示,单因素方差分析法比较多个样本均数,采用LSD-t 检验法进行均数之间的两两比较,线性相关法分析两两指标间的相关性。
结 果
1 血浆和肺组织中各项生化指标的变化
模型组血浆内毒素水平随HPS 的病程进展逐渐增高,各时点间有显著差异(P <0.05);模型组血浆和肺组织匀浆TNF-α 含量和血浆MDA 含量也随病程进展而逐渐增高,各时点间有显著差异(P <0.05)。模型组各项指标分别在第6 周和第8 周与相应正常对照组相比有显著差异(P <0.05),见表1、2。
表1 各时点对照组和模型组HPS 大鼠血浆内毒素、TNF-α 和ALT 水平的变化Table 1. Plasma levels of endotoxin,TNF-α and ALT in normal control(NC)and HPS (M)groups(±s)
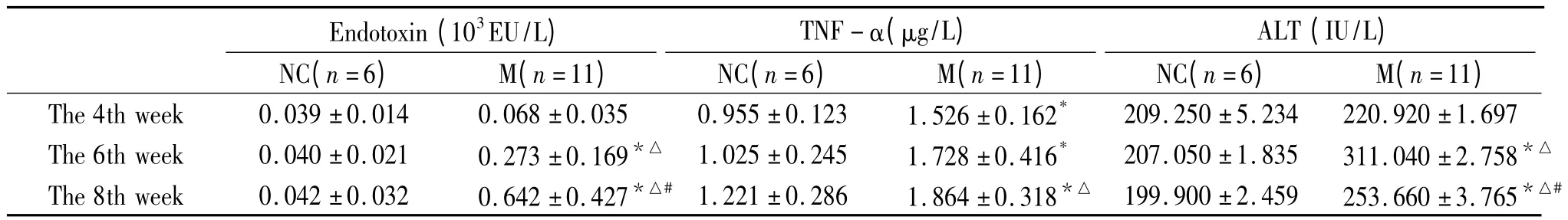
表1 各时点对照组和模型组HPS 大鼠血浆内毒素、TNF-α 和ALT 水平的变化Table 1. Plasma levels of endotoxin,TNF-α and ALT in normal control(NC)and HPS (M)groups(±s)
* P <0.05 vs NC;△P <0.05 vs the 4th week;#P <0.05 vs the 6th week.
Endotoxin (103EU/L)TNF-α(μg/L)ALT (IU/L)NC(n=6) M(n=11) NC(n=6) M(n=11) NC(n=6) M(n=11)The 4th week 0.039±0.014 0.068±0.035 0.955±0.123 1.526±0.162*209.250±5.234 220.920±1.697 The 6th week 0.040±0.021 0.273±0.169*△ 1.025±0.245 1.728±0.416* 207.050±1.835 311.040±2.758*The 8th week 0.042±0.032 0.642±0.427*△# 1.221±0.286 1.864±0.318*△ 199.900±2.459 253.660±3.765*△△#
表2 各时点对照组和模型组HPS 大鼠肺组织匀浆TNF-α和MDA 含量变化Table 2. Contents of TNF-α and MDA of lung tissue in normal control(NC)and HPS (M)groups(±s)
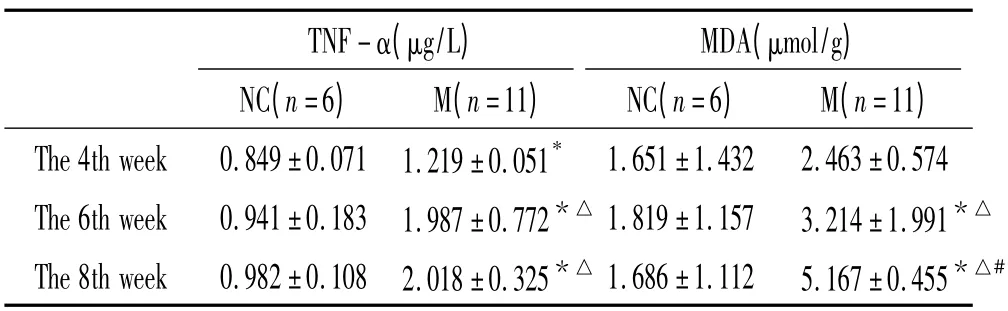
表2 各时点对照组和模型组HPS 大鼠肺组织匀浆TNF-α和MDA 含量变化Table 2. Contents of TNF-α and MDA of lung tissue in normal control(NC)and HPS (M)groups(±s)
* P <0.05 vs NC;△P <0.05 vs the 4th week;#P <0.05 vs the 6th week.
TNF-α(μg/L)MDA(μmol/g)NC(n=6) M(n=11) NC(n=6) M(n=11)The 4th week 0.849±0.071 1.219±0.051*1.651±1.432 2.463±0.574 The 6th week 0.941±0.183 1.987±0.772*△1.819±1.157 3.214±1.991*△The 8th week 0.982±0.108 2.018±0.325*△1.686±1.112 5.167±0.455*△#
2 肝和肺组织病理变化
肝组织HE 染色显示,正常组肝小叶结构规整,肝细胞索排列整齐,呈放射状围绕在中央静脉周围,肝细胞质丰富,核圆形,蓝染,见图1A;模型4 周组:肝细胞索排列紊乱,中央肝小叶坏死伴有炎细胞浸润,肝细胞发生脂肪变性,小叶间可见纤维增生,见图1B;模型6 周组:肝细胞脂肪变性加重,增生的纤维交织成网状结构,炎细胞浸润加重,见图1C;模型8 周组:假小叶形成,见图1D。
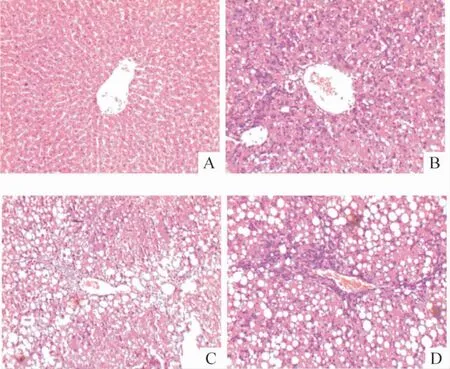
Figure 1. Pathological changes of hepatic tissues (HE staining,× 100). A:control ;B:liver cirrhosis at the 4th week ;C:liver cirrhosis at the 6th week ;D:liver cirrhosis at the 8th week.图1 肝组织病理学改变
肺组织HE 染色显示,正常肺组织肺泡结构完整,间隔均匀,见图2A;模型4 周组,肺泡间隔略增厚,伴有巨噬细胞和噬中性粒细胞积聚,见图2B;模型6 周组,肺泡间隔增厚,伴有毛细血管扩张,巨噬细胞及噬中性粒细胞积聚,部分肺泡腔变小,见图2C;模型8 周组,肺泡间隔进一步增厚,隔内见管腔明显增大的毛细血管以及大量聚集的巨噬细胞,肺泡腔进一步变小,见图2D。
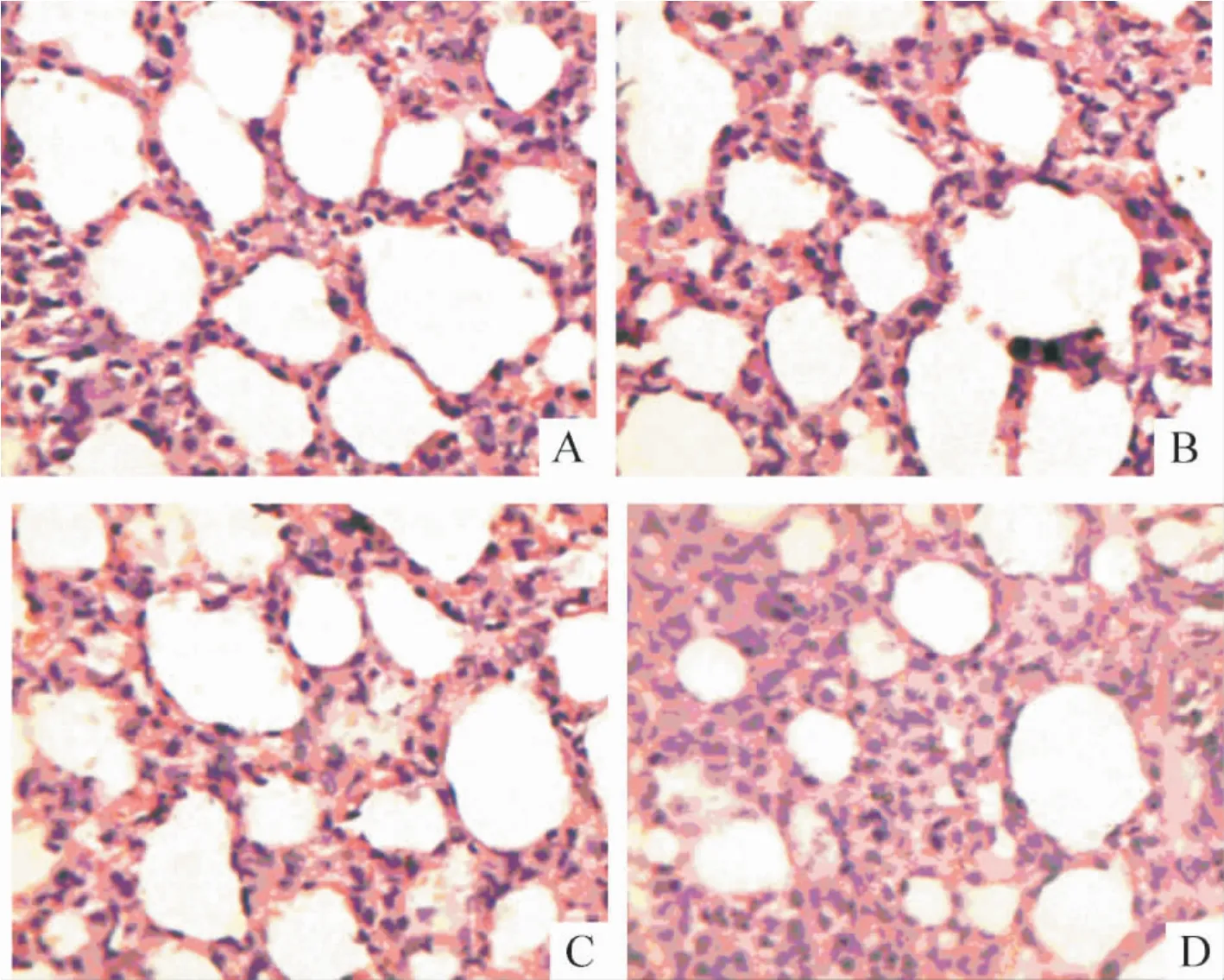
Figure 2. Pathological changes of pulmonary tissues(HE staining,× 400). A:control ;B:HPS at the 4th week ;C:HPS at the 6th week ;D:HPS at the 8th week.图2 肺组织病理学改变
以上观察和我所建立的肝硬化合并肝肺综合征动物模型的病理变化结果相吻合[7]。
3 肺组织中GRP78 蛋白和mRNA 的表达
模型组GRP78 蛋白和mRNA 的表达随病程进展而逐渐增加,且各时点间的表达有显著差异(P <0.05)。在同一时点,模型组GRP78 蛋白和mRNA的表达也都显著高于对照组(P <0.05),见图3、4 和表3、4。
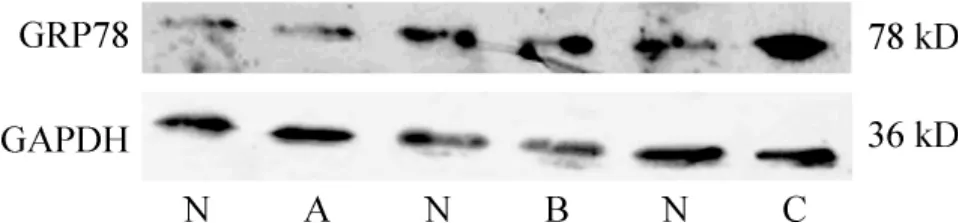
Figure 3. The protein levels of GRP78 and GAPDH in pulmonary tissues. N:normal :A:HPS at the 4th week ;B:HPS at the 6th week ;C:HPS at the 8th week.图3 GRP78 蛋白在肺脏的表达变化
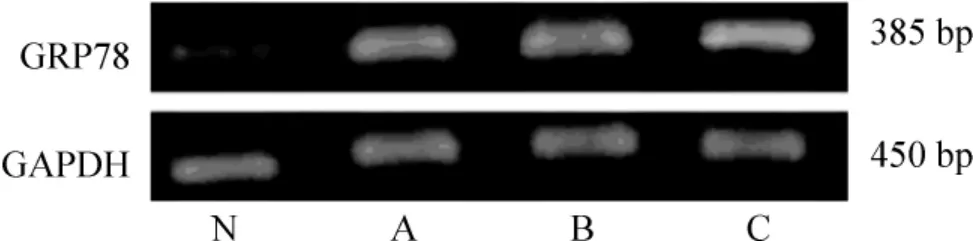
Figure 4. The mRNA levels of GRP78 and GAPDH in pulmonary tissues. N:normal;A:HPS at the 4th week ;B:HPS at the 6th week ;C:HPS at the 8th week.图4 GRP78 mRNA 在肺脏的表达变化
4 各指标间相关性分析
血浆内毒素的含量分别和血浆及肺组织匀浆TNF-α、MDA 的含量呈正相关(P <0.01)。肺组织GRP78 蛋白表达水平和血浆内毒素含量呈高度正相关(P <0.01)。肺组织中GRP78 蛋白与mRNA 的表达呈高度正相关(P <0.01)。肺组织GRP78 蛋白的表达水平分别与血浆及肺组织匀浆中MDA 和TNF-α 的含量呈正相关(P <0.01),见表5。
表3 GRP78 蛋白在肺脏的表达变化Table 3. The protein level of GRP78 in the lung in normal control(NC)and HPS(M)groups (±s)
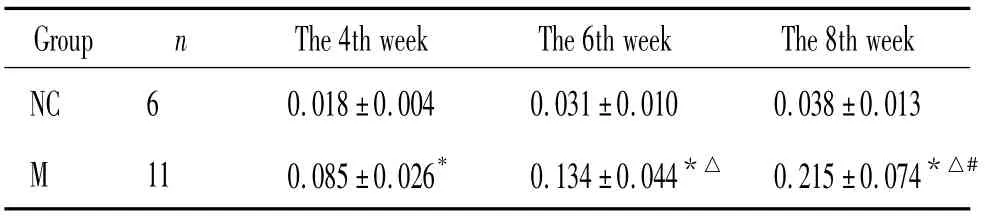
表3 GRP78 蛋白在肺脏的表达变化Table 3. The protein level of GRP78 in the lung in normal control(NC)and HPS(M)groups (±s)
Data were normalized to GAPDH as endogenous control. * P <0.05 vs NC ;△P <0.05 vs 4th week group ;#P <0.05 vs 6th week group.
Group n The 4th week The 6th week The 8th week NC 6 0.018±0.004 0.031±0.010 0.038±0.013 M 11 0.085±0.026* 0.134±0.044*△ 0.215±0.074*△#
表4 GRP78 mRNA 在肺脏的表达变化Table 4. The mRNA level of GRP78 in the lung in normal control(NC)and HPS(M)groups (±s)
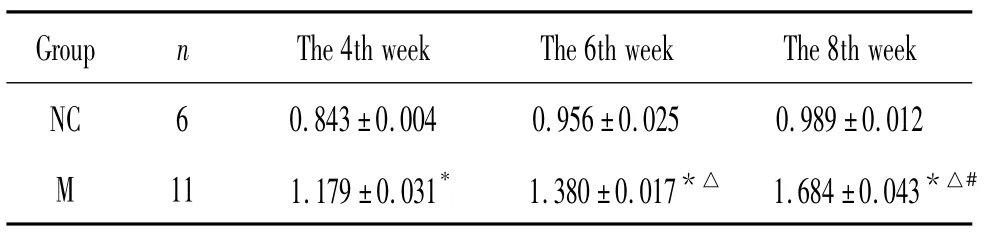
表4 GRP78 mRNA 在肺脏的表达变化Table 4. The mRNA level of GRP78 in the lung in normal control(NC)and HPS(M)groups (±s)
Data were normalized to GAPDH as endogenous control. P <0.05 vs NC ;△P <0.05 vs 4th week group ;#P <0.05 vs 6th week group.
Group n The 4th week The 6th week The 8th week NC 6 0.843±0.004 0.956±0.025 0.989±0.012 M 11 1.179±0.031* 1.380±0.017*△ 1.684±0.043*△#

表5 各指标间相关性分析Table 5. Crrelation analysis of the indexes in HPS rats
讨 论
复制理想的动物模型是研究人类疾病发病机制进而寻找有效治疗策略的前提和基础。本研究中,根据血浆ALT 水平以及肝组织和肺组织形态学的改变,我们认为肝肺综合征的动物模型复制成功。
内质网是细胞中蛋白质加工和Ca2+贮存的重要细胞器。由于各种原因引起内质网中错误折叠蛋白与未折叠蛋白在腔内聚集和/或Ca2+平衡紊乱,可以导致内质网应激,通过未折叠蛋白反应途径,增强细胞对损伤的抵抗及适应能力。GRP78 增加是内质网应激的重要标志,也是该过程中内质网稳态的主要调控者。近年研究发现,GRP78 又是与多种疾病发生密切相关的重要因子[8]。本项研究结果显示:模型组动物肺组织中GRP78 蛋白和mRNA 表达在第4周即有所增加,并随着病程进展逐渐增高,且二者之间的变化高度正相关,提示GRP78 的高表达和HPS的发病密切相关。
研究已经证实,内毒素是重要的内质网应激原[9],它可以通过未折叠蛋白和/或Ca2+的聚集等多种途径直接引起内质网应激[10,11],也可以通过氧化应激间接诱导内质网应激,进而导致GRP78 表达增高。据报道,氧化应激可以抑制钙泵功能,导致内质网中储存的钙离子减少或异常蛋白增多,诱发内质网应激[12,13]。我们前期研究证实,HPS 发病过程中肺组织中NO 表达增多,NO 与内毒素均可以促进活性氧产生[14,15],后者攻击分子伴侣或导致细胞内Ca2+聚集,激发内质网应激[16,17],进一步参与疾病的发病过程。我们研究发现,模型组动物血浆内毒素水平随病程进展逐渐升高,血浆及肺组织匀浆中促炎因子TNF -α 含量也逐渐升高,呈现出与内毒素一致的变化规律,二者与各时点肺组织中GRP78 蛋白的表达呈高度正相关,提示肠源性内毒素及其诱导产生的细胞因子是引起内质网应激以及GRP78 表达增高的重要因素。我们还发现血浆和肺组织匀浆中MDA(是脂质过氧化的中间产物,其含量可以反映氧自由基对生物膜的损害程度)含量随病程进展逐渐升高,与内毒素变化趋势一致,且高度相关,提示氧化应激是内毒素引起内质网应激的重要中间环节。前期工作中,我们已经利用肝硬化合并HPS 模型证实了肠源性内毒素在肝肺综合征发病中的作用[1],但对其机制探讨有限;我们给正常大鼠腹腔注射小剂量内毒素(每天0.5 μg/g BW)4 d,发现肺组织中GRP78 蛋白表达较正常对照组动物显著增加,并且肺泡腔内有大量巨噬细胞积聚(尚未发表),这些结果揭示了内毒素与GRP78 高表达间的内在联系以及它们在HPS 发病中的重要作用。由于有文献报道GRP78 作为多功能受体参与了多种疾病的发生[8],因此我们认为肠源性内毒素通过引起GRP78的高表达很可能是促进HPS 发病的重要机制。
肺脏是处于肝脏的“下游”器官,肝硬化时由于肝脏代谢障碍和生物转化功能降低以及侧枝循环的建立,导致各种毒物直接进入肺循环,肠源性内毒素是全部毒物中作用最强的物质。因而我们认为肝硬化时形成的肠源性内毒素血症作为内质网应激的重要应激原,激活肺组织的内质网应激反应导致GRP78 表达增高可能是HPS 发病的关键。这一发现将为揭示HPS 发病的新机制,进而寻求有效的非手术治疗途径提供新思路。
[1] 张慧英,韩德五,王新国,等. 脂多糖在肝肺综合征发生中的作用[J]. 中国病理生理杂志,2005,21(11):2238 -2242.
[2] Hiramatsu N,Kasai A,Hayakawa K,et al. Real -time detection and continuous monitoring of ER stress in vitro and in vivo by ES -TRAP:evidence for systemic,transient ER stress during endotoxemia [J]. Nucleic Acids Res,2006,34(13):e93.
[3] Ji C. Dissection of endoplasmic reticulum stress signaling in alcoholic and non - alcoholic liver injury[J]. J Gastroenterol Hepatol,2008,23(Suppl 1):S16 -S24.
[4] 冀菁荃,张慧英,贾建桃,等. 糖调节蛋白78 在大鼠肠源性内毒素血症促进肝硬化形成中的作用[J]. 中国病理生理杂志,2010,26(12):2447 -2452.
[5] 苏艾荣,张慧英,关宿东. 大鼠肝肺综合征形成中肺组织NOS 表达的动态变化[J].蚌埠医学院学报,2010,35(4):340 -342.
[6] Zhang HY,Han DW,Zhao ZF,et al. Multiple pathogenic factor-induced complications of cirrhosis in rats:A new model of hepatopulmonary syndrome with intestinal endotoxemia[J]. World J Gastroenterol,2007,13(25):3500 - 3507.
[7] Zhang HY,Han DW,Su HR,et al. Intestinal endotoxemia plays a central role in development of hepatopulmonary syndrome in a cirrhotic rat model induced by multiple pathogenic factors[J]. World J Gastroenterol,2007,13(47):6385 -6395.
[8] Gonzalez - Gronow M,Selim MA,Papalas J,et al.GRP78:a multifunctional receptor on the cell surface[J].Antioxid Redox Signal,2009,11(9):2299- 2306.
[9] Ni M,Lee AS. ER chaperones in mammalian development and human diseases[J]. FEBS Lett,2007,581(19):3641 -3651.
[10] Endo M,Mori M,Akira S,et al. C/EBP homologous protein (CHOP)is crucial for the induction of caspase -11 and the pathogenesis of lipopolysaccharide - induced inflammation[J]. J Immunol,2006,176(10):6245-6253.
[11] Kimura K,Ito S,Nagino M,et al. Inhibition of reactive oxygen species down-regulates protein synthesis in RAW 264.7[J]. Biochem Biophys Res Commun,2008,372(1):272 -275.
[12] Nakayama Y,Endo M,Tsukano H,et al. Molecular mechanisms of the LPS - induced non - apoptotic ER stress-CHOP pathway[J]. J Biochem,2010,147(4):471 -483.
[13] Ji C,Kaplowitz N. Betaine decreases hyperhomocysteinemia,endoplasmic reticulum stress,and liver injury in alcohol- fed mice[J]. Gastroenterology,2003,124(5):1488 -1499.
[14] Güngör N,Pennings JL,Knaapen AM,et al. Transcriptional profiling of the acute pulmonary inflammatory response induced by LPS:role of neutrophils[J]. Respir Res,2010,11(1):24.
[15] Xu KY,Huso DL,Dawson TM,et al. Nitric oxide synthase in cardiac sarcoplasmic reticulum [J]. Proc Natl Acad Sci USA,1999,96(2):657 -662.
[16] Gorlach A,Klappa P,Kietzmann T. The endoplasmic reticulum:folding,calcium homeostasis,signaling,and redox control[J]. Antioxid Redox Signal,2006,8(9 -10):1391 -1418.
[17] Pacher P,Beckman JS,Liaudet L. Nitric oxide and peroxynitrite in health and disease[J]. Physiol Rev,2007,87(1):315 -424.
