心衰大鼠室旁核微量注射AT1 和AT2 受体阻滞剂对肾交感神经活性的影响
2011-12-23潘丽华秦晓同朱健华
潘丽华, 秦晓同, 朱健华, 桂 乐
(南通大学附属医院心血管内科,江苏 南通226001)
据统计,心力衰竭(heart failure,HF)的年死亡率为10%,是导致65 岁以上的老年人入院的主要原因[1]。心衰的确切病因至今仍不十分明确,大量研究结果显示心衰时循环内分泌激活,主要是肾素-血管紧张素(angiotensin,Ang)-醛固酮系统的激活可加速心力衰竭的恶化[2]。交感神经兴奋增强是慢性心衰的重要病理特征,其可导致外周血管阻力的增加,增加心脏的后负荷,肾上腺皮质醛固酮释放增加,水钠潴留,从而增加心脏的前负荷。因此,降低心衰状态下交感神经的活性可以明显降低心衰的死亡率。据相关文献报道,阻断脑内血管紧张素系统的活性能导致慢性心衰交感神经兴奋性显著降低[3]。下丘脑室旁核是心血管系统功能调节的重要区域,其调节了交感神经活动的输出,它与大脑其它神经核团存在密切联系,包括延髓头端腹外侧区(rostral ventrolateral medulla,RVLM)、孤束核(nucleus tractus solitarius,NTS)、脑桥的蓝斑核(locuscoeruleus,LC)等,这些区域对心血管系统起着重要的调节作用[4]。本研究制作大鼠心梗后心衰模型,后腹膜途径寻找肾交感神经,利用AngⅡ-1 型(angiotensin Ⅱtype 1,AT1)和2 型(angiotensi Ⅱtype 2,AT2)受体阻滞剂微量注射于下丘脑室旁核,记录心率、血压和肾交感神经的活性,探讨慢性心衰的中枢调控机制。
材 料 和 方 法
1 动物和仪器
选用SD 大鼠,雄性,体重180 -220 g,由南通大学实验动物中心提供。实验室分笼饲养,予以标准鼠粮和自来水,保持笼内通风干燥,室温18 -22 ℃。SD 大鼠随机分为2 大组:手术组(HF AT1组、HF AT2组、HF Veh 组)和假手术组(sham AT1组,sham AT2组、sham Veh 组)。4 周后采用Stoelting 大鼠脑立体定位仪进行定位,POWERLAB 8/30 系统采集信号(Adinstrument)系统记录心率、血压和肾交感神经放电信号。
2 试剂
AT1受体阻滞剂(L - 158809)和AT2受体阻滞剂(PD123319)均购自 Sigma,用生理盐水溶解、配制为0.1 mol/L的溶液。人工脑脊液(artificial cerebrospinal fluid,ACSF)[pH 7.4,含有(mmol/L):NaCl 130,KCl 2. 99,CaCl20.98,MgCl2·6H2O 0. 80,NaHCO325,Na2HPO4·12H2O 0.039,Na2HPO4·2H2O 0.46][5],- 20 ℃冻存备用。
3 心衰模型的制作
冠脉结扎诱导慢性心衰动物模型:SD 大鼠在水合氯醛麻醉下仰位固定于手术台,自左侧3 -4 肋间开胸,暴露心脏,于肺动脉圆锥及左心房之间找出冠脉左前降支,以0 号线立即结扎冠脉,迅速关闭胸腔,并用负压吸引吸出胸腔内血液和气体。假手术组仅置缝线而不结扎冠脉。术后肌注青霉素。术后第4 周末对假手术组大鼠与心衰组大鼠进行实验。
4 血流动力学检测
使用乌拉坦麻醉各手术大鼠,行颈部切口并分离右颈总动脉,结扎远心端,用动脉夹夹住近心端,在管壁上剪一很小的斜口,插入内径0.5 mm、外径1 mm 并充满1 ×105U/L 肝素钠生理盐水的聚乙烯导管,经右侧颈总动脉向心端缓慢插入左心室,导管另一端通过压力换能器连接到生理记录仪,同步采集心率(heart rate,HR)、左心室收缩压(left ventricular systolic pressuer,LVSP)、左心室舒张末期压(left ventricular end-diastolic pressure,LVEDP)和左心室内压最大上升或下降速率(±dp/dtmax)。LVEDP≥15 mmHg 为心衰模型成功的标志。
5 记录血压、心率和肾交感神经活动
血流动力学检测后对符合实验标准的各手术大鼠行颈部切口并分离气管,行气管切开,股静脉置管,术中使用肌松剂驰肌碘(gallamin)以25 mg·kg-1·h-1持续泵入。行颈部切口并分离右颈总动脉,导管接压力换能器,与桥式放大器相连,POWERLAB 8/30 同步采集测动脉血压、平均动脉压和心率(HR);后将动物俯位固定于大鼠脑立体定位仪上,再将大鼠取侧俯卧位,经腹膜后暴露左肾,在手术显微镜下剥离肾交感神经,将神经置于双极铂丝电极上,灌入配制好的温热液体石蜡(37 ℃),使神经与记录电极结合处于周围组织绝缘并湿润和保护神经。POWERLAB 8/30 系统采集信号,记录肾交感神经活动(renal sympathetic nerve activity,RSNA)。
6 室旁核(paraventricular nucleus,PVN)定位和微量注射
大鼠固定在脑立体定位仪上,沿矢状缝做皮肤切口暴露颅骨,调整前囟和后囟至同一水平。PVN 定位:B=1.8 mm,L=0.4 mm,H=7.9 mm。B 表示为前囟向后,L 表示正中线左右旁开,H 表示硬脑膜下深度。电钻颅骨钻孔,再用微量注射器插入PVN 内。
7 定位与组织学检测
实验结束时,10% KCl 静脉注入处死动物,以此时神经放电积分值作为肾交感神经放电活动的噪声水平。室旁核内微量注射2% 滂胺天蓝溶液(50 nL)。剪取头颅,去除颅骨,将脑组织固定于10% 甲醛溶液中,2 d 后作切片,在显微镜下定位微量注射点位置,定位不准确者不列入统计。
8 统计学处理
结 果
1 大鼠心功能评价
1.1 血流动力学的测定 术后4 周检测大鼠血流动力学,手术组大鼠LVEDP 较假手术组明显增高(P <0.05),LVSP高于假手术组,但无显著差异,见表1。
表1 手术组与假手术组血流动力学比较Table 1. Hemodynamics in rats with heart failure and shamed-operated rats (±s)
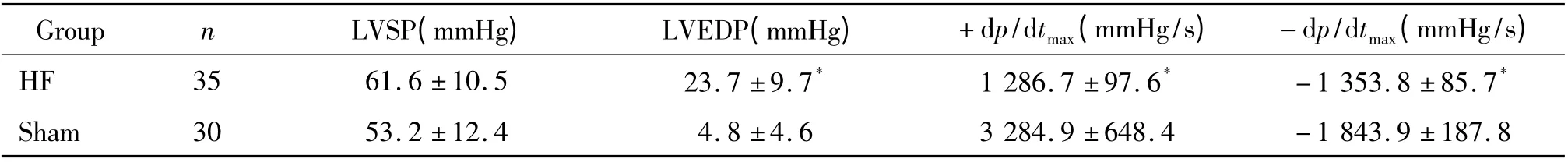
表1 手术组与假手术组血流动力学比较Table 1. Hemodynamics in rats with heart failure and shamed-operated rats (±s)
* P <0.05 vs sham group. HF:heart failure;sham:sham-operated.
Group n LVSP(mmHg) LVEDP(mmHg) +dp/dtmax(mmHg/s) -dp/dtmax(mmHg/s)HF 35 61.6 ±10.5 23.7 ±9.7* 1 286.7 ±97.6* -1 353.8 ±85.7*Sham 30 53.2 ±12.4 4.8 ±4.6 3 284.9 ±648.4 -1 843.9 ±187.8
1.2 心脏、肺组织与体重比的测量 取实验后大鼠心脏,实验结束后立即剪开胸壁暴露心脏与肺脏,随即剪取心脏与肺脏,将心脏在滤纸上沥干,称重。同时称取肺湿重。将心脏重与总体重相除,得到心脏/体重值,将肺湿重与总体重相除,得到肺/体重值。假手术组及心衰组大鼠的指标均来自于手术后4 周获得的组织标本。心衰组大鼠的心脏/体重指数高于假手术组,差异显著(P <0.01),说明心梗后慢性心衰而引起的心脏肥大;心衰组大鼠的肺/体重指数高于假手术组(P <0.01),提示有心力衰竭引起的肺水肿,见表2。
表2 心衰大鼠心、肺重与体重比及心梗占左心室面积比的变化Table 2. Changes of heart weight(HW)/body weight(BW),lung weight(LW)/BW and infarct area(IA)/left ventricular area(IA/LVA)in rats(±s)

表2 心衰大鼠心、肺重与体重比及心梗占左心室面积比的变化Table 2. Changes of heart weight(HW)/body weight(BW),lung weight(LW)/BW and infarct area(IA)/left ventricular area(IA/LVA)in rats(±s)
**P <0.01 vs sham group.
Group n HW/BW(mg/g) LW/BW(mg/g) IA/LVA(%)HF 31 5.4±1.4** 9.8±2.8** 49.5±8.5**Sham 30 2.7±0.4 6.9±0.9 0
1.3 心脏病理组织学观察 观察心脏病理组织学变化,并采用Image-Pro Plus 6.0 软件面积法测定该心脏心梗面积占左室面积的比值,该比值≥30%为冠脉结扎术诱导心衰模型成功标志。见表2。
2 大鼠血压、心率和肾交感神经活性的变化
表3 中可以看出,HF AT1组大鼠与sham AT1组比较,前者肾交感神经放电活动明显减弱(P <0.05),HF AT2组与sham AT2组比较,肾交感神经放电无显著变化,各组大鼠注射药物前后HR 和MAP 均有改变,但无明显差异。
图1 显示,肾交感神经的放电活动在AT1受体阻滞剂L-158809注射后,手术组和假手术组大鼠都有减弱趋势,手术组减弱较假手术组减弱更为明显,见图1A、B。肾交感神经的放电活动在AT2受体阻滞剂PD123319 注射前后手术组与假手术组改变不明显,见图1C、D。
讨 论
本研究使用SD 大鼠冠状动脉左前降支结扎导致心梗从而诱导慢性心衰动物模型,4 周后可见,心衰组心脏/体重比与肺/体重比指数均高于假手术组,且有统计学意义;心衰组大鼠LVEDP 较假手术组明显增高,差异有统计学意义;心脏病理组织学变化显示梗死面积>30%(梗死面积为49.5 ±8.5),有统计学意义,表明心衰模型制作成功。
表3 各组大鼠PVN 微量注射AT1 和AT2 受体阻滞剂的效应Table 3. Averaged changes of RSNA,HR and MAP before and after microinjection into the paraventricular nucleus(PVN)of the hypothalamus (±s)
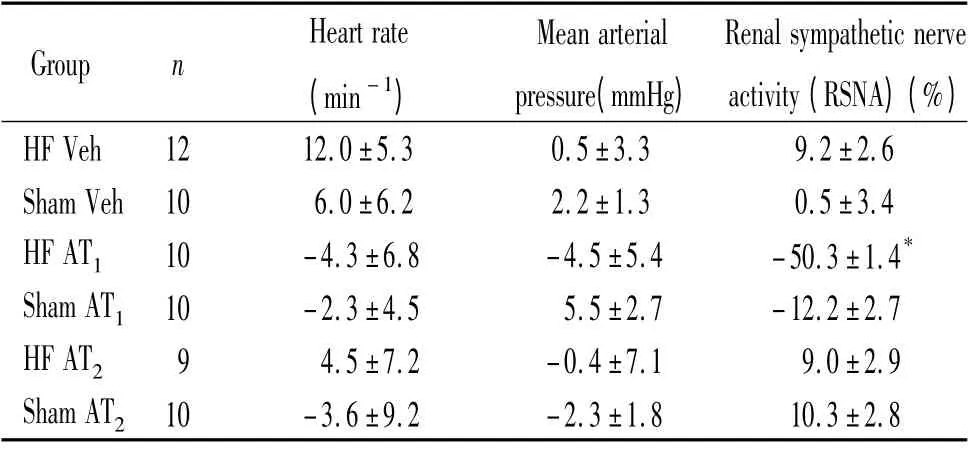
表3 各组大鼠PVN 微量注射AT1 和AT2 受体阻滞剂的效应Table 3. Averaged changes of RSNA,HR and MAP before and after microinjection into the paraventricular nucleus(PVN)of the hypothalamus (±s)
* P <0.05 vs sham AT1 group. Veh:injection into PVN with ACSF in HF rats and sham rats.AT1:injection with AT1 receptor antagonist (L -158809)into PVN of HF rats and sham rats.AT2:injection with AT2 receptor antagonist (PD123319)into PVN of HF rats and sham rats.
Group n Heart rate(min -1)Mean arterial pressure(mmHg)Renal sympathetic nerve activity(RSNA)(%)HF Veh 12 12.0±5.3 0.5±3.3 9.2±2.6 Sham Veh 10 6.0±6.2 2.2±1.3 0.5±3.4 HF AT1 10 -4.3±6.8 -4.5±5.4 -50.3±1.4*Sham AT1 10 -2.3±4.5 5.5±2.7 -12.2±2.7 HF AT2 9 4.5±7.2 -0.4±7.1 9.0±2.9 Sham AT2 10 -3.6±9.2 -2.3±1.8 10.3±2.8
据相关文献报道,心力衰竭时循环内分泌激活,可加速心力衰竭的恶化,慢性心衰大鼠肾交感神经活性明显高于假手术组[6],这与我们的研究结果相一致。从我们的结果中可见,手术组RSNA 在注射AT1受体阻滞剂L -158809 后比注射前明显减弱,而假手术组减弱不明显;手术组注射AT2受体阻滞剂PD123319 前后改变不明显,而假手术组亦无相关改变。PVN 是自主性和内分泌性反应的重要整合中枢,在维持心血管活动的动态平衡中起着关键作用。心衰时PVN 中AT1受体介导的血管紧张素反应对交感神经功能的调节有重要的作用[7]。心衰大鼠PVN 内AT1受体上调,使用Ang II 可明显引起肾交感放电的增强[7,8]。本研究中,AT1受体阻滞剂影响了Ang Ⅱ受体介导的交感信号的输出,阻断了相关兴奋性信号的转导,从而抑制了肾交感神经的放电。最近,Gao等[9]发现,心衰大鼠中RVLM 内AT1受体蛋白的表达明显升高,而AT2受体蛋白表达明显下降,AT1/AT2受体比例上升。本研究使用AT2受体阻滞剂后手术组及假手术组的RSNA神经放电改变不明显,以此推测,心衰大鼠PVN 内AT2受体表达不升高,不排除AT2受体无AT1相关介导作用。若要明确相关机制还需进一步研究探讨。
本研究就心衰SD 大鼠下丘脑室旁核对AT1和AT2受体阻滞剂微量注射后肾交感神经的反应进行了相关研究,中枢受体AT1对心衰的慢性激活有重要意义,而AT2意义不大,为慢性心衰的病理生理研究和治疗提供了依据。
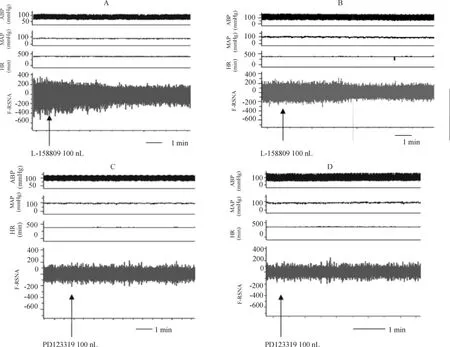
Figure 1. Changes of ABP,MAP,HR and RSNA before and after injection with AT1 receptor antagonist(L-158809)and AT2 receptor antagonist(PD123319)into PVN.ABP:ambulatory blood pressure;MAP:mean arterial pressure;HR:heart rate;RSNA:renal sympathetic nerve activity.A:injection with L-158809 into PVN in heart failure(HF)rats;B:injection of L-158809 into PVN in sham-operated (sham)rats;C:injection with PD123319 into PVN in HF rats;D:injection PD123319 into PVN in sham rats.图1 大鼠血压、心率及肾交感神经活动的变化
[1] Neubauer S. The failing heart-an engine out of fuel[J].N Engl J Med,2007,356 (11):1140 -1151.
[2] Atlas SA. The renin - angiotensin aldosterone system:pathophysiological role and pharmacologic inhibition[J]. J Manag Care Pharm,2007,13(8 Suppl B):9 -20.
[3] Francis J,Wei SG,Weiss RM,et al. Brain angiotensin -converting enzyme activity and autonomic regulation in heart failure[J]. Am J Physiol Heart Circ Physiol,2004,287(5):H2138 -H2146.
[4] Ferguson AV,Latchford KJ,Samson WK.The paraventricular nucleus of the hypothalamus - a potential target for integrative treatment of autonomic dysfunction[J]. Expert Opin Ther Targets,2008,12(6):717 -727.
[5] 杨世方,凌亦凌,戴鸿雁,等.八肽胆囊收缩素对正常及脑缺血大鼠大脑皮层NO 水平的调节[J].中风与神经疾病杂志,2003,20(2):103 -106.
[6] Wang RJ,Zeng QH,Wang WZ,et al. GABAAand GABABreceptor-mediated inhibition of sympathetic outflow in the paraventricular nucleus is blunted in chronic heart failure[J]. Clin Exp Pharmacol Physiol,2009,36(5 -6):516 - 522.
[7] Zhu GQ,Gao L,Li Y,et al.AT1receptor mRNA antisense normalizes enhanced cardiac sympathetic afferent reflex in rats with chronic heart failure[J].Am J Physiol Heart Circ Physiol,2003,287(4):H1828 -H1835.
[8] Zheng H,Li YF,Wang W,et al. Enhanced angiotensin -mediated excitation of renal sympathetic nerve activity within the paraventricular nucleus of anesthetized rats with heart failure[J].Am J Physiol Regul Integr Comp Physiol,2009,297(5):R1364 -R1374.
[9] Gao L,Wang WZ,Wang W,et al.Imbalance of angiotensin type 1 receptor and angiotensin II type 2 receptor in the rostral ventrolateral medulla[J]. Hypertension,2008,52(4):708 -714.
