饲料中添加还原型谷胱甘肽对牙鲆生长和抗氧化能力的影响
2011-09-13王芳倩张文兵麦康森徐玮王小洁刘付志国
王芳倩,张文兵,麦康森,徐玮,王小洁,刘付志国
(中国海洋大学海水养殖教育部重点实验室,山东青岛266003)
饲料中添加还原型谷胱甘肽对牙鲆生长和抗氧化能力的影响
王芳倩,张文兵**,麦康森,徐玮,王小洁,刘付志国
(中国海洋大学海水养殖教育部重点实验室,山东青岛266003)
以酪蛋白、明胶为主要蛋白源配制精制基础饲料,添加不同浓度梯度的还原型谷胱甘肽(GSH),饲料中GSH的含量分别为0、97.96、189.92、371.84、688.72和1 063.56 mg·kg-1,在流水式养殖系统中分别投喂初始体质量为(9.49± 0.22)g的牙鲆(Paralichthys olivaceus)幼鱼,8周后观测各组牙鲆的生长情况及机体的抗氧化状态。结果表明,饲料中添加外源的GSH对牙鲆成活率没有显著影响(P>0.05);牙鲆增重率(WGR)在饲料GSH含量为371.84 mg·kg-1时达到最大值,显著高于其它各组(P<0.05);饲料GSH添加组牙鲆肝脏中GSH的含量显著高于零添加组(P<0.05);各处理组肝脏中丙二醛(MDA)的含量没有显著差异(P>0.05);肝脏中谷胱甘肽还原酶(GR)的活力随饲料中GSH含量的升高呈现先降低后上升的趋势,并在饲料中GSH含量为371.84 mg·kg-1时达到最低值;肝脏中超氧化物歧化酶(SOD)和谷胱甘肽过氧化物酶(GPx)活力没有受到饲料中GSH含量的显著影响(P>0.05);饲料中GSH含量为371.84 mg·kg-1时,肝脏中总抗氧化力(T-AOC)显著高于1 063.56 mg·kg-1组(P<0.05),谷胱甘肽-S-转移酶(GST)活力显著低于其它各组(P<0.05)。根据WGR的实验数据,利用折线模型得到牙鲆幼鱼饲料中GSH的适宜含量为368.92 mg·kg-1,过高或过低都会对生长造成负面影响,抑制机体抗氧化能力,增加机体氧化压力。
牙鲆;饲料;谷胱甘肽;生长;抗氧化
还原型谷胱甘肽(GSH)是由γ-谷氨酰环化转移酶、γ-谷氨酰半胱氨酸合成酶、谷胱甘肽合成酶催化细胞内谷氨酸、半胱氨酸和甘氨酸脱水而成的含有巯基的天然三肽,体内主要由肝脏合成,与氧化型谷胱甘肽(GSSG)相互转化,以维持细胞正常的生理过程[1-2]。哺乳动物中的研究发现,外源型GSH可以被小肠直接吸收进入血液循环[3-4],食物中补充GSH在机体内可以起到清除自由基、缓解缺血性再灌注损伤[5]、防止脂质过氧化[6]等多种生理功能。另外,GSH作为Ⅱ相解毒酶——谷胱甘肽S-转移酶(GST)的作用底物,参与机体的解毒作用,能够与毒素结合形成1种新的可溶性物质,使毒素的毒性大大降低[7]。
水生动物体内GSH水平对外界条件的变化很敏感[8-9],体内的GSH在鱼体解除重金属毒性[10],免受多氯联苯的氧化损伤[11],提高抵抗微囊藻毒素毒性的能力[12]等方面起到了重要的作用;同时,影响草鱼[13]和凡纳滨对虾[14]的生长和抗氧化能力。目前,关于水产饲料中应用GSH的研究主要集中于淡水鱼和虾类。凡纳滨对虾饲料中添加GSH可以提高体内过氧化物酶活性[14]、提高肝胰腺抗氧化能力和降低脂质过氧化水平[15]、提高GSH在体内的蓄积[16-17]。草鱼饲料中添加GSH可以提高特定生长率、成活率、饲料转化率和血清中IGF-1的水平[13],同时提高肝脏和肌肉中GSH的沉积和抗氧化能力[18]。饲料中添加100~400 mg·kg-1的GSH,能够显著增强罗非鱼的摄食和生长,提高总抗氧化能力(T-AOC)和超氧化物歧化酶(SOD)的活力[19]。然而,GSH通过食物途径对海水养殖鱼类的生长、生理代谢和饲料利用等方面的影响,还没有相关的报道。
牙鲆(Paralichthys olivaceus)是我国重要的海水养殖品种之一,然而由于爱德华氏菌症、淋巴囊肿病等顽固性疾病的日益严重,养殖成活率下降,给牙鲆养殖业造成极大的损失[20]。目前,牙鲆的基本营养需求已经明确,那么怎样通过营养途径来提升养殖牙鲆的健康水平,提高牙鲆的产量和品质,已经成为人们日益关注的焦点。本研究拟利用以酪蛋白和明胶为蛋白源配制的精制饲料,分析在饲料中添加不同浓度梯度的GSH对牙鲆生长和抗氧化能力影响,为GSH在牙鲆饲料中的应用提供基础数据。
1 材料和方法
1.1 实验饲料
以酪蛋白、明胶为主要蛋白源,鱼油为主要脂肪源,糊精为主要糖源配制等氮等能的精制饲料,基础饲料配方和营养组成见表1。在基础饲料中添加不同梯度的GSH,分别为:0、100、200、400、700和1100 mg·kg-1;饲料中GSH含量的实测值分别为:0、97.96、189.92、371.84、688.72和1 063.56 mg·kg-1。
制作饲料时,先将各种饲料原料粉碎,过60目筛,逐级扩大混合均匀后,先后加入油和水,用双螺杆挤条机(华南理工大学,F-26(Ⅱ)型)加工成型,37℃烘干,制成颗粒饲料,-20℃储存备用。
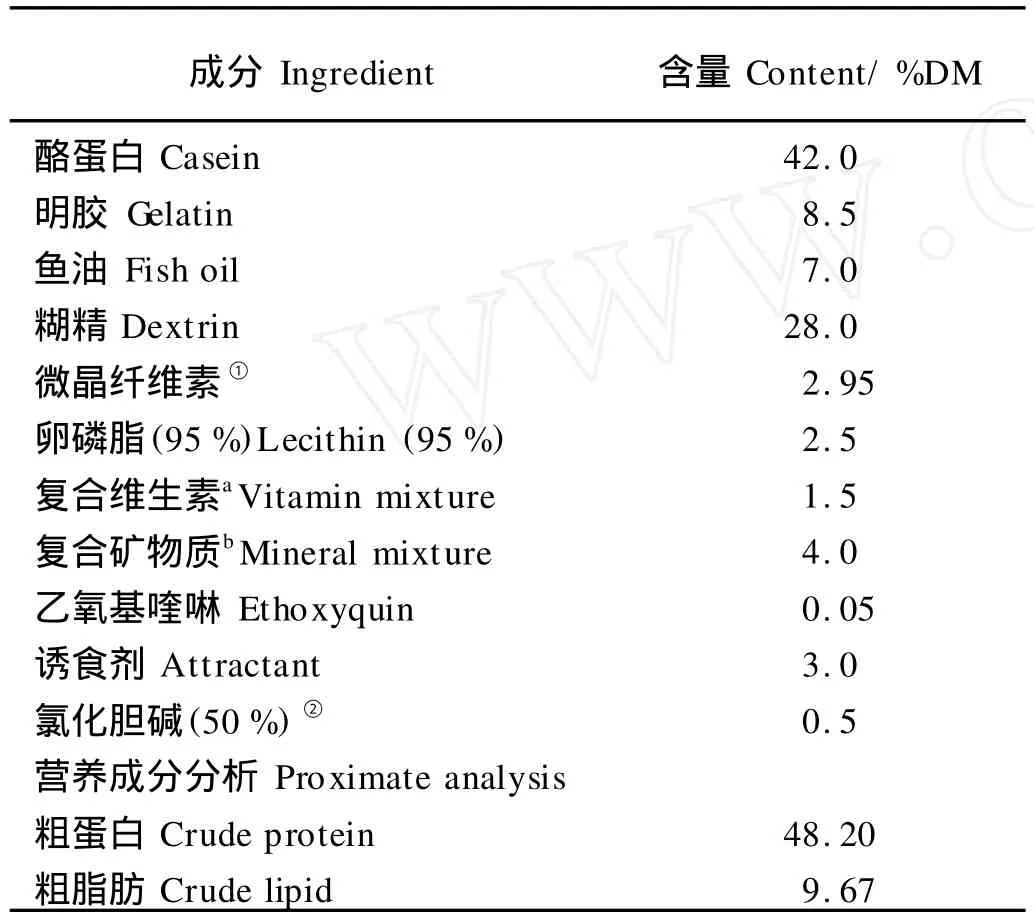
表1 实验基础饲料配方及营养组成Table 1 Ingredients and composition of the basal diet
1.2 饲养与管理
牙鲆幼鱼购自山东省日照市良种示范基地,为当年孵化的同一批鱼苗,初质量为(9.49±0.22)g,实验鱼个体无病无伤,体质健壮。饲养实验在中国海洋大学鳌山卫实验基地流水养殖系统中进行,每个水槽为1个养殖单位,容积为300 L,水流速度为1 L·min-1,水温(17~25)℃,盐度30±1,溶氧不低于6 mg·L-1, p H=7.6~8.3。
正式实验开始前,先用基础饲料驯化2周,待牙鲆完全适应精制饲料和养殖环境后,开始随机分组进行实验。实验共6个处理,每个处理设置3个重复,每个重复放鱼30尾。养殖实验持续8周,实验期间自然光照,每天投喂2次(08··00和18··00)。
1.3 样品采集
实验结束前,牙鲆禁食24 h后称质量和计数。每个重复(水槽)随机取8尾牙鲆,解剖采集肝脏,液氮速冻后-80℃冻存备用。
牙鲆的生长情况用增重率(WGR)来表示,其计算公式如下:
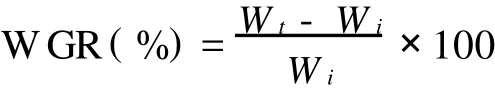
式中,Wt-终体质量(g);Wi-初始体质量(g)
1.4 样品测定
将肝脏组织解冻,取采集到的8尾鱼肝脏在预冷的匀浆介质(mg/μL=1/9)中匀浆混合均匀,4℃下3 500 r/min离心15 min,取上清,进行指标测定。
组织匀浆液的总蛋白测定使用南京建成生物工程研究所蛋白试剂盒,以考马斯亮蓝染色;GSH、谷胱甘肽还原酶(GR)、谷胱甘肽过氧化物酶(GPx)的测定采用南京建成生物工程研究所试剂盒,利用二硫代二硝基苯甲酸与巯基化合物的反应比色测定;丙二醛(MDA)使用南京建成生物工程研究所试剂盒,根据硫代巴比妥酸法进行比色定量测定;GST使用南京建成生物工程研究所试剂盒,利用GST催化GSH与1-氯-2,4-二硝基苯的结合能力的原理比色测定;SOD使用黄嘌呤氧化酶法测定,使用南京建成生物工程研究所试剂盒;T-AOC采用酶标仪进行比色定量测定,使用南京建成生物工程研究所试剂盒。
1.5 数据统计分析
所有数据均采用SPSS软件进行统计分析。每个处理得到的数据用单因素方差分析(ANOVA)。当不同处理之间有显著差异(P<0.05)时,用Tukey检验比较不同处理间的平均值。实验结果用平均数±标准差(±S.D.)表示。
2 实验结果
2.1 GSH对牙鲆增重率和成活率的影响
如表2所示,饲料中添加不同剂量的GSH对牙鲆幼鱼的成活率没有显著影响(P>0.05),成活率在97.58%~100.00%范围内变动。
GSH含量为371.84 mg·kg-1饲料组牙鲆的增重率在所有处理组中显著最高(P<0.05),其值为118.81%±10.06%,其他各组间的增重率没有显著差异(P>0.05)。通过折线模型拟合,得知当饲料中GSH含量为368.92 mg·kg-1时,牙鲆增重率达到最大值116.34%(见图1)。
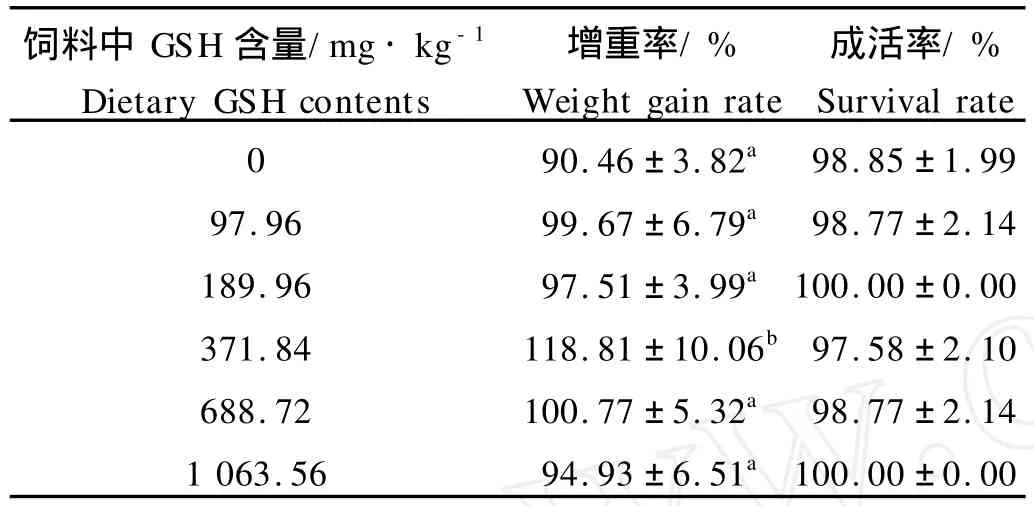
表2 饲料中还原型谷胱甘肽(GSH)的不同水平对牙鲆增重率(WGR)和成活的影响(平均值±标准差,n=31)Table 2 Effects of dietary reduced glutathione(GSH)on the weight gain rate(WGR)and survival of Paralichthys olivaceus(Mean±S.D.,n=31)
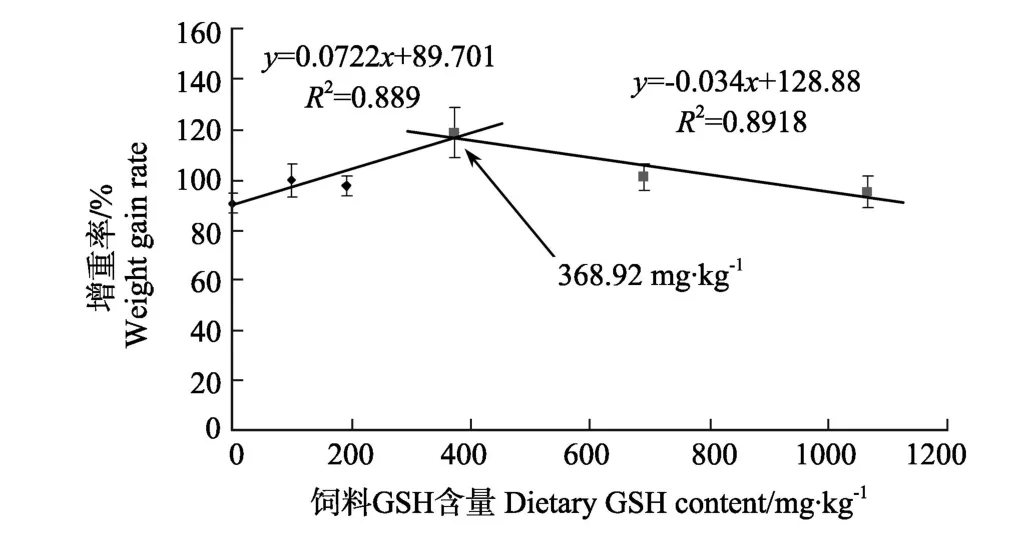
图1 饲料中还原型谷胱甘肽(GSH)的不同水平对牙鲆增重率(WGR)的影响Fig.1 Effects of dietary reduced glutathione(GSH)on the weight gain rate(WGR)ofParalichthys olivaceus
2.2 GSH对牙鲆肝脏中GSH、MDA和T-AOC的影响
如表3所示,随饲料中GSH含量的升高(0~1 063.56 mg·kg-1),肝脏GSH的含量有显著的先升高后下降的趋势。饲料中GSH含量为371.84 mg·kg-1时,肝脏中的GSH含量最高,其值为(27.97±1.77)mg·g-1prot,显著高于饲料GSH零添加组和1 063.56 mg· kg-1组(P<0.05)。
牙鲆肝脏中MDA水平随着饲料中GSH添加量的升高呈现先下降后上升的趋势,但各组间没有显著差异(P>0.05)。

表3 饲料中还原型谷胱甘肽(GSH)的不同水平对牙鲆肝脏GSH、丙二醛(MDA)和总抗氧化力(T-AOC)的影响(平均值±标准差,n=31)Table 3 Effects of dietary reduced glutathione(GSH)on the GSH,malondiadehyde(MDA)and the total antioxidative capacity(T-AOC)in hepatopancreas ofParalichthys olivaceus(Mean±S.D.,n=31)
随着饲料中GSH含量的升高,肝脏中的T-AOC有先升高后降低的趋势,且在饲料GSH含量为371.84 mg·kg-1时达到最高。各处理组T-AOC与对照组差异不显著(P>0.05),但饲料GSH含量为371.84 mg·kg-1时的T-AOC显著高于饲料GSH含量为1 063.56 mg·kg-1时的对应值(P<0.05)。
2.3 GSH对牙鲆肝脏中GPx、GST、GR和SOD活力的影响
如表4所示,随着饲料中GSH含量由0升高到1 063.56 mg·kg-1,肝脏中GPx活力有先上升后下降的趋势,但各组间差异不显著(P>0.05)。
GST活力与GPx的趋势正好相反,有先下降后上升的趋势,并在饲料GSH含量为371.84 mg·kg-1时达到最低,且显著低于其它各组(P<0.05)。
肝脏GR活性除了在饲料GSH含量为1 063.56 mg·kg-1的处理组外,其它各组均显著低于饲料GSH零添加组(P<0.05);饲料GSH含量为371.84 mg·kg-1时, GR活力显著低于其他各组(P<0.05)。
随着饲料中GSH含量的升高,肝脏中的SOD活力有先升高后降低的趋势,且在饲料GSH含量为371.84 mg·kg-1时达到最高。然而,肝脏中SOD的活力没有受到饲料中GSH含量的显著影响(P>0.05)。
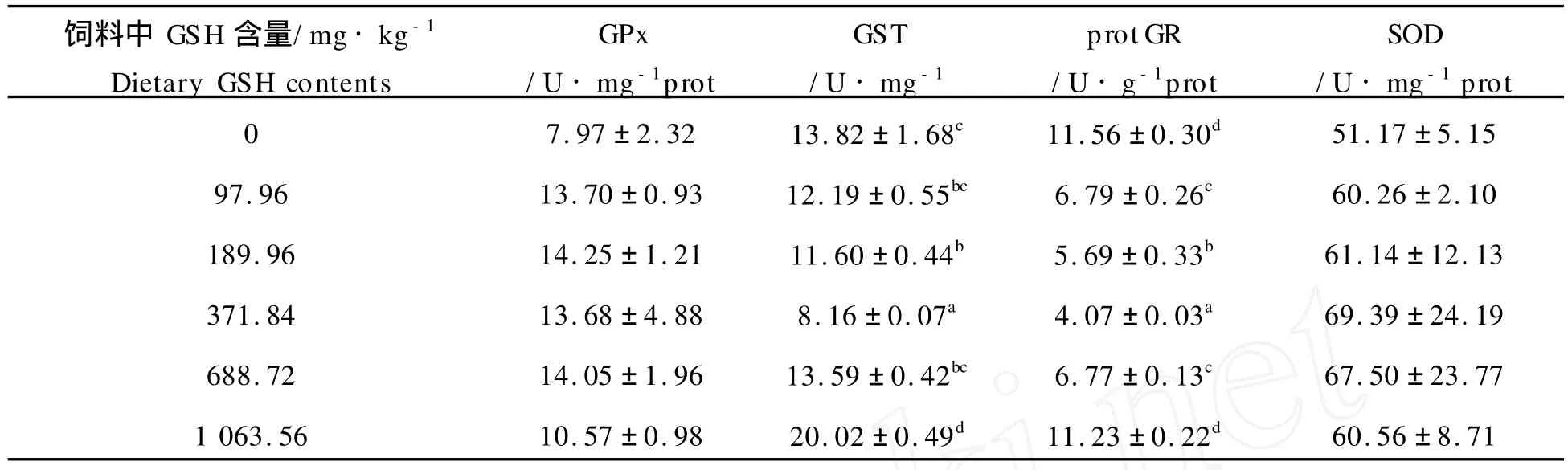
表4 饲料中还原型谷胱甘肽(GSH)的不同水平对牙鲆肝脏中谷胱甘肽过氧化物酶(GPx)、谷胱甘肽-S-转移酶(GST)、谷胱甘肽还原酶(GR)和超氧化物歧化酶(SOD)活性的影响(平均值±标准差,n=31)Table 4 Activities of Glutathione peroxidase(GPx),glutathione S-transferase(GST),glutathione reductase(GR)and the total superoxide dismutase(SOD)in hepatopancreas ofParalichthys olivaceusat different dietary reduced glutathione(GSH)levels(Mean±S.D.,n=31)
3 讨论
谷胱甘肽系统主要是指GSH、GPx、GST和GR。GSH可以在GPx和GST的催化下清除机体内H2O2和脂类过氧化过程的中间产物LOO-或LOOH、防止血红蛋白中的二价铁氧化[21]和清除各种高活性自由基[22],在此过程中GSH本身被氧化生成GSSG;而GSSG可以在GR的催化下,以NADPH为供氢体还原为GSH。当GSSG不能被及时还原为GSH的时候,GSH/GSSG的比值就要发生变化,这个比例的变化,可能是机体内一些含有巯基和二硫键的酶活性发生改变,因此谷胱甘肽在GSH和GSSG状态之间的相互转化,对于维持机体的正常生理状态十分重要[1-2]。
饲料中缺硒会导致虹鳟体内GPx的活性显著降低,同时GST活性显著上升[23]。这表明GST在鱼类体内可以在GPx活性降低情况下作为1个抵抗氧化损伤的保护性机制而存在。此外,GST可以作为反映肝脏损伤的1种敏感指标,当机体受到重金属等氧化损伤时,GST水平变化显著[24]。在本研究中,牙鲆肝脏GSH积累量显著受到饲料中不同水平GSH的影响,在饲料GSH含量为371.84 mg·kg-1时,肝脏GSH积累量最大,且肝脏中GSH的沉积量与T-AOC变化趋势一致,表明了肝脏中GSH的沉积可以提高机体总抗氧化能力。结合本实验中GPx和GST活力变化趋势,表明饲料中适当添加GSH在一定范围内可以促进牙鲆的抗氧化机能发挥作用。然而,当饲料中GSH的含量超过一定水平时(>371.84 mg·kg-1),牙鲆肝脏中GSH的沉积量下降,GPx活力降低,GST活力上升,与刘晓华等[17]在凡纳滨对虾中的研究结果相似,这可能是由于过量的GSH对机体抗氧化能力产生的负面影响[25-27]。本研究中GSH在肝脏中积累量增大时,GR活性水平相应降低,GR在机体内主要是用以维持GSH/GSSG的平衡,这表明体内GSH还原状态的维持可以由外源GSH来辅助调节,而不一定完全由内源性GSSG转化而来。
MDA作为脂质过氧化产物会对机体造成氧化胁迫和细胞损伤[27]。随着饲料中GSH含量的升高,牙鲆肝脏中MDA含量有总体下降的趋势(见表3),这表明饲料中添加适量的GSH能够减少脂质过氧化作用,保护机体免受氧化损伤。大量研究表明,GSH在体内的含量变化会保护蛋白巯基免受氧化损伤[28],在GPx的作用下催化各种亲电子化合物反应,生成无毒性或者毒性小的化合物,以解除有毒物质在体内的积累[8,29-30],GSH在体内的积累能够提高机体清除自由基的能力、提高抗氧化力[19]。本实验中随着饲料GSH含量由0增加到371.84 mg·kg-1时,肝脏T-AOC和GPx活力逐渐升高。GPx作为机体抗氧化酶系的重要组成部分,间接反映了机体自由基反应的动态变化和抗氧化能力[31-32],本实验中GPx活性的升高表明GSH能够提高机体清除有害过氧化物的能力,同时T-AOC的升高也再次证明饲料中添加适量的GSH能够提高牙鲆的抗氧化能力。然而,Thomas等[25]在分子细胞学水平的研究表明,GSH作为氧化物的前体,浓度过高时会产生毒性,从而引起DNA损伤。Sah等[26]和高姝娟等[27]的研究发现,过量的GSH与其它抗氧化剂一样,会引起氧分子生成超氧阴离子。本研究的结果也表明,饲料中GSH的含量超过371.84 mg·kg-1后,会引起牙鲆肝脏中GSH的含量降低(见表3)、T-AOC下降(见表3)、GPx活性下降(见表4)和MDA含量升高(见表3),造成抗氧化能力下降,氧化胁迫升高。
饲料中适当添加GSH能够显著促进牙鲆的生长,这与在草鱼[13]和凡纳滨对虾[17]中的研究结果一致。但对于牙鲆来说,GSH在饲料中的适宜含量为368.92 mg·kg-1,略高于草鱼饲料中的适宜添加量300 mg·kg-1[13]。在对凡纳滨对虾[17]和草鱼[13]的研究中表明,饲料中适量添加GSH可以通过提高胰岛素样生长因子IGF-1的水平而促进动物的生长。GSH是由谷氨酸、半胱氨酸和甘氨酸形成的三肽化合物,其中半胱氨酸脱羧产物半胱胺是辅酶A的组成成分,能够破坏生长抑素分子的二硫键,使生长抑素的生物学功能可逆性丧失,解除生长抑素对生长激素等激素的抑制,促进生长激素的分泌,从而起到促生长的作用,并在鳗鱼[33]和草鱼[34]的相关研究中得到了证实。另外,GSH能够在动物肠腔中起到保护肠黏膜免受毒物和过氧化物的损伤作用[35],从而保护动物消化系统。结合本实验中GSH能够对牙鲆抗氧化机能产生的积极影响,GSH对牙鲆生长的调节作用可能是综合性的,相关机理有待于进一步研究。
[1] Rahman I,MacNee W.Regu1ation of redox glutathione levels and gene transcription in lung inflammation:therapeutic approaches [J].Free Radical Biology and Medicine,2000,28(9):1405-1420.
[2] Schafer F Q,Buettner G R.Redox environment of the cell as viewed through the redox state of the glutathione disulfide/glutathione couple[J].Free Radical Biology and Medicine,2001,30 (11):1191-1212.
[3] Linder M,De Burlet G,Sudaka P.Transport of glutathione by intestinal brush border membrane vesicles[J].Biochemical and Biophysical Research Communications,1984,123(3):929-936.
[4] Vincenzini M T,Favilli F,Iantomasi T.Glutathione-mediated transport across intestinal brush-border membranes[J].Biochimica et Biophysica Acta,Biomembranes,1988,942(1):107-114.
[5] 薛飞,王广田,庞志刚,等.还原型谷胱甘肽对大鼠肝脏缺血再灌注损伤的保护作用[J].郑州大学学报:医学版,2007,42(1): 139-141.
[6] 李磊,张王君,赵清喜,等.还原型谷胱甘肽对急性坏死性胰腺炎大鼠胰腺组织脂质过氧化的保护作用[J].社区医学杂志,2008, 6(1):31-32.
[7] Kondo F,Ikai Y,Oka H,et al.Formation,characterization and toxicity of the glutathione and cysteine conjugates of toxic heptapeptide microcystins[J].Chemical Research in Toxiciology, 1992,5(5):591-596.
[8] Cossu C,Doyotte A,Jacquin M C,et al.Glutathione reductase, selenium-dependentglutathione peroxidase,glutathione levels, and lipid peroxidation in freshwater bivalves,Unio tumidus,as biomarkers of aquatic contamination in field studies[J].Ecotoxicology and Environmental Safety,1997,38:122-131.
[9] Chen G S,Xu Y,Xu L H,et al.Influence of dioxin and metalcontaminated sediment on phase I and II biotransformation enzymes in silver crucian carp[J].Ecotoxicology and Environmental Safety,1998,40:234-238.
[10] Maracine M,Segner H.Review:cytotoxicity of metals in isolated fish cells:importance of the cellular glutathione status[J]. Comparative Biochemistry and Physiology(A),1998,120:83 88.
[11] Thomas P,Wofford H W.Effects of cadmium and Aroclor 1254 on lipid peroxidation,glutathione peroxidase activity,and selected antioxidants in Atlantic croaker tissues[J].Aquatic Toxicology,1993,27(1-2):159-177.
[12] 张甬元,徐立红,周炳升,等.鱼体中谷胱甘肽对微囊藻毒素的解毒作用的初步研究[J].水生生物学报,1996,20(3):284-286.
[13] 赵红霞,谭永刚,周萌,等.饲料中添加谷胱甘肽对草鱼生长、生理指标和抗病力的影响[J].中国水产科学,2007,14(4):678-683.
[14] 曹俊明,刘晓华,周萌,等.饲料中添加谷胱甘肽对凡纳滨对虾非特异性免疫因子和相关酶活性的影响[J].华中农业大学学报,2007,26(4):528-532.
[15] 刘晓华,曹俊明,吴建开,等.饲料中添加谷胱甘肽对凡纳滨对虾肝胰腺抗氧化指标和脂质过氧化物含量的影响[J].水产学报,2007,31(2):235-240.
[16] Vincenzini M T,Iantomasi T.Intestinal uptake and transmembrane transport systems of intact GSH:characteristics and possible biological role[J].Biochem Biophys Acta,1992,1113:13-23.
[17] 刘晓华,曹俊明,吴建开,等.饲料中添加谷胱甘肽对凡纳滨对虾生长及组织生化组成的影响[J].水生生物学报,2008,32 (3):440-444.
[18] 朱选,曹俊明,赵红霞,等.饲料中添加谷胱甘肽对草鱼组织中谷胱甘肽沉积和抗氧化能力的影响[J].中国水产科学,2008, 15(1):160-166.
[19] 张国良,赵会宏,周志伟,等.还原型谷胱甘肽对罗非鱼生长和抗氧化性能的影响[J].华南农业大学学报,2007,28(3):90-93.
[20] 郭金龙,孙桂清,殷禄阁,等.牙鲆营养需求及饲养管理技术[J].河北渔业,2008(5):34-35.
[21] 郑云郎.谷胱甘肽的生物学功能[J].生物学通报,1995,30 (5):22-24.
[22] 金一尊,丁立,严敏芬.细胞谷胱甘肽含量鱼放射增敏研究[J].辐射研究与辐射工艺学学报,1996,14(3):172-176.
[23] Bell J G,Adron J W,Cowey C B.Effect of selenium deficiency on hydroperoxide-stimulated release of glutathione from isolated perfused liver of rainbow trout(Salmo gairdneri)[J].British Journal of Nutrition,1986,56:421-428.
[24] Xu Z,Bai S.Effects of waterborne Cd exposure on glutathione metabolism in Nile tilapia(Oreochromis niloticus)liver[J].Ecotoxicology and Environmental Safty,2007,67:89-94.
[25] Thomas S,Lowe J E,Hadjivassiliou V,et al.Use of comet assay to investigate the role of superoxide in glutathione-induced DNA damage[J].Biochemical and Biophysical Research Commu-nications,1998,243(1-4):241-245.
[26] Sah N K,Kumar S,Subramanian M,et al.Variation in the modulation of superoxide-induced singlestrand breaks in plasmid pBR322 DNA by biological antioxidants[J].Biochemistry and Molecular Biology International,1995,35(2):291-296.
[27] 高姝娟,刘东波,罗贵民,等.抗氧化剂抗脂质过氧化机制的ESR研究[J].波谱学杂志,1998,15(2):139-143.
[28] Arrigo A P.Gene expression and the thiol redox state[J].Free Radical Biology and Medicine Free,1999,27(9/10):936-944.
[29] Hermansky S J,Stohs SJ,Eldeen Z M,et al.Evaluation of potential chemopropectants against microcystin-LR hepatotoxicity in mice[J].Journal of Applied Toxicology,2006,11(1):65-73.
[30] Runnegar M T,Andrews J,Gerdes R G,et al.Injury to hepatocytes induced by a peptide toxin from the cyanobacterium Microcystis aeruginosa[J].Toxicon,1987,25(11):1235 1239.
[31] Mourente G M,Tocher D R,Diaze E,et al.Relationships between antioxidants,antioxidants enzyme activities and lipid peroxidation products during early development inDentex dentex eggs and larvas[J].Aquaculture,1999,179:309-324.
[32] Trenzado C,Hdalgo M C,Garc a-Gallego M,et al.Antioxidant enzymes and lipid peroxidation in sturgeon Acipenser naccarii and trout Oncorhynchus mykiss:A comparative study[J].Aquaculture,2006,254:758-767.
[33] 林浩然,张皎.半胱胺盐酸盐对鳗鱼生长性能的影响[J].饲料广角,2005(11):34-36.
[34] Xiao D,Lin H R.Effects of cysteamine-a somatostatin-inhibiting agent-on serum growth hormone levels and growth in juvenile grass carp(Ctenopharyngodon idellus)[J].Comparative Biochemistry and Physiology Part A,2003,134:93-99.
[35] Aw T Y,Williams M W,Gray L.Absorption and lymphatic transport of peroxidized lipids by rat small intestine in vivo role of mucosal GSH[J].Gastrointestinal and Liver Physiology,1992, 262(1):99-106.
Abstract: The basal diet employed casein and gelatin as main protein sources and was supplemented with reduced glutathione(GSH)up to 0,97.96,189.92,371.84,688.72 and 1 063.56 mg·kg-1diet.In the flowthrough culture system,the Japanese floundersParalichthys olivaceus(initial weight(9.49±0.22)g) were fed with graded levels of dietary GSH,respectively,for 8 weeks to evaluate their growth and antioxidative status.The results showed that survival rate was not significantly affected by dietary GSH levels(P>0.05).The average weight gain rate(WGR)in the treatment with 371.84 mg·kg-1dietary GSH was significantly higher than those in other treatments(P<0.05).The hepatic GSH concentration in dietary GSH added groups was significantly higher than that in dietary GSH deprived group(control group)(P<0.05).No significant differences in hepatic malondiadehyde(MDA)concentration were found between GSH deprived and supplemented groups(P>0.05).The lowest value of hepatic GR activities was found in treatment with 371.84 mg·kg-1dietary GSH(P<0.05).There were no significant differences in the activities of hepatic superoxide dismutase(SOD)and glutathione peroxidase(GPx)among the all treatments(P>0.05).In the group with 371.84 mg·kg-1dietary GSH,the total anti-oxidative capability(T-AOC)was significantly higher than that in the group with 1 063.56 mg·kg-1dietary GSH,however,the GST activity was significantly lower than those in the other groups(P<0.05). Based on the WGR data in the present experiment,a broken-line model was employed to calculate the optimal levels of dietary GSH,which was 368.92 mg·kg-1diet.Deficient or overdose of dietary GSH could cause negative effects on the growth and anti-oxidative capacity ofParalichthys olivaceus.
Key words: Paralichthys olivaceus;feeds;glutathione;growth;anti-oxidative capability
责任编辑 于 卫
Effects of Dietary Reduced Glutathione on Growth and Anti-Oxidative Capability of Japanese Flounder,Paralichthys olivaceus
WANG Fang-Qian,ZHANG Wen-Bing,MAI Kang-Sen,XU Wei,WANG Xiao-Jie,LIUFU Zhi-Guo
(Key Laboratory of Mariculture,Ministry of Education,Ocean University of China,Qingdao 266003,China)
S963
A
1672-5174(2011)04-051-06
国家高技术研究发展计划项目(2007AA09Z437)资助
2010-01-07;
2010-04-27
王芳倩(1984-),女,硕士生。E-mail:wangfq-2007@163.com
E-mail:wzhang@ouc.edu.cn
