眼针对急性脑缺血再灌注损伤大鼠海马组织ICAM-1表达的影响
2011-09-12潘茜孙宏伟王健于丹王守岩高原王莹王哲关洪全辽宁中医药大学沈阳110847
潘茜 孙宏伟 王健 于丹 王守岩 高原 王莹 王哲 关洪全 辽宁中医药大学 (沈阳 110847)
0.引言
脑缺血再灌注损伤与脑组织的炎症反应关系密切[1-3]。炎症介质细胞间黏附因子1(intercellular adhesion molecule-1, ICAM-1)具有介导白细胞与血管内皮细胞之间的黏附及白细胞穿过血管壁这一复杂过程的作用。正常情况下ICAM-1可在血管内皮细胞处有较低水平表达,不会引起机体的病理性损伤;而在脑缺血等病理情况下,其表达可明显升高,通
1.材料与方法
过促进炎症反应的发生,加重脑组织的损伤程度[4-6]。眼针疗法是我院著名老中医彭静山教授于上世纪70年代始创,是以眼眶周围穴区为针刺点进行防治疾病的一种微针疗法。本研究通过建立大鼠脑缺血再灌注损伤的动物模型,观察眼针治疗对大鼠海马组织中ICAM-1表达量的影响,探究眼针治疗脑缺血再灌注损伤的相关作用机制。
1.1 实验动物与分组
健康SPF级SD大鼠64只,雌雄不拘,体重280±20克,由北京维通利华实验动物中心提供,许可证编号:SCXK(京)2007-0001。适应性喂养一周,自由饮水、摄取标准颗粒饲料,室内温度22˚C,相对湿度45%。按随机数字法将大鼠分为对照组、假手术组、模型组、眼针组4组,每组16只。
1.2 模型制备与评价
参照文献[7],模型组及眼针组采用改良的线栓法复制大鼠大脑中动脉缺血再灌注损伤模型。具体如下,在室温 (22˚C) 条件下 ,大鼠用10%水合氯醛 (300mg/kg)腹腔注射麻醉后,仰卧固定于手术台上,颈部消毒后正中偏右0.5cm处纵向切开2cm切口,分离右侧颈总动脉(CCA) 、颈外动脉 (ECA) 、颈内动脉 (ICA)。其中ECA需暴露出3~5mm, ICA需分离至翼腭动脉。在ECA远端距CCA分叉处3~5mm处结扎ECA,注意:结扎用的手术线不要剪断。再用电凝器在结扎点远心端电凝ECA,用眼科手术剪在结扎点和电凝点之间剪断ECA。然后将ECA向鼠尾方向牵拉,使ECA和 ICA成一条直线。动脉夹夹闭CCA 近心端和ICA远心端,在ECA结扎点前端剪一“V”形小口,缓慢将栓塞线经ECA插入ICA,打开ICA远心端的动脉夹。栓塞线插入深度1.8cm至2.2cm。结扎ECA,逐层缝合。正常组未做处理。假手术组术式同缺血再灌注模型组、眼针组,仅未插入钓鱼线。模型组、眼针组于缺血2 h进行再灌注,再灌注后72 h进行神经功能缺损评分。模型的评价参照ZeaLonga 5分制评分标准:①0分为无症状;②1分为不能完全伸展对侧前爪;③2分为向对侧转圈;④3分为向对侧倾倒;⑤4分为不能自发行走,意识丧失。评分为1~3分者纳入实验组,未达标准者排除。
1.3 眼针取穴及刺法
取13mm毫针,眼针组于大鼠眶周2mm处针刺,定位参照人体取穴方法[8,9],取肝区、上焦区、下焦区、肾区,见图1。针刺手法:从眼眶边缘1mm部位平刺,左眼按照顺时针方向(右侧按逆时针方向),从该穴区起始定位线向终止定位线进针,进行平刺操作,刺入真皮,达到皮下组织,进针3mm,到终止定位线为止。留针20min,留针10min时用刮柄进行刮针1次,刮针5下。治疗时机:眼针组于脑缺血再灌注即刻及取材前30min分别进行眼针治疗2次。正常组、假手术组和模型组无其他处理。
1.4 试剂
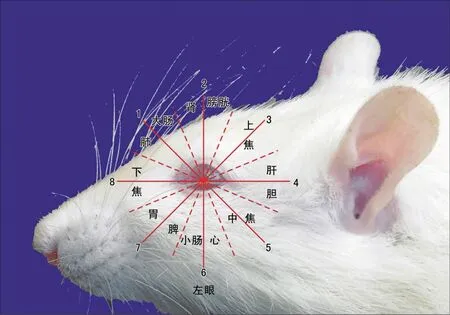
图1.大鼠眼针取穴示意图
实时荧光定量PCR试剂盒购自TaKaRa大连宝生物。ICAM引物由北京华大基因公司合成。亲和纯化兔抗鼠ICAM多克隆抗体、DAB染色试剂均购自武汉博士德生物工程有限公司。
1.5 指标测定
海马组织ICAM蛋白表达(Western blot法):于缺血再灌注损伤3h对大鼠给予10%水合氯醛腹腔注射麻醉后断头取出脑组织,去掉小脑,沿两侧大脑半球连接处将大脑半球切开,剥离出病变侧海马,按组织净重:裂解液=1:10的比例,加入相应体积的裂解液,PH值为7.5,将样品剪碎后匀浆、离心,上清即为总蛋白。兔抗鼠ICAM一抗(1:500);O–dianidine,β-naphthyl acid phosphate显色;扫描仪扫描NC膜,分析结果。
海马组织ICAM mRNA的表达采用RQ-PCR方 法:ICAM上 游 引 物:5'CAAACGGGAGATGAATGG 3';下游引物:5'CACGAAGCCCGCAAT3'。β-actin为内参,其上下游引物分别为:5' CGT GCGTGACATTAAAGAG 3',5' TTGCCGATAGTGA TGACCT 3'。所有的产物,在ABI Prism 7500 HT序列检测系统中运行。读取CT 值,以管家基因β-actin 为内参,以扩增倍数作为比较的依据, △CT = CT目的基因-CTβ-actin , △△CT =△CT实验- △CT对照,扩增倍数= 2 - △△CT。将所扩增的PCR产物同时进行溶解曲线分析。
1.6 统计学处理。
采用SPSS11.5统计软件分析,实验数据均采用“ ±s ”表示,组间比较采用单因素方差分析,P<0.05被认为有显著性差异。
2.结果
2.1 眼针对急性脑缺血再灌注损伤3h后大鼠神经缺损评分影响
模型组和眼针组大鼠均出现不同程度的神经功能障碍,如提尾时左侧前肢不能伸直,行走向对侧旋转或倾倒等;假手术组大鼠无神经功能障碍表现。模型组造模后即刻与眼针组造模后即刻及模型组再灌注损伤3h后神经功能缺损评分无显著差异,眼针组再灌注损伤3h后与造模后即刻神经功能缺损评分有显著差异(P< 0.01)。
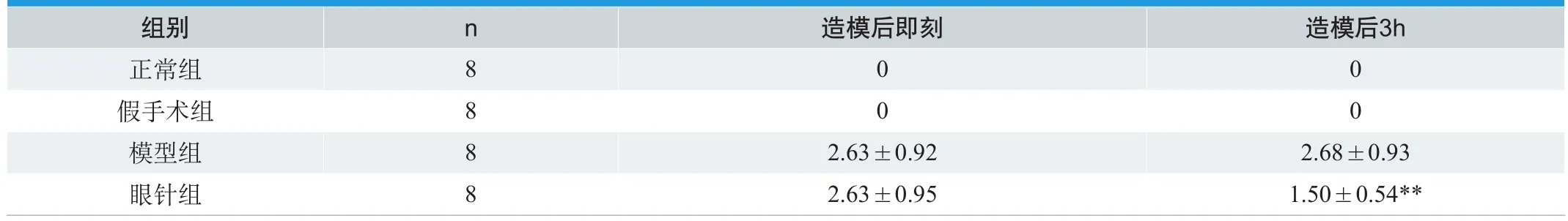
表1. 眼针对脑缺血再灌注损伤3h后神经缺损评分影响
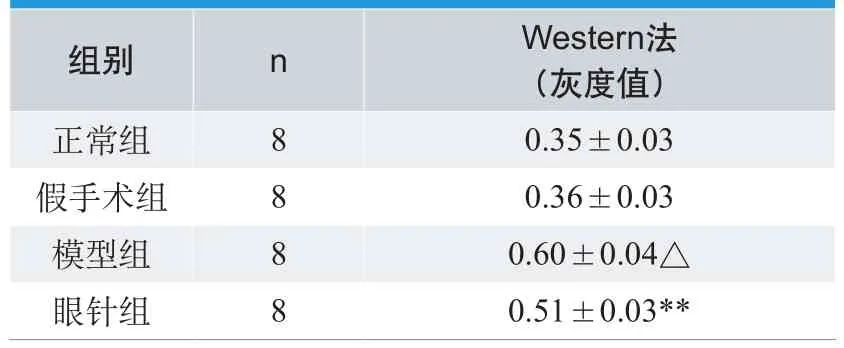
表2.眼针对急性脑缺血再灌注损伤大鼠海马组织ICAM-1蛋白表达影响
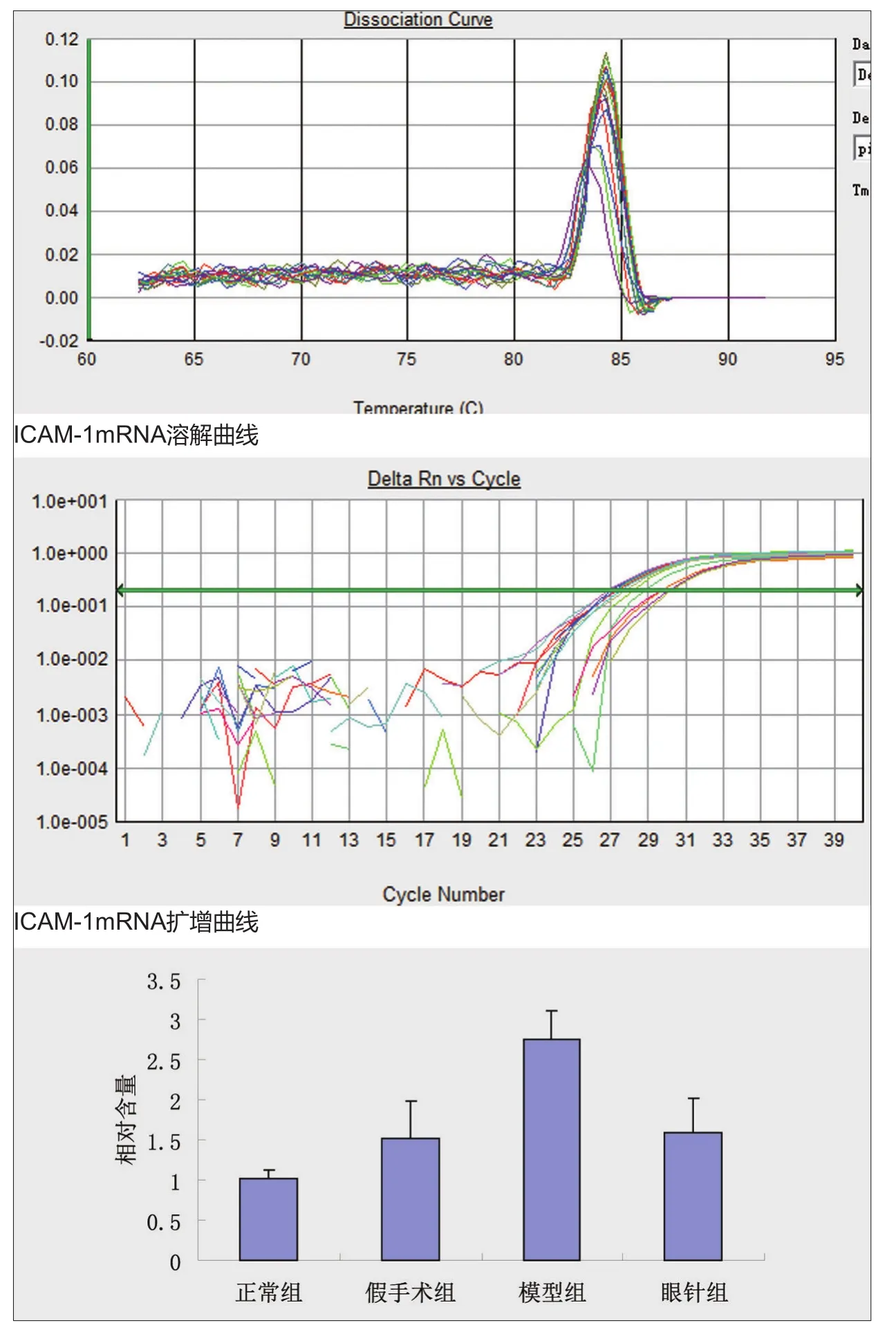
图2.眼针对急性脑缺血再灌注损伤大鼠海马组织ICAM-1mRNA表达影响注:△P<0.01,与正常组比较,*P<0.01,与模型组比较。
2.2 眼针对急性脑缺血再灌注损伤大鼠海马组织ICAM-1蛋白表达的影响
表2为采用Western blot方法检测结果:取大鼠右侧海马组织检测ICAM-1蛋白,以β-actin为内参,模型组海马组织ICAM-1蛋白表达明显高于正常组和假手术组,眼针组ICAM-1蛋白表达明显低于模型组(P<0.01)。
2.3 眼针对急性脑缺血再灌注损伤大鼠海马组织ICAM-1mRNA表达的影响
采用实时定量PCR方法检测海马组织ICAM-1mRNA表达的结果如图2所示,本实验选用β-actin作为内参,ICAM基因扩增产物大小为86bp,β-actin基因扩增产物为132 bp。模型组脑组织ICAMmRNA表达较正常组、假手术组增加,眼针组表达较模型组减少,均有显著差异(P<0.01)。
3.讨论
由辽宁中医药大学附属医院著名老中医彭静山教授于上世纪70年代首创的眼针疗法,是在眼眶周围应用针刺等刺激防治疾病的一种微针疗法,用于临床30余年来,疗效显著。研究表明脑缺血再灌注损伤的发生与脑组织缺血后发生炎症反应关系密切[10]。细胞间黏附因子1(ICAM-1)属免疫球蛋白超家族成员,与白细胞的浸润关系密切,可促进炎症反应的发生。本实验通过建立大鼠脑缺血再灌注损伤模型,应用Western blot、实时荧光定量聚合酶链反应(RQ-PCR)方法测定海马组织ICAM-1蛋白及mRNA表达的变化,观察眼针治疗对大鼠海马组织中ICAM-1含量的影响,探究眼针治疗脑缺血再灌注损伤的相关作用机制。
本研究发现,大鼠脑缺血再灌注损伤模型组和眼针组大鼠均出现不同程度的神经功能障碍;模型组造模后即刻与眼针组造模后即刻及模型组再灌注损伤3小时后神经功能缺损评分无显著差异,眼针组再灌注损伤3小时后与造模后即刻神经功能缺损评分有显著差异(P<0.01)。该结果表明眼针治疗有助于改善大鼠脑缺血神经功能损伤程度,利于大鼠神经功能的恢复。Western blot方法和实时定量PCR方法检测结果表明,模型组海马组织ICAM-1蛋白及mRNA表达水平明显高于正常组和假手术组,眼针组ICAM-1蛋白及mRNA表达明显低于模型组(P<0.01)。该结果表明经眼针治疗后,脑缺血再灌注损伤大鼠海马组织中ICAM-1含量明显降低,同时大鼠神经功能缺损程度降低。
本研究结果表明脑缺血再灌注损伤后,大鼠海马组织可通过增加 ICAM-1的表达量,进一步促进炎症反应的发生,加重脑组织的损伤,致使大鼠出现如提尾时左侧前肢不能伸直, 行走向对侧旋转或倾倒等神经功能缺损的症状。应用眼针的治疗方法,可通过降低脑缺血再灌注后大鼠海马组织中ICAM-1的含量,抑制白细胞在血管内皮上的黏附,减轻炎性反应的发生,使大鼠神经功能缺损的症状得到缓解。
脑缺血早期的炎症反应对于缺血性脑损伤的最终范围和程度的影响具有重要意义[11]。本研究通过建立大鼠局灶性脑缺血再灌注损伤的动物模型,揭示了“眼针疗法”治疗中风病与炎症相关的部分作用机制,为发挥针灸防治常见病作用,进一步完善“眼针疗法”提供一定的理论依据。
[1]Iadecola C, Alexander M. Cerebral ischemia and inf l ammation. Curr Opin Neurol. 2001; 14:89-94.
[2]Kao TK, Ou YC, Kuo JS, Chen WY, Liao SL, Wu CW, Chen CJ, Ling NN, Zhang YH, Peng WH. Neuroprotection by tetramethylpyrazine against ischemic brain injury in rats. Neurochem Int. 2006; 48:166-176.
[3]Merrill JE,Benveniste EN.Cytokines in inflammatory brain lesions:helpful and harmful[J].Trends Neurosci,1996,19(18):331-338.
[4]Jianping Cao,Xueyin Shi,Weiyan Li,Jian Liu , Xiaoyong ,ect.Protective effect of anti-intercellular adhesion molecule-1 antibody on global cerebral ischemia/reperfusion injury in the rat BioScience Trends. 2009; 3(2):48-52.
[5]高分飞,石刚刚,张 力,等.缺血-再灌注损伤研究进展[J].现代诊断与治疗, 2003, 14(2): 88-91.
[6]Tamatani T, Miyasaka M. Identification of monoclonal antibody reactive with the rat homologue of ICAM-1, and evidence for differential involvement of ICAM-1 in the adherence of resting versus activated lymphocytes to high endothelial cells. Int Immunol. 1993; 2:166-172.
[7]马贤德,孙宏伟,柴继严,等.线栓法制备大鼠脑缺血再灌注模型的方法研究,中华中医药学刊,2009,27(6):1200-1201.
[8]彭静山.眼针疗法[M].沈阳:辽宁科学技术出版社,1990.11.
[9]田维柱. 中华眼针[M]. 沈阳:辽宁科学技术出版社, 1998:78-88.
[10]Chin YC, Shan YS, Nou YT, Tin YH, Su YC, Ching LH. Ferulic acid provides neuroprotection against oxidative stressrelated apoptosis after cerebral ischemia/reperfusion injury by inhibiting ICAM-1 mRNA expression in rats. Brain Res.2008; 1209:136-150.
[11]Vemuganti R, Dempsey RJ, Bowen KK. Inhibition of intercellular adhesion molecule-1 protein expression by antisense oligonucleotides is neuroprotective after transient middle cerebral artery occlusion in rat. Stroke. 2004; 35:179-184.
