体外转录法制备西尼罗河热病毒RNA片段
2011-09-11邹艳丽赵永刚张永强包静月孙成友王君玮李金明王志亮
邹艳丽,赵永刚,张永强,包静月,孙成友,王君玮,李金明,王志亮
(中国动物卫生与流行病学中心国家外来动物疫病诊断中心,山东青岛 266032 )
西尼罗河病毒(West Nile virus,WNV)是黄病毒科黄病毒属成员,它会引起人畜共患病[1]。因于1937年首次从非洲乌干达西尼罗河地区一名发热妇女血液中分离到而得名[2]。与日本脑炎病毒、墨累河谷脑炎病毒、圣路易斯脑炎病毒和昆津病毒同属日本脑炎病毒血清群。该病毒是蚊媒病毒,主要经库蚊传播给人、马和鸟类等,可引发西尼罗河热和致死性的西尼罗河病毒性脑膜脑炎,其中西尼罗河热被世界动物卫生组织列为重大疫病。西尼罗河病毒分布广泛,1950年埃及3名儿童的血液中分离到病毒,60年代早期第一次报道从埃及和法国的马中分离到病毒[3]。据报道,已从以色列、南非、刚果、印度等地分离到病毒,此后西尼罗河病广泛分布于非洲和中东。近几年,阿尔及利亚(1994)、罗马尼亚(1967—1997)、捷克(1997)、刚果(1998)、俄罗斯、美国(1999)都先后暴发过西尼罗河热[4]。在世界上许多国家和地区引起流行,造成人、马和鸟类的大量感染及死亡,给发病国家造成重大危害,成为全球兽医界和公共卫生部门的一大难题。我国目前还没有发现西尼罗河病毒,但存在传入的风险,因此建立快速、准确的检测方法对于我国预防该病毒的入侵具有重大意义。
1 材料与方法
1.1 材料
1.1.1 菌种 质粒DH5α购自大连宝生物公司,EII基因由上海生工合成并克隆到PUC59载体上。PGEM-T-easy载体购自Promega公司。
1.1.2 主要试剂 普通PCR试剂盒、RT-PCR试剂盒、DL2000均购自TaKaRa公司,胶回收试剂盒购自上海华舜公司,Riboprobe System-T7体外转录试剂盒购自Promega公司。
1.2 方法
1.2.1 引物设计 根据WNV毒株的EII蛋白基因序列,设计引物。
WNV5ST75′- TAATACGACTCTATAGGGCGATTT TTTTTTTTTTTTATGGGAGAAGCT CAC AAT GAC-3′;WNV6R 5′- GCAAGGTCCATCCGTGCCAGTGTAC-3′
在上游引物的5'端引入T7启动子。引物由大连宝生物工程公司合成。
1.2.2 序列合成 根据大肠杆菌表达密码子偏爱性和密码子的简并性修改并合成序列。
ATG GGA GAA GCT CAC AAT GAC AAA CGT GCT GAC CCA GCT TTT GTG TGC CGTCAA GGA GTG GTG GAC CGT GGC TGG GGC AAC GGC TGC GGA CTG TTT GGC AAA GGA AGC ATT GAC ACA TGC GCC AAA TTT GCC TGC TCT ACC AAG GCA ATC GGACG T ACC ATC TTG AAA GAG AAT ATC AAG TAC GAA GTG GCC ATT TTT GTC CAT GGACCA ACT ACT GTG GAG TCG CAC GGA AAC TAC TCC ACA CAG GCT GGA GCC ACT CAG GCA GGG CGT TTC AGC ATC ACT CCT GCG GCG CCT TCA TAC ACA CTG AAG CTT GGA GAA TAT GGA GAG GTG ACA GTG GAC TGC GAA CCA CGT TCA GGG ATT GAC ACC AAT GCA TAC TAC GTG ATG ACT GTT GGA ACA AAG ACG TTC TTG GTC CAT CGT GAG TGG TTC ATG GAC CTC AAC CTC CCT TGG AGC AGT GCT GGA AGT ACT GTG TGG CGT AAC CGT GAG ACG TTA ATG GAG TTT GAG GAA CCA CAC GCC ACG AAG CAG TCT GTG ATC GCA TTG GGC TCA CAA GAG GGA GCT CTG CAT CAA GCT TTG GCT GGA GCC ATT CCT GTG GAA TTT TCA AGC AAC ACT GTC AAG TTG ACG TCG GGT CAT TTG AAG TGC CGT GTG AAG ATG GAA AAA TTG CAG TTG AAG GGA ACA ACC TAT GGC GTC TGC TCA AAG GCT TTC AAG TTT CTT GGG ACT CCGGCA GAC ACA GGT CAC GGC ACT GTG GTG TTG GAA TTG CAG TAC ACT GGC ACG GAT GGA CCT TGC
1.2.3 PCR扩增 反应体系为:DNA 1 μL,上下游 引 物(25 pmol)各 1 μL,dNTP 2 μL,10×PCR Buffer 2.5 μL,rTaq 0.5 μL,ddH2O 18.5 μL,总体系25 μL。反应条件:95 ℃预变性 5 min;94 ℃变性 30 s,55 ℃退火30 s,72 ℃延伸1 min,循环35次;最后72℃延伸7 min。
1.2.4 连接与转化 在T4 DNA连接酶作用下,纯化的PCR产物与PGEM-T easy载体于25 ℃连接1 h后,用CaCl2法制备感受态细胞,将连接产物转化至DH5α细胞中。
1.2.5 重组质粒筛选与鉴定 使用蓝白斑试验筛选重组质粒,挑取白色菌落转接至含氨苄青霉素100 μg/mL的LB培养液中,37 ℃,210 r/min培养过夜,提取质粒DNA。以质粒为模板,利用设计的引物进行PCR扩增,检查插入片段的大小,根据目的片段大小来判定其阳性,送交上海生工进行双向测序。
1.2.6 重组质粒载体的线性化处理与浓度测定 质粒用NdeⅠ内切酶经37℃消化2 h,1%琼脂糖凝胶电泳鉴定酶切产物,观察线性化结果。
1.2.7 体外转录、模板RNA标准品的制备 利用Riboprobe System-T7试剂盒,室温配制20 μL反应体系:5×Buffer 4 μL,DTT (100 mmol/L)2 μL,RNasin(40U)1 μL,rNTP (终浓度各为0.5 mmol/L)5 μL,线性化质粒(0.3 μg/μL) 2 μL,T7 poly(18 U)1 μL,DEPC H2O 5.5 μL。反应条件为 37 ℃ 1 h。转录产物加Dnase(1 U/μL)1.5 μL继续反应20 min除去DNA模板,用RNA转录纯化试剂盒进行纯化并用NanoDrop ND1000分光光度计定量。转录产物浓度可以换算为拷贝/μL。拷贝数=浓度×阿伏加德罗常数/ (1个碱基对的平均分子质量×总长度),阿伏加德罗常数为6.02×1023。用DEPC水将其分别依次梯度稀释,取各稀释液作模板,进行RT-PCR,引物和扩增条件与前述步骤相同。分装作为标准品,-80 ℃冻存。
2 结果
2.1 西尼罗河热病毒基因重组质粒的PCR鉴定
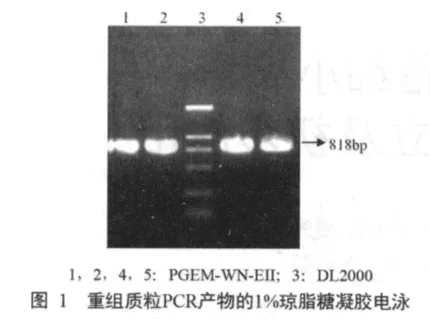
以Trizol提取的RNA为模板,用WNV5ST7,WNV6R为引物,经PCR扩增后应得818 bp长的片段,经1%琼脂糖凝胶电泳,结果显示扩增出的目的片段大小与预期值相符合(图1)。
2.2 测序结果比对
登录Genebank,将质粒插入片段的测序结果进行比对,结果显示,克隆的DNA序列与合成的基因序列相应片段的同源性100%,证实碱基序列正确,能够进入下一步的体外转录等试验。
2.3 cRNA标准品质量浓度测定
体外转录的cRNA经核酸蛋白测定仪测定,其质量浓度为352.6 ng/μL,D260 nm/D 280 nm 分别为1.92。根据拷贝数计算公式,将其梯度稀释为5.0×1011~5.0×102拷贝 /μL-80℃保存。
2.4 体外转录结果鉴定
以梯度稀释的体外转录RNA产物作模板,作RTPCR。体外转录产物RT-PCR电泳结果见图2。由图可知,PCR产物为818 bp,且转录产物质量浓度5.0×102拷贝/μL时,仍出现清晰目的条带,在质量浓度为5.0×102拷贝/μL时均出现清晰目的条带。
3 讨论
建立特异、敏感、快速的西尼罗河热病原诊断方法,是我国对外来疫病西尼罗河热防控技术储备需要。我们为此制备了西尼罗河热病毒的RNA标准品,为以后的检测作阳性对照来用。
本研究采用构建含有T7启动子的重组质粒,直接用T7 RNA聚合酶进行体外转录获得RNA片段,并准确定量,可作为西尼罗河热病毒的核酸扩增快速诊检技术方法的阳性对照,无生物安全隐患。同时也避免了以往研制的商品化试剂盒中质粒标准品不能很好地对样品处理及逆转录过程进行有效控制的问题[5-6]。
本研究成功克隆了西尼罗河热病毒的保守基因,并构建了相应的重组质粒,进行体外转录获得了阳性RNA标准品,进行了准确定量,为进一步开展西尼罗河热病毒的功能、结构等研究奠定了基础,同时为后续建立和优化西尼罗河热病毒核酸快速检测的方法学研究,如实时荧光定量PCR、依赖核酸序列的扩增(NASBA)和环介导的等温扩增(LAMP)技术等,提供了基础。
[1]Petersen L R,Marfin A A.West Nile virus:a primer for the clinician[J].Ann Intem Med,2002,137(3):173-179.
[2]Smithbum K C, Hughes T P,Burke A W, et al. A neurotropic virus isolated from the blood of a native of Uganda[J].Am J Trop Med Hyg,1940,20(4):471-492.
[3]Hubalek Z,Halouzka J. West Nile fever—a reemerging mosquito-borne viral disease in Europe[J].Europe Emerg Infect Dis, 1999,5(5):643-650.
[4]Lanciotti R S,Roehrig J T,Deubel V,et al. Origin of the West Nile Virus responsible for an outbreak of encephalitis in the Northeastern United States[J].Science,2000,286(2): 333-337.
[5]Lambrechts L,Chevillon C,Albright R G,et al.Genetic specif i city and potential for local adaptation between dengue viruses and mosquito vectors[J]. BMC Evol Biol,2009,174(9):160-170.
[6]Scott T W,Morrison A C.Vector dynamics and transmission of dengue virus:implications for dengue surveillance and prevention strategies:vector dynamics and dengue prevention[J].CurrTop Microbiol Immunol,2010,338(1):115-128.
