猪链球菌感染风险因子分析及控制要点
2011-08-16刘佩红孙学强沈素芳陆承平
王 建 ,刘佩红 ,孙学强 ,沈素芳 ,陆承平
(1.上海市动物疫病预防控制中心,上海 201103 ;2.南京农业大学农业部动物疫病诊断与免疫重点开放实验室 ,江苏南京 210095;3.中国动物卫生与流行病学中心,山东青岛 266032 )
猪链球菌病是猪由链球菌感染所引起的一类疾病的总称。临床上表现为败血症、脑膜炎、关节炎、心内膜炎、颊部脓肿及局部皮肤和皮下脓肿等。该病分布范围极广,世界各地均有发生,且血清型众多,抗原结构复杂,是多年来一直困扰我国养猪业的主要传染病之一[1-3]。该病在20世纪七、八十年代曾在我国广泛流行,其病原均确诊为兰氏C群链球菌,其中以马链球菌兽疫亚种为主[2-3]。1990年代,我国由于注射C群链球菌疫苗进行免疫,猪链球菌病疫情有所缓解,但是猪链球菌2型的流行却呈逐年上升趋势。1990年初首次报道在广东省发现猪链球菌2型疑似病例,1998—1999年江苏省部分地区猪群中连续2年在盛夏季节突然暴发流行该病,不但造成大量猪死亡, 而且有25人感染发病,死亡14人[4]。2005年7月四川省9个地市26个县区先后暴发猪链球菌2型病,生猪因发病死亡的同时,与病猪有密切接触的人群感染猪链球菌病的病例报告有206例,死亡38例[5],此后四川、重庆、广东、广西、江苏、安徽等地陆续又有猪-人感染报道。猪链球菌2型感染不仅给养猪业造成严重的经济损失,而且给公共卫生和食品安全造成严重威胁,猪链球菌病已成为近年来引起各国生猪业损失和公共卫生威胁的一种人畜共患病[2-3]。
造成猪场发生链球菌感染的因素比较复杂,一般认为猪群猪链球菌带菌率高达30%~75%,而猪链球菌2型带菌率达20%~30%,很多不同的血清型或菌株常存在于猪的扁桃体和鼻腔中,但不一定发病[1-3]。饲养条件不适可能增加猪链球菌病暴发的危险性,这些因素包括:高温高湿、气候变化、圈舍卫生条件差、过度拥挤,通风不良(氨气、CO2、灰尘浓度或湿度过高),温度的波动大,不同日龄的猪混群,粪尿污染严重,出现免疫抑制病(PRRS、PCV-2、PR)等。本文通过查阅相关文献,对猪链球菌感染的风险因素进行分析,并引入HACCP理念确定控制要点。
1 猪链球菌在环境及载体中的存活能力
猪链球菌2型常污染环境,在粪、灰尘及水中能存活较长时间。在水中4 ℃可存活1~2 W,50 ℃为2 h,60 ℃为10 min;灰尘中0 ℃可存活54 d、9 ℃为25 d,22~25 ℃时为24 h以内;粪便中0 ℃可存活104 d、9 ℃为10 d,22~25 ℃时为8 d;在腐尸中4 ℃可存活42 d,22~25 ℃时为12 d,这样就为鸟、鼠或犬的间接传播提供了重要的传染来源[1-3]。
日光直射2 h死亡。冷冻6个月特性不变。常用消毒剂、清洁剂如2%石炭酸、0.1%新洁尔灭、1%来苏尔、1%酶酚皂液等均可在3~5 min内可杀死SS2。污染和有机物存在影响消毒效果,清除表面污物可提高消毒效果,减少猪和从业人员感染的机会。对青霉素类、喹诺酮类、头孢菌素类、磺胺类等药物敏感[1,3]。
2 猪链球菌的传播途径
猪链球菌的传播机制主要是通过直接接触或污染环境进行水平传播,也可垂直传播(有些新生仔猪可在分娩时感染)。病猪、病尸、病愈带菌猪和隐性感染猪是主要传染源。病猪与健康猪接触、吸入污染的空气浮尘、或由病猪排泄物(尿、粪、唾液等)污染的饲料、饮水及动物均可引起猪只大批发病而造成流行[6]。
病菌通常从口腔或鼻腔侵入机体,定植在猪的上呼吸道(尤其是鼻腔和扁桃体)、生殖道和消化道,4~6月龄的猪扁桃体携带率为32%~50%表现亚临床症状病猪的鼻腔或扁桃体中可分离出猪链球菌2型,该种带菌猪可成为传染源[7]。本病主要经呼吸道、消化道和损伤的皮肤感染,体表外伤、断脐、阉割、注射消毒不严等往往造成感染发病。
鼠和猪之间可发生自然传播,昆虫媒介在疾病的传播中也起重要作用[7]。Enright证实,苍蝇能在猪场内或不同场间通过机械携带传播本病,其它动物或鸟类作为传染源或传播媒介的重要性仍有待证实[8]。

表1 猪链球菌感染风险因子
SS2垂直传播机制并不清楚,Robertson等发现,母猪生殖道内存在SS,分娩的过程中仔猪可能被感染,但目前仍没有证据表明,公猪生殖器携带本菌[9]。
3 猪链球菌在猪体内分布
我们通过建立的猪链球菌仔猪动物感染模型,掌握了猪链球菌在猪体内的分布情况[10-11],猪链球菌存在于病猪的各实质器官、血液、肌肉、关节和分泌物及排泄物中。病死猪肉、内脏及废弃物处理不当、活猪市场及运输工具的污染等都是造成本病流行的重要因素[1,3]。
4 猪链球菌病的流行特点
不分年龄、品种和性别的猪,均易感,但大多数3~12周龄的仔猪易暴发流行,尤其在断奶及混群时易出现发病高峰。猪链球菌病的流行无明显季节性,一年四季均可发生,一般呈散发性,但7~10 月份易出现大面积流行。新疫区及流行初期多为急性败血症和脑炎型,来势凶猛,病程短促,死亡率高;老疫区及流行后期多为关节炎或淋巴结脓肿型,传播缓慢,发病率和死亡率低,但可在猪群中长期流行[1-3]。
5 猪链球菌病发病诱因
拥挤、通风不良、气候骤变、混群、运输迁移、免疫接种,体表外伤、断脐、阉割等压力下都可诱使猪只感染猪链球菌[15]。在有许多其他的细菌和病毒感染压力下,特别是PRRS、PCV-2、PR等免疫抑制病,可加速猪链球菌的感染[1]。为了能建立猪链球菌感染及疫苗免疫保护效果评价的仔猪动物模型,我们采用PRRS弱毒预感染,然后进行猪链球菌攻毒试验取得了较好的实验效果,说明PRRS、PCV-2、PR等免疫抑制病感染确实是猪链球菌病的发病诱因[10-11]。
6 猪链球菌感染的风险因子分析
为了能比较清楚地排查猪链球菌感染的风险因子,我们通过查阅相关文献,引入HACCP的理念对猪链球菌感染进行危害分析和防控[12-13],猪场猪链球菌感染的流程分析图2,风险因子见表1。
对所有的风险因子我们绘制了关键控制点(CCP)决策树(见图 1),来判定是否为CCP。有些风险可通过严格遵守并实施良好的猪场操作规范GFP(good farming practice)来控制,如温度、湿度、运输、清洁消毒、污染物控制、病死猪处理、饲养密度、诊断监测、应激、昆虫、鼠类、尘埃等。
猪链球菌感染流程的潜在风险的分析见表2。
7 猪场猪链球菌感染的控制要点
我国已制定了《GB/T 17824.1-2008 规模猪场建设》《GB/T 17824.2-2008 规模猪场生产技术规程》以控制的。隐性带菌猪、混群饲养、精液、免疫抑制病(PRRS、PCV-2、PR等)、疫苗免疫、药物预防等应该是控制的关键点(CCP)。因为按照标准化操作,无法确保这些风险可以控制。对这几个控制点进行控制应该是我们工作的重点。控制措施见表3。
要取得理想的控制效果,对猪场的设施、管理水平的要求较高,需要猪场具有良好的操作规范,另外还需加强技术培训的开展。对基地生产技术人员、管理人员展开相关的技术培训,包括样品采集技术、消毒技术、生产工艺技术、疫病综合防控技术等。
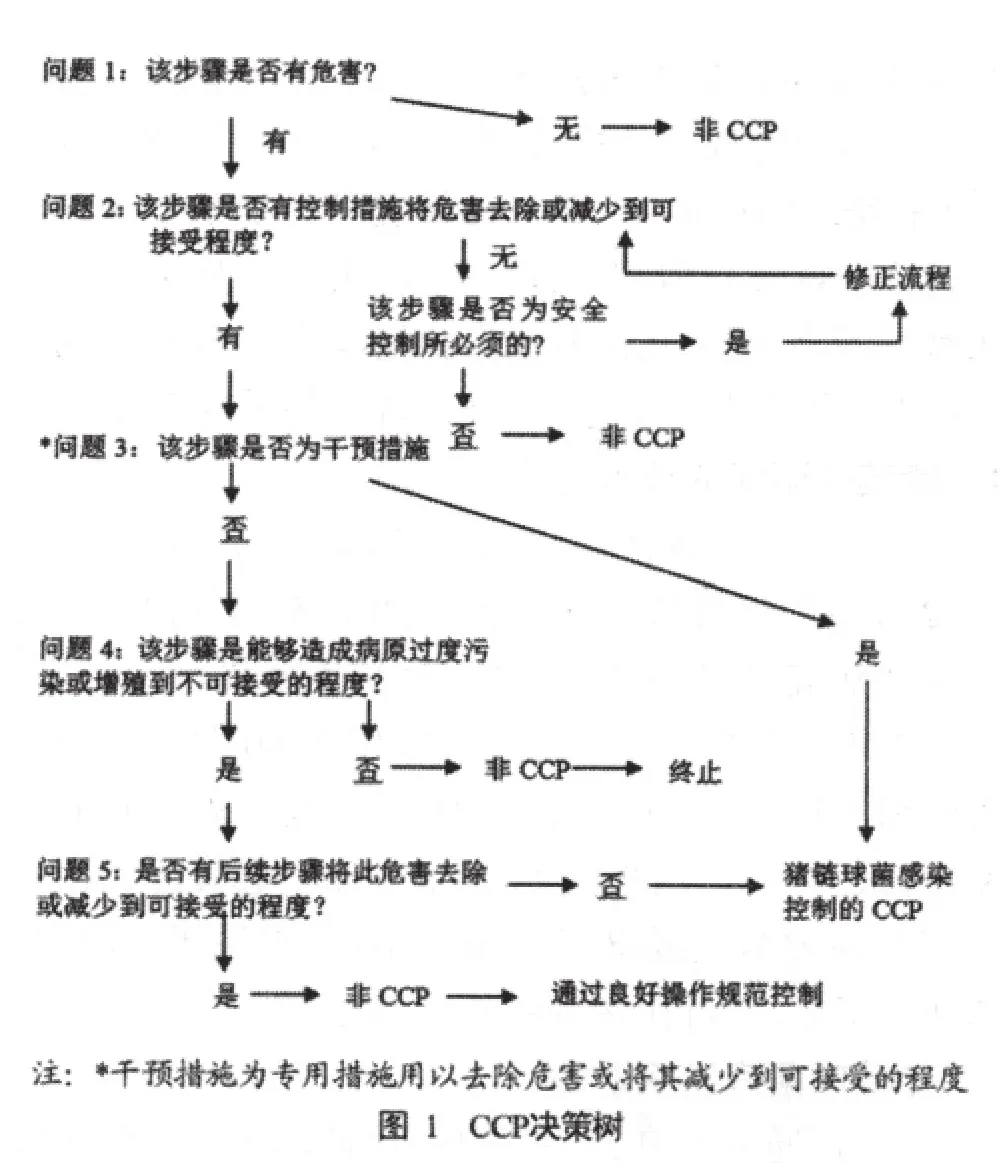
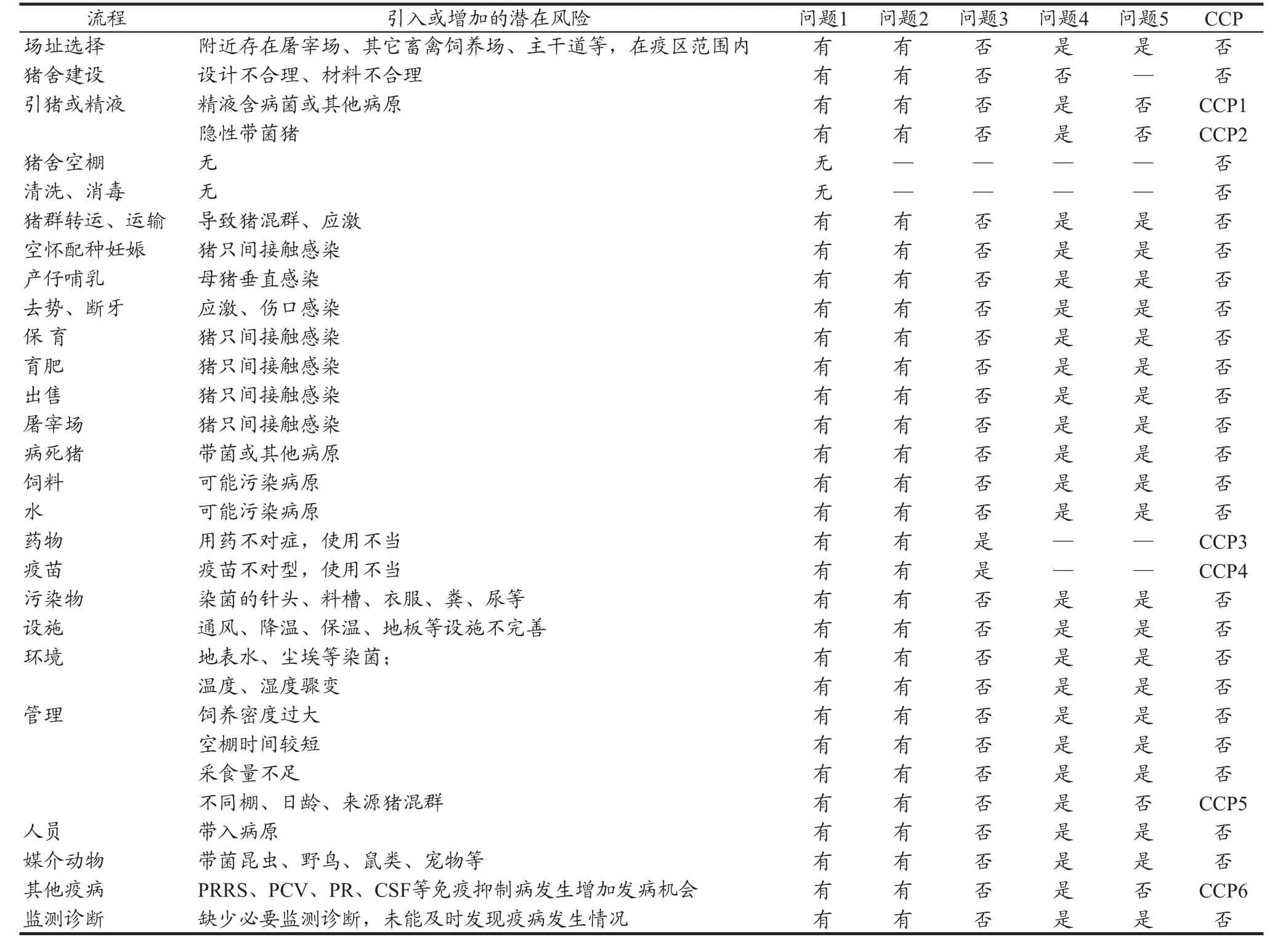
表 2 猪链球菌感染风险因子分析
8 讨论
近二十年来,随着我国养猪业朝集约化和规模化的发展,猪饲养密度的不断增大,猪链球菌病已成为危害严重的三大细菌病之一,同时猪链球菌2型还是近年来新出现的重要人畜共患病病原,给人类的健康安全带来巨大挑战。猪链球菌的控制和根除是个世界难题,人们试图通过投药、隔离饲养、监测清除阳性猪《GB/T 17824.3-2008规模猪场环境参数及环境管理》《GB/T 17823-2009 集约化猪场防疫基本要求》等标准,猪场在标准化操作的基础上,许多风险因素是可等做法来根除猪链球菌,但虽然花费了大量的人力、物力却都未获成功。在欧洲,通过减群、清洁、消毒,并在至少6周后重新引进猪链球菌2型阴性的猪群成功根除了2型链球菌病,其中一个扩群的猪场因离感染阳性的大型猪场距离很近又发生了疾病,其它11个猪场仍保持阴性。使用隔离断奶(isowean)无法根除猪链球菌,药物早期断奶(MEW)可以控制猪链球菌2型,方法为:在产仔前,母猪产前使用青霉素,仔猪出生后至10日龄每日注射青霉素或头孢噻呋,5日龄断奶隔离饲养,但这种方法不能清除猪链球菌所有型[14]。我们期望通过关键控制点的控制这种成本相对较低的方式,将猪链球菌感染风险降低,下一阶段将具体对建立的综合防控措施的应用效果进行验证、分析。
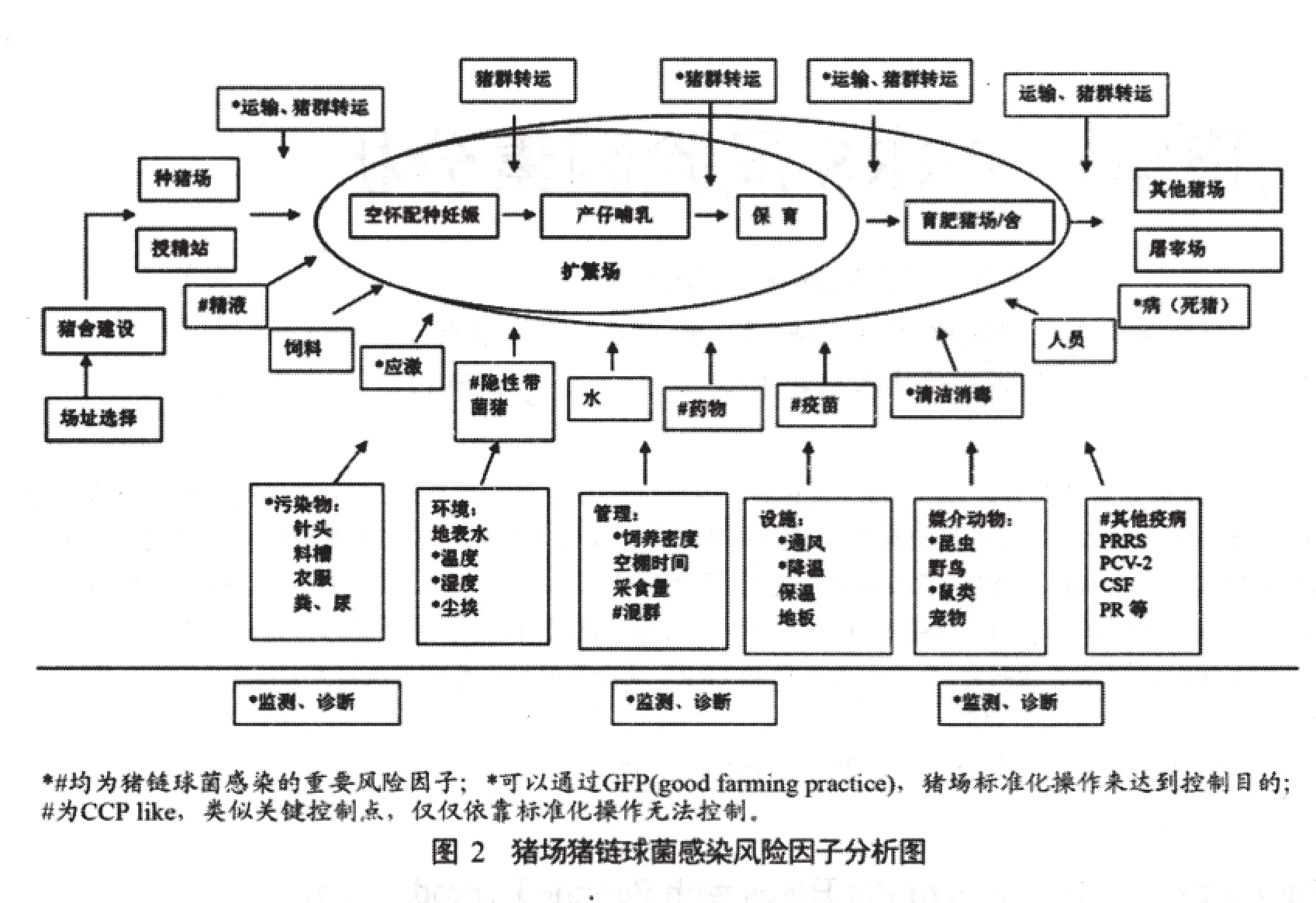

表3 猪链球菌感染控制措施
[1] Straw B E,Zimmerman J J,Allaire S D,et al. Diseases of Swine[M].9th ed. Iowa:Blackwell Publishing Professional,2006:769-784.
[2] 陆承平.兽医微生物学[M].4版.北京:中国农业出版社,2007.
[3] 杨正时,房海.人及动物病原细菌学[M].石家庄:河北科学技术出版社,2003:332-358.
[4] Wei Z,Li R,Zhang A,et al.Characterization of Streptococcus suis isolates from the diseased pigs in China between 2003 and 2007[J]. Vet Microbiol,2009,137(1/2):196-201.
[5] Yu H,Jing H,Chen Z,et al.Human Streptococcus suis outbreak,Sichuan,China[J]. Emerg Infect Dis,2006,12(6):914-920.
[6] Staats J J,Feder I,Okwumabua O. Streptococcus suis:past and present[J]. Vet Res Commun,1997,21(6):381-407.
[7] Enright M R,Alexander T J,Clifton-Hadley F A. Role of houseflies(Musca domestica)in the epidemiology of Streptococcus suis type 2[J]. Vet Rec,1987,121(6):132-133.
[8] Madsen L W,Svensmark B,Elvestad K,et al.Streptococcus suis serotype 2 infection in pigs: new diagnostic and pathogenetic aspects[J]. J Comp Pathol,2002,126(1):57-65.
[9] Lun Z R,Wang Q P,Chen X G,et al. Streptococcus suis:an emerging zoonotic pathogen [J]. Lancet Infect Dis,2007,7(3) :201-209.
[10]Zhao Z Z,Wang J,Liu P H,et al. Cultivation,LD50 determination and experimental model of Streptococcus suis serotype 2 strain HA9801[J]. Research in Veterinary Science,2009,86(2):200–205.
[11]齐新永,王建,刘佩红,等.猪链球菌2型感染普通仔猪模型的建立及其病理学观察[J].中国畜牧兽医,2009(3):146-149.
[12] Horchner P M,Pointon A M.HACCP-based program for onfarm food safety for pig production in Australia[J]. Food Control,2011,22(10):1674-1688.
[13] Noordhuizen J P,Frankena K. Epidemiology and quality assurance:applications at farm level[J].Preventive Veterinary Medicine,1999,39(2):93-110.
[14] Harris D L. Multi-Site Pig Production [M].Iowa:Blackwell Publishing Professional,2000:57-78.
