水稻单粒种子DNA提取及SSR-PCR反应体系的正交设计优化
2011-09-08李炫丽王世才许双全
李炫丽,王世才,许双全
(湖北省种子集团有限公司禾盛生物育种研究院,武汉 430070)
水稻单粒种子DNA提取及SSR-PCR反应体系的正交设计优化
李炫丽,王世才,许双全
(湖北省种子集团有限公司禾盛生物育种研究院,武汉 430070)
本文以水稻单粒干种子为材料进行DNA提取方法和SSR-PCR反应体系的优化研究,结果表明:用CTAB法提取的水稻干种子DNA较为完整,降解量少,可获得理想的扩增效果。在试验设计范围内,确定的最佳反应体系为20 μL,其中含模板DNA 45ng,dNTPs浓度为0.15 mmol/L,引物浓度为0.4 μmol/L,Mg2+浓度为1.5 mmol/L,Taq酶为1.6 U。
水稻;种子;CTAB法;SDS法;SSR-PCR体系优化
我国是世界上第一个在生产上利用水稻杂种优势的国家,杂交水稻的推广对大幅度提高水稻单产起了巨大作用。但是,由于种子质量问题给农户造成严重减产的事件时有发生。因此,种子质量(主要是真实性和纯度)控制显得尤为重要。如何能更快更有效地鉴定和检验杂交水稻种子纯度和品种真实性,已成为种子生产和销售中亟待解决的问题之一。
SSR(Simple Sequence Repeats)标记是指以 2 ~ 6个碱基为重复单位组成的长达几十个核苷酸的串联重复序列,广泛分布于水稻基因组中。由于SSR分子标记具有分布广泛、共显性遗传、结果稳定性高等优点,在指纹图谱构建、遗传多样性分析等方面有着广泛的应用[1],在生产指导中常用于杂交水稻品种真实性和纯度鉴定。
在杂交水稻纯度鉴定和真实性鉴定过程中,大多数工作人员常选取幼小植株或幼嫩叶片为材料进行植物基因组提取,这种方法不仅费时(种子发芽一般需要4~6天),且步骤繁琐,很难适应如今种子贸易的快节奏。为了缩短检测时间,提高工作效率,最好选择干种子进行基因组DNA的提取。匡猛等[2]以棉种为材料,探索出一种适合棉花品种SSR分析的DNA快速提取方法;McDonald等[3]从玉米、棉花、小麦及三叶草的干种子中提取DNA,并成功扩增出特异性片段;Yoshihash等用磨碎的谷粒提取了水稻基因组DNA,并对该水稻品种进行了遗传分析[4]。
SSR技术对反应条件要求较为严格,研究体系的稳定性和可重复性成为SSR分子标记技术应用的主要因素。不同作物间的SSR标记扩增会出现较大差异,因此有必要对水稻SSR反应体系进行优化试验。本研究对影响SSR扩增结果的模板DNA含量、Mg2+浓度、引物浓度、dNTPs浓度和酶的浓度及水稻单粒种子DNA提取方法等因素进行了探讨,旨在建立一套成熟稳定的SSR分子标记技术反应体系,使SSR标记技术更好地为杂交水稻纯度检验、种质资源鉴定及分子标记育种等工作服务。
1 材料和方法
1.1 材料
以杂交水稻品种两优287干种子、扬两优6号干种子为材料。
1.2 DNA提取的方法
1.2.1 SDS法:取一粒水稻干种子,剥去颖壳,放入预冷的研钵内,磨碎后将粉末放入1.5 mL离心管中;加入800 μL预热的 SDS提取 buffer(50 mmol/L Tris-HCl,pH=8.0;2.5 mmol/L EDTA,pH=8.0;300 mmol/L NaCl;1%SDS),65 ℃水中温浴 1h;4 ℃、10000 r/min离心15 min,吸上清,加等体积的平衡酚和氯仿/异戊醇 (24∶1)上下颠倒混匀;4℃、10000 r/min离心15 min,将上清夜吸出至另一个1.5 mL的离心管中,加入等体积异丙醇混匀,于-20℃冰箱冷冻3~4 h;4℃、10000 r/min离心15 min后弃上清,用预冷70%乙醇洗涤沉淀2遍,37℃干燥;加50 μL超纯水溶解,-20℃储存。
1.2.2 CTAB法:取一粒水稻干种子,放入预先冷冻好的研钵内,加入 800 μL CTAB裂解液 (2%CTAB;100 mmol/L Tris-HCl,pH 为 8.0;50 mmol/L EDTA,pH为 8.0;3%PVP;1.4 mol/LNaCl), 迅速研磨充分并转入2 mL离心管中,65℃恒温水浴1 h,降至室温后加入等体积的24∶1氯仿/异戊醇,12000 r/min离心15 min;取上清,加入等体积的1%CTAB沉淀缓冲液;轻轻摇晃至形成絮状沉淀,5000 r/min离心8 min沉淀DNA;加入2 mL的 1 mol/LNaCl及 1 μg/mL的 RNAase37℃水浴中过夜。24∶1氯仿/异戊醇再抽提一次,加入异丙醇沉淀DNA,预冷后用70%酒精洗沉淀两次,干燥;加入50 μL超纯水,-20℃储藏备用。
1.3 PCR反应体系的优化
本试验以两系杂交水稻两优287为材料,RM17为引物,对SSR-PCR反应体系进行多因素多水平的20 μL反应体系正交试验设计。试验对DNA模板含量、dNTPs浓度、Mg2+浓度、引物浓度、Taq酶浓度共5个因素分别设计4个浓度梯度水平,共16个处理的正交设计,各反应因素水平见表1。每个反应体系均加入2.0 μL 10xTaq DNA Pol.Buffer,最后加 ddH2O 补齐至20 μL。 PCR 反应程序为:94℃预变性 5 min,94℃变性15 s,55℃退火15 s,72℃延伸30 s, 共扩增35个循环;72℃延伸5 min,4℃保存。扩增产物用4%琼脂糖凝胶进行检测,经EB染色后,经凝胶成像系统进行拍照,保存。
表1 正交实验设计各反应物浓度
2 结果与分析
2.1 不同提取方法对扩增结果的影响
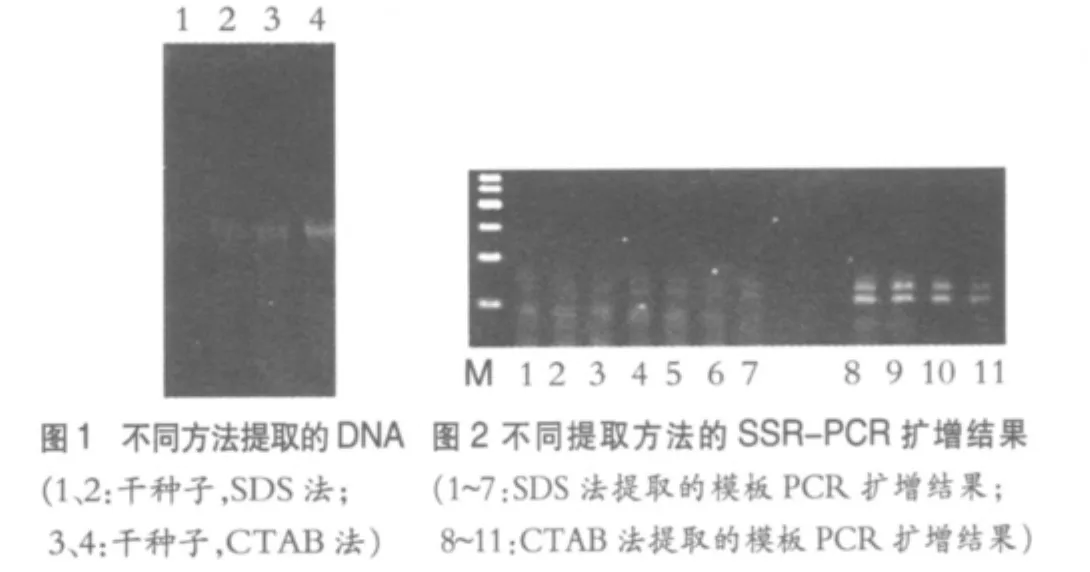
如图1所示,用CTAB法和SDS法提取水稻干种子DNA都是可行的。用CTAB法提取的DNA条带较亮,DNA也较为完整,能获得较好的扩增效果;而SDS法提取的DNA条带较弱,DNA也有轻微的降解。
如图2所示,在同样的反应体系和扩增条件下,以CTAB法提取的DNA为模板能扩增出清晰的条带;而以SDS法获得的的模板虽然也能扩增出目的带,但扩增效果稍差,目的条带较弱,可能是未经纯化的模板含有蛋白及其它杂质,影响了扩增效果。
2.2 水稻SSR-PCR反应最优体系的确定
正交试验设计的16个反应体系的扩增结果如图3所示,除第15个反应体系没有扩增出条带,其余15个均有扩增条带,可见试验所设计的各试验因素浓度梯度没有偏离最适范围。其中,1~4反应体系在模板浓度较低的情况下,依次分别增加dNTPs浓度、引物浓度、Taq酶浓度及Mg2+浓度,其扩增条带逐渐变亮,扩增产物逐渐增多,说明在DNA模板浓度一定的情况下,适当增加其余各反应成分浓度可以提高扩增产物量;4~16组合虽然模板浓度加大,但大多组合扩增产物亮度与3、4相当,说明在合理的范围内,模板浓度对扩增结果影响不大,微量的DNA便可扩增出产物;8组合的扩增产物较少,15组合几乎没有扩增产物,在8、15反应组合dNTPs浓度、引物浓度和Taq酶浓度都处于中等水平的情况下,Mg2+浓度均为本实验设计的最低水平,所以推测它们扩增产物量少可能跟Mg2+浓度较低有关;9、10、16组合扩增产物亮度较其余组合扩增条带明显变亮,扩增产物较多。从经济实用的角度考虑,确定9反应为最佳反应组合,即20 μL反应体系中含模板DNA 45ng,dNTPs浓度为 0.15 mmol/L,引物浓度为 0.4 μmol/L,Mg2+浓度为 1.5 mmol/L,Taq 酶为 1.6 U。

2.3 最优反应体系的检测
为了检测上述试验筛选出来的最优反应体系的扩增效果,本研究对杂交水稻扬两优6号种子进行纯度检测,所用引物为RM1。检测结果如图4所示,28粒种子都扩增得到了清晰且特异性较高的条带,表明本研究所筛选出来的反应体系具有较好的重复性和稳定性。

3 讨论
SSR分子标记具有数量丰富、多态性高、共显现性遗传、结果稳定可靠等优点,因此在遗传多样性分析[5]、基因的定位与分离[6]、品种纯度鉴定[7]等方面得到了日益广泛的应用。
虽然SSR分子标记技术对模板DNA质量和浓度要求不高,但是高质量的DNA是实验结果可靠并有稳定重复性的有力保证。用水稻单粒干种子进行DNA提取时,SDS法步骤少,用时少,但提取的DNA纯度较低,扩增效果也稍差;而CTAB法提取水稻干种子DNA时,虽然步骤和用时稍多,但提取的DNA质量高,扩增效果好。在进行SSR-PCR反应中,模板DNA如果含有多糖、酚类、蛋白质等杂质,会影响DNA聚合酶活性,干扰引物与模板的结合。所以,为了保证扩增的稳定性和高效性,在进行水稻干种子DNA抽提时,建议选用CTAB法。
SSR-PCR反应涉及的反应因子多,对反应条件十分敏感。任何一个反应因子设置不当,都会影响扩增结果。模板浓度是PCR反应的制约因子之一,如果其浓度过低,与引物碰撞机会较少,结合概率降低,则扩增产物量较少或扩增结果不稳定;如果其浓度过高,则会增加非特异性扩增[8]。本研究用15~45 ng的4个DNA浓度梯度进行扩增,除15反应,其余反应都扩增出条带,说明模板浓度在相当范围内都能扩增出结果。Mg2+是Taq酶的激活剂,适量浓度的Mg2+可以促进Taq酶充分发挥聚合作用。但是,如果Mg2+浓度过高,会增加非特异性产物扩增;浓度过低,会使反应扩增结果产物减少或者没有扩增产物[9]。本试验中共设计了4个Mg2+浓度梯度,当Mg2+浓度为1.0mmol/L时,反应1、反应8扩增条带很弱,反应15基本没有扩增产物出现,可能是Mg2+浓度较低,影响了酶活性的缘故。dNTPs是DNA合成的原料,浓度低时影响扩增结果;浓度过高,会与Taq酶竞争性结合Mg2+,使酶反应活性降低,从而降低扩增效率[9]。Taq酶也是反应的关键因素之一,酶的质量、浓度也直接影响扩增结果。总之,PCR扩增效果是体系中各个因素综合作用的结果,每个反应因子浓度的高低及各反应因子间的相互作用都直接影响反应结果。
正交试验设计是研究多因素、多水平相互作用的一种较新的实验设计方法,具备“均匀分散、齐整可比”的特点[10],而PCR反应体系所含组分多,且各组分均可能对扩增敏感性、特异性等产生影响。因此,在本研究中采用正交试验设计,借助正交表来筛选最佳反应组合,大大减少了试验次数,又快又好地筛选最优组合。筛选出的最经济、最稳定的体系为:20 μL反应体系中含模板DNA 45ng,dNTPs浓度为 0.15 mmol/L,引物浓度为 0.4 μmol/L,Mg2+浓度为 1.5 mmol/L,Taq 酶为1.6 U。
本研究以1个SSR标记对16个不同反应体系进行了筛选,并对筛选出的最优体系进行了扩增检验。结果表明,试验筛选出最优反应体系具有稳定、高效和可重复性的特点,可应用于水稻基因的定位、种质鉴定及杂交水稻纯度鉴定等方面。
[1]彭锁堂,庄云杰,颜启传,等.我国主要杂交水稻组合及其亲本 SSR 标记和纯度鉴定[J].中国水稻科学,2003,17(1):1 ~ 5.
[2]匡猛,杨伟华,许红霞,等.单粒棉花种子快速提取方法[J].分子植物育种,2010,8(4):827 ~ 831.
[3]McDonald MB,Elliot LJ,Sweeney PM.DNA extraction from dry seeds for PAPD analysis in varietal indentifiction studies[J].Seed Science and Technology,1994,(22):171 ~ 176.
[4]Yoshihashi T,Nakamura S,et al.Identification of domestic rice cultivars by RAPD analysis using one grain of milled rice as a sample[J].Nippon-Shokuhin-Kagaku-Kogaku-Kaishi,1999,46(4):250 ~ 254.
[5]王金花,罗文勇,陈建伟,等.应用SSR和ISSR标记分析栽培香稻品种的遗传多样性[J].分子植物育种,2005,3(1):37~42.
[6]陈大洲,钟平安,肖叶青,等.利用SSR标记定位东乡野生稻苗期耐冷性基因[J].江西农业大学学报(自然科学版),2002,24(6):753 ~ 756.
[7]苏顺宗,黄玉碧,杨俊品,等.利用SSR鉴定水稻杂交种子纯度的研究[J].种子,2003,(1):23 ~ 35.
[8]刘欣,郑文静,张少斌.水稻SSR-PCR反应技术体系的优化[J].湖北农业科学,2009,48(7):18 ~ 21.
[9]刘勋甲.玉米RAPD研究影响因素的探讨[J].华中农业大学学报,1996,15(5):405 ~ 408.
[10]姜同川.正交设计实验[M].济南:山东科技出版社,1985:1~65.
1005-2690(2011)06-0020-04
S 511.037
A
2011-05-09
