细小病毒H-1非结构蛋白NS1基因对人胃癌细胞的抑制作用研究*
2011-09-07王园园李金辉萧树东郑
王园园 刘 炯 李金辉 萧树东郑 青# 汪 铮#
上海交通大学医学院附属仁济医院消化内科 上海市消化疾病研究所1(200001)南京军区南京总医院消化内科2
细小病毒H-1是自主性细小病毒的主要代表之一,对肿瘤细胞和恶性转化细胞有选择性杀伤作用,而对正常细胞无影响[1],有望成为新型的抗肿瘤制剂。多项实验已证实非结构蛋白NS1是细小病毒H-1发挥细胞毒作用的效应蛋白[1~3]。本课题前期研究[4]结果显示,低分化胃癌细胞对细小病毒H-1的细胞毒作用较为敏感,可能与细胞中NS1蛋白的产生和集聚能力增高有关。本研究利用成功构建的细小病毒H-1非结构蛋白NS1基因重组真核质粒为载体,旨在深入研究NS1基因对高分化胃癌细胞株MKN28、中分化胃癌细胞株SGC7901和低分化胃癌细胞株MKN45的影响,从而为进一步探讨NS1基因的抗肿瘤效应以及研究相关机制奠定基础。
材料与方法
一、质粒、细胞株和主要试剂
细小病毒H-1储存液由海德堡大学德国癌症研究中心(DKFZ)Rommelaere教授惠赠,细小病毒H-1非结构蛋白NS1基因真核表达质粒 pcDNA3.1-NS1由刘炯博士成功构建;真核表达质粒pcDNA3.1由金思特科技(南京)有限公司提供。不同分化程度的人胃癌细胞株 MKN28、SGC7901、MKN45由上海市消化疾病研究所冻存。质粒小提试剂盒购自天根生化科技(北京)有限公司,限制性内切酶、逆转录试剂盒、PCR试剂盒购自宝生物工程 (大连)有限公司,Unizol试剂(上海博星基因芯片有限责任公司),G418(Gibco,InvitrogenTMby Life Technologies),脂质体转染试剂LipofectamineTM2000(InvitrogenTMby Life Technologies),小鼠抗人 CD44单克隆抗体(BD 公司)。
二、方法
1.质粒抽提:分别将pcDNA3.1空质粒菌液和pcDNA3.1-NS1质粒菌液涂于氨苄西林(Amp)抗性的LB培养板,倒置于37℃培养箱内过夜培养。挑选一单克隆菌落加入5 ml LB培养基,37℃摇床220 r/min振荡培养过夜。按试剂盒说明书抽提菌液中的质粒。
2.质粒的双酶切鉴定:对抽提得到的pcDNA3.1空质粒和重组质粒pcDNA3.1-NS1进行双酶切鉴定, 反应体系内含 KpnⅠ1 μl、XhoⅠ1 μl、10×M 缓冲液 2 μl、质粒 DNA 5 μl,加 ddH2O 补足至 20 μl,37℃酶切2 h。行1%琼脂糖凝胶电泳。
3.重组质粒的测序鉴定:取5 μl经双酶切鉴定的重组质粒pcDNA3.1-NS1,送上海英骏生物技术有限公司,以NCBI/BLAST分析测序结果。
4.G418最佳筛选浓度确定:将MKN28、SGC7901、MKN45细胞按 105/孔分别接种于24孔板,并设置对照组(未转染质粒)、空质粒转染组和重组质粒pcDNA3.1-NS1转染组,分别于100、200、300、400、500、600、700 μg/ml G418 浓度下进行筛选,选择在10~14 d内使对照组细胞全部死亡的最低G418浓度行下一步筛选试验。
5.质粒稳定转染胃癌细胞:参照LipofectamineTM2000试剂说明书,将质粒分别转染胃癌MKN28、SGC7901、MKN45细胞,48 h后加入G418,于筛选浓度下(300 μg/ml)继续培养4周,挑出单克隆细胞株扩大培养。
6.RT-PCR法检测转染细胞中NS1基因表达:Unizol试剂抽提 MKN28、SGC7901、MKN45 转染细胞总RNA,按逆转录试剂盒说明书逆转录合成cDNA。PCR引物由上海生工生物工程技术服务有限公司合成,NS1上游引物:5’-TCC ACA GCC TGC CAA GGT-3’, 下游:5’-CTC AAA TCC GCC TCG ATC TC-3’,片段长度87 bp。PCR反应体系内含模板 cDNA 2 μl、NS1 上下游引物混合液(10 μmol/L)2 μl、Premix Ex Taq 12.5 μl,以 ddH2O 补足至 25 μl。反应条件:94 ℃ 5 min;94 ℃ 30 s,60 ℃ 30 s,72 ℃1 min,30个循环;72℃ 10 min。行1.5%琼脂糖凝胶电泳鉴定NS1表达。
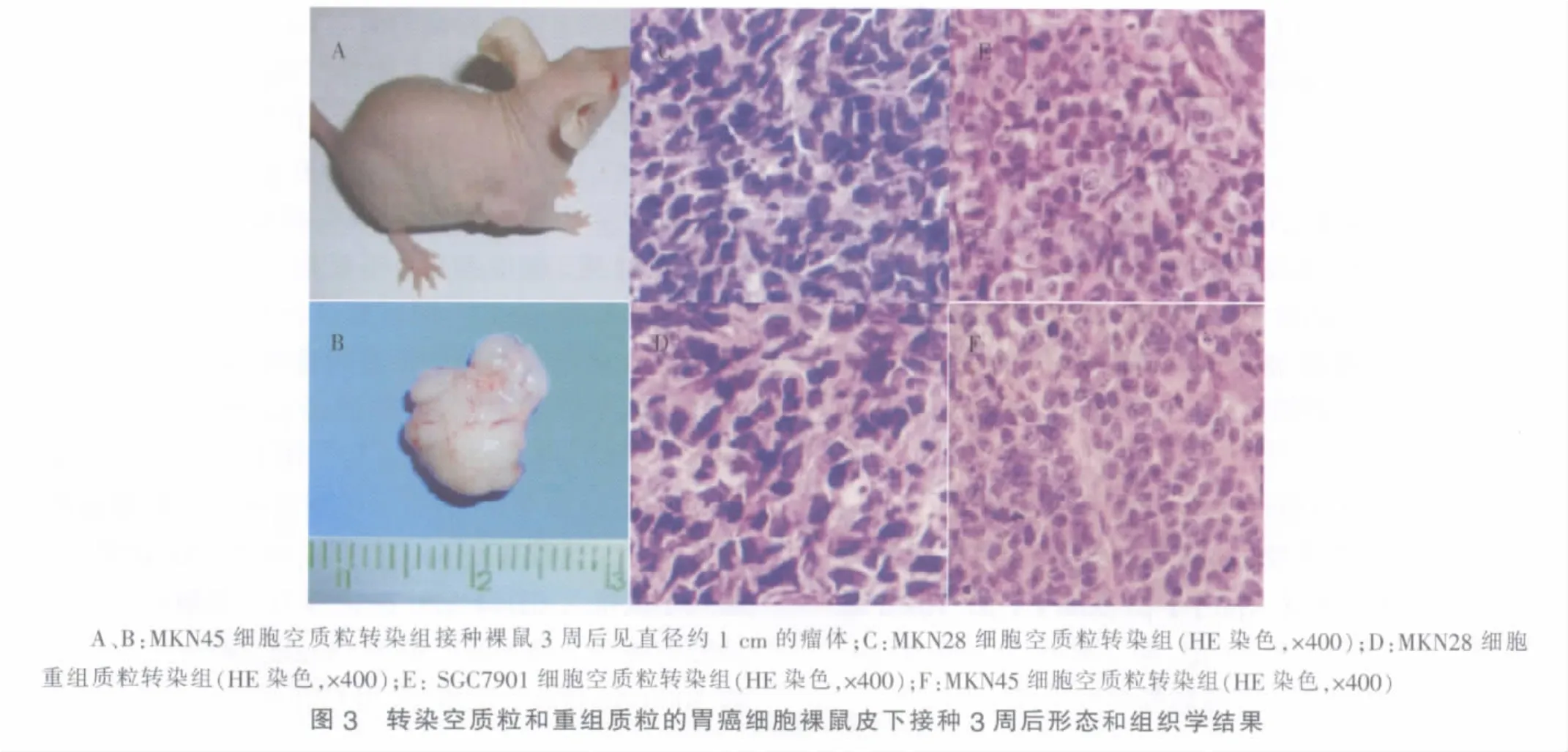
7.裸鼠体内成瘤实验:4周龄雌性BALB/c裸鼠(中国科学院上海实验动物中心)30只,分为6组,每组5只,22℃无菌条件下饲养。MKN28、SGC7901、MKN45细胞分别转染pcDNA3.1空质粒和重组质粒pcDNA3.1-NS1后,以106/300 μl细胞悬液浓度皮下接种至裸鼠右侧背部,观察成瘤情况。3周后,将裸鼠处死,取出瘤体,测量瘤体长径(a)、短径(b),瘤体体积=ab2/2。同时瘤体行病理切片分析。
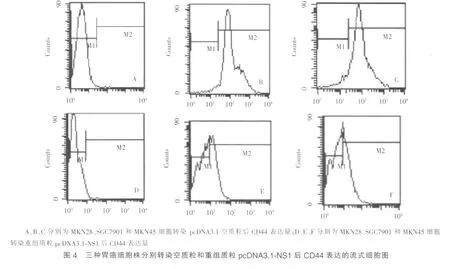
8.胃癌细胞CD44表达的检测:胃癌MKN28、SGC7901、MKN45细胞分别转染pcDNA3.1空质粒和重组质粒pcDNA3.1-NS1后,用无酶细胞分离液消化,PBS洗涤2次,制成单细胞悬液。每种细胞均设置阴性对照管和CD44标记管,每管200 μl悬液,加入小鼠抗人CD44-APC振荡混匀,细胞与荧光素共轭抗体在室温下避光孵化15 min。流式细胞仪计数5000~10 000个细胞,采用Cell-Quest软件分析。
三、统计学分析
结 果
一、双酶切鉴定结果
pcDNA3.1空质粒仅扩增出一条5000 bp以上的条带,而重组质粒pcDNA3.1-NS1经KpnⅠ和XhoⅠ双酶切后可见2条条带,其中一条在5000 bp以上,与pcDNA3.1空质粒大小一致,另一条大小约2000 bp,与 NS1 片段长度(2019 bp)吻合(见图 1)。


二、重组质粒的测序鉴定
重组质粒pcDNA3.1-NS1的测序结果经NCBI/BLAST分析,其mRNA序列与已知序列完全吻合。
三、NS1基因表达
胃癌 MKN28、SGC7901、MKN45细胞转染重组质粒pcDNA3.1-NS1后,均扩增出大小为87 bp的NS1条带,而转染空质粒的细胞均未扩增出任何条带(见图 2)。
四、裸鼠体内成瘤实验
转染空质粒和重组质粒pcDNA3.1-NS1的MKN28细胞皮下接种2周时,分别有5只和4只裸鼠长出瘤体,平均体积分别为(461.04±18.09)mm3和(457.40±20.11) mm3,组间差异无统计学意义(P>0.05)。接种10 d左右,SGC7901和MKN45细胞空质粒转染组裸鼠即可观察到瘤体;而接种转染重组质粒pcDNA3.1-NS1的SGC7901和MKN45细胞后,直至处死所有裸鼠均未观察到肿瘤生长。
接种后3周,各胃癌细胞HE染色示细胞核增大,核深染、核分裂象增多,为肿瘤细胞特征(见图 3)。
五、CD44表达
转染pcDNA3.1空质粒后,MKN28细胞不表达CD44,SGC7901和MKN45细胞中CD44表达量分别为97.6%和92.6%;转染重组质粒pcDNA3.1-NS1后,MKN28细胞亦不表达 CD44,SGC7901和MKN45细胞中CD44表达量明显降低,分别为44.0%和41.2%(见图 4)。
讨 论
我国胃癌发病率在各种消化道恶性肿瘤中位居前列,严重危害人们的健康。在传统放化疗对胃癌疗效不佳的情况下,积极探索低毒的有效靶向根除肿瘤的抗原是肿瘤基础研究的方向。细小病毒H-1对肿瘤细胞和转化细胞具有选择性杀伤和抑制生长的作用,具有亲瘤性和溶瘤性[5,6]。Ran等[4]和Liu等[7]前期观察发现不同胃癌细胞对细小病毒H-1细胞毒作用的敏感性存在差异,并对其可能机制进行了初步探讨。Cornelis等[8]的研究表明,细小病毒的肿瘤抑制作用不仅可通过其在肿瘤细胞中的大量复制而实现,还可通过产生毒性NS1蛋白来发挥效应。NS1是一种多功能蛋白,具有解旋酶、核酸内切酶、ATP酶、DNA-nicking和序列特异性DNA结合活性,既可控制病毒DNA的复制和表达,还具有细胞毒性作用,与病毒抗肿瘤活性直接相关[9]。NS1的毒性效应与细胞蛋白的磷酸化有关[10~12],新近研究表明NS1蛋白通过连接细胞内酪蛋白激酶(CK)Ⅱα与原肌球蛋白而调节激酶的底物特异性,从而参与介导CKⅡ依赖的细胞骨架的改变和细胞死亡[11,12]。
本研究选取3种不同分化程度的胃癌细胞株,转染重组质粒pcDNA3.1-NS1和空质粒后皮下注射裸鼠,结果显示高分化胃癌MKN28细胞组裸鼠均可见肿瘤生长,且两组肿瘤大小无明显差异;中分化胃癌SGC7901和低分化胃癌MKN45细胞空质粒转染组裸鼠亦可观察到肿瘤生长,而转染重组质粒pcDNA3.1-NS1后均未见肿瘤生长,证实NS1基因对中低分化的胃癌细胞生长具有抑制作用。与Ran等[4]的低分化胃癌细胞株对细小病毒H-1细胞毒作用较为敏感的研究结果相一致。此外,转染重组质粒的SGC7901和MKN45细胞表面覆盖了一层溶胞样的膜状物,而MKN28细胞未见此现象。
肿瘤干细胞的研究近年成为肿瘤研究的热点之一,可通过识别出这一小部分细胞从而进行靶向治疗以彻底杀灭残存的肿瘤细胞,阻止其转移和复发。目前已报道了数种肿瘤干细胞的表面标记物,但关于胃癌干细胞表面标记物的文献报道极少。Takaishi等[13]的研究发现胃癌细胞株MKN45、MKN74和NCI-N87中,细胞表面标记CD44+的胃癌细胞具有自我更新、自分化等干细胞特性,体外无血清培养条件下可形成肿瘤球、在动物体内具有致瘤性,且对化疗和放疗的耐受性更强,敲除CD44则导致肿瘤球形成能力和致瘤性明显减弱。提示CD44+细胞具有胃癌干细胞特性,CD44与胃癌干细胞具有较强的相关性,可能是胃癌干细胞的表面标记之一。本实验发现,SGC7901和MKN45细胞转染重组质粒pcDNA3.1-NS1后CD44含量明显降低,而MKN28细胞转染空质粒和重组质粒pcDNA3.1-NS1后均无CD44表达。提示NS1对胃癌干细胞潜在标记物CD44具有抑制作用,NS1对分化程度不同的胃癌细胞株的敏感性差异可能与其对CD44的抑制作用有关,但具体机制还有待于深入研究。
综上所述,稳定转染细小病毒H-1非结构蛋白NS1基因后,胃癌细胞SGC7901和MKN45的致瘤能力受到抑制,并对胃癌干细胞潜在标记物CD44有明显抑制作用,说明细小病毒H-1非结构蛋白NS1基因表达对中低分化的胃癌细胞有较好的抗肿瘤活性,可能与其降低胃癌干细胞表型CD44的表达有关,有望成为胃癌治疗的新型生物制剂。但目前关于非结构蛋白NS1抑瘤效应的分子调控机制尚未完全阐明,胃癌干细胞特异性表面标记物亦需进一步明确,这将是今后研究的方向。
1 Cornelis JJ,Deleu L,Koch U,etal.Parvovirus oncosuppression.In:Kerr JR,Cotmore SF,Bloom ME,et al,eds.The parvoviruses.London:Hodder Arnold,2006.365-384.
2 Daeffler L,Hörlein R,Rommelaere J,et al.Modulation of minute virus of mice cytotoxic activities through sitedirected mutagenesis within the NS coding region.J Virol,2003,77(23):12466-12478.
3 Caillet-Fauquet P,Perros M,Brandenburger A,et al.Programmed killing of human cells by means of an inducible clone ofparvoviralgenesencoding nonstructural proteins.EMBO J,1990,9(9):2989-2995.
4 Ran ZH,Liu J,Feng Y,et al.Investigation of the sensitivities of distinct gastric cancer cells to parvovirus H-1 induced cytotoxicity.Chin J Dig Dis,2004,5(3):93-97.
5 Cornelis JJ,Spruyt N,Spegelaere P,et al.Sensitization of transformed rat fibroblasts to killing by parvovirus minute virus of mice correlates with an increase in viral gene expression.J Virol,1988,62(9):3438-3444.
6 Cornelis JJ, Becquart P, Duponchel N, et al.Transformation of human fibroblasts by ionizing radiation,a chemical carcinogen,or simian virus 40 correlates with an increase in susceptibility to the autonomous parvoviruses H-1 virus and minute virus of mice.J Virol,1988,62(5):1679-1686.
7 Liu J,Ran ZH,Xiao SD,et al.Changes in gene expression profiles induced by parvovirus H-1 in human gastric cancer cells.Chin J Dig Dis,2005,6(2):72-81.
8 Cornelis JJ,Salomé N,Dinsart C,et al.Vectors based on autonomous parvoviruses:novel tools to treat cancer?J Gene Med,2004,6 Suppl 1:S193-S202.
9 Rommelaere J,Cornelis JJ.Autonomous Parvoviruses.In:Hernáiz DrieverP,Rabkin SD,eds.Replication-Competent Viruses for Cancer Therapy.Monographs in Virology(Vol.22).Basel:Karger,2001.100-129.
10 Anouja F,Wattiez R,Mousset S,et al.The cytotoxicity of the parvovirus minute virus of mice nonstructural protein NS1 is related to changes in the synthesis and phosphorylation of cell proteins.J Virol,1997,71(6):4671-4678.
11 Nüesch JP,Rommelaere J.A viral adaptor protein modulating casein kinaseⅡactivity induces cytopathic effects in permissive cells.Proc Natl Acad Sci U S A,2007,104(30):12482-12487.
12 Nüesch JP,Rommelaere J.NS1 interaction with CKⅡalpha:novelprotein complex mediating parvovirusinduced cytotoxicity.J Virol,2006,80(10):4729-4739.
13 Takaishi S,Okumura T,Tu S,et al.Identification of gastric cancer stem cells using the cell surface marker CD44.Stem Cells,2009,27(5):1006-1020.
