Lgr5在Barrett食管和早期食管鳞癌中的表达
2011-09-07丁黎葭陈世耀马丽黎练晶晶
丁黎葭* 陈世耀# 纪 元 马丽黎 练晶晶
复旦大学附属中山医院消化科1(200032) 病理科2 内镜中心3 内科4
肿瘤干细胞(cancer stem cells)学说认为肿瘤干细胞是原发性肿瘤组织中一类具有自我更新、无限增殖和多向分化潜能的细胞亚群,是肿瘤生长、转移、复发的根源。Wnt信号通路参与组成干细胞信号网络,与肿瘤的发生、发展有关[1]。作为Wnt信号通路的靶基因,G蛋白偶联受体Lgr5(leucinerich-repeat-containing G-protein-coupled receptor 5)主要表达于肌肉、胎盘、脊髓、脑组织中[2]。近年研究发现Lgr5为肿瘤干细胞标记物之一[3],与相应正常组织相比,人原发性结肠癌、卵巢癌、肝细胞癌中存在Lgr5过表达[4,5],提示Lgr5与肿瘤的发生有一定关联。Becker等[6]的研究显示,Barrett食管中存在Lgr5表达,在Barrett食管相关高度异型增生和食管腺癌中,其表达较Barrett食管显著增强,并与食管腺癌预后不良独立相关,提示Lgr5有作为Barrett食管相关异型增生和食管腺癌生物学标记的潜能。本研究旨在探讨Lgr5在Barrett食管和早期食管鳞癌中的表达及其临床意义。
材料与方法
一、标本来源
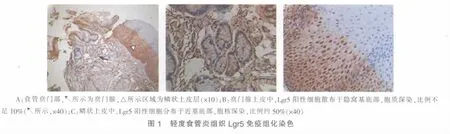
Barrett食管和早期食管鳞癌组织标本均源自2007年1月~2009年12月于复旦大学附属中山医院内镜中心接受内镜检查或治疗的病例,诊断经活检病理或内镜手术病理检查证实。癌旁组织取自距癌灶边缘3 cm以内处,经病理检查证实为非癌组织(多为异型增生组织)。Barrett食管20例,其中男14例,女6例,年龄39~81岁,中位年龄58岁。早期食管鳞癌20例,其中男12例,女8例,年龄48~76岁,中位年龄60岁;原位癌7例,黏膜内癌10例,黏膜下癌3例。选取同期轻度食管炎组织标本20例作为对照,其中男10例,女10例,年龄45~84岁,中位年龄56岁。
二、诊断标准
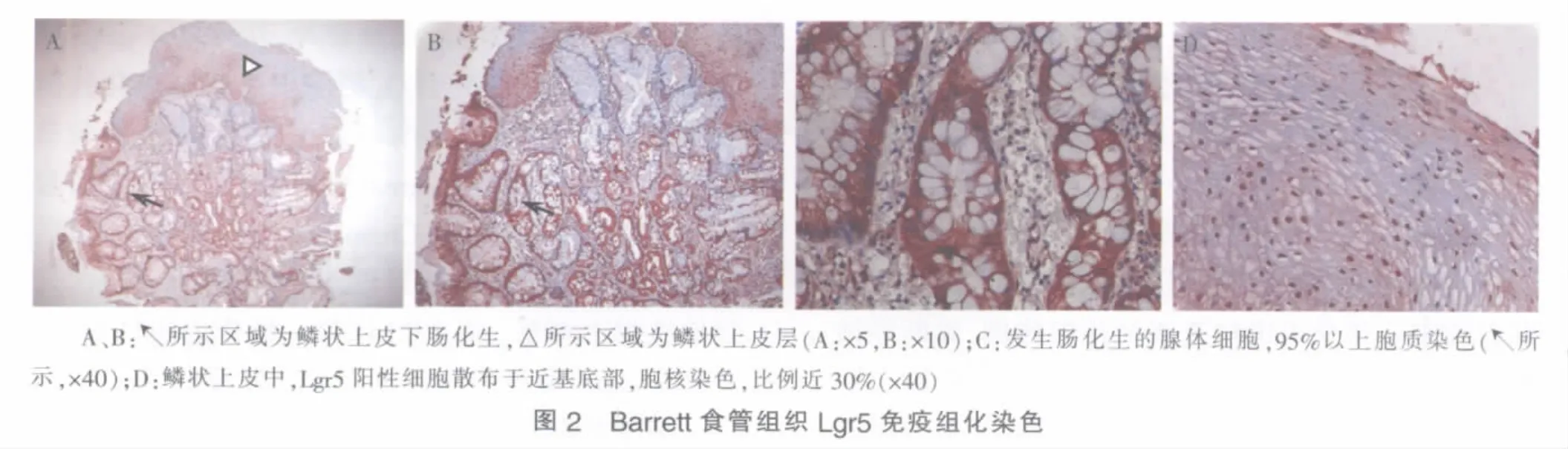
1.Barrett食管[7]:内镜检查示鳞、柱状上皮交界与胃食管连接部分离,即胃食管连接部近端出现橘红色胃柱状上皮,以四象限法取活检,病理检查证实存在含杯状细胞的肠化生。
2.早期食管癌[8]:内镜检查示食管黏膜粗糙、糜烂或颗粒状隆起,碘液染色不着色,内镜手术病理检查证实为原位癌(肿瘤局限于鳞状上皮层内,未突破基底膜)、黏膜内癌(肿瘤侵及黏膜固有层或黏膜肌层)或黏膜下癌(肿瘤侵及黏膜下层的上1/3)。
3.轻度食管炎[9]:内镜检查示食管黏膜呈点状或条状发红、糜烂,但无融合现象(内镜分级Ⅰ级);活检病理检查可见鳞状上皮增生、黏膜固有层乳头延伸和上皮细胞层内炎性细胞浸润,无黏膜糜烂、溃疡形成,无Barrett食管改变。
三、Lgr5免疫组化染色
采用免疫组化EnVision二步法(ChemMateTMEnVisionTMDetection Kit,Dako公司)。甲醛固定石蜡包埋组织每隔2 mm连续切片,切片厚4 μm。切片常规脱蜡水化,3%H2O2消除内源性过氧化物酶活性,微波抗原修复,滴加工作浓度为1:50的兔抗人 Lgr5多克隆抗体(Sigma-Aldrich Co.),37 ℃孵育1 h,滴加HRP标记的ChemMateTMEnVision二抗,37℃孵育30 min,DAB显色,苏木精复染,封片,光学显微镜下观察。以PBS代替一抗作为阴性对照,以已知Lgr5染色阳性切片作为阳性对照。
结果判断[6]:细胞核或细胞质内见均匀一致的棕色颗粒定义为Lgr5染色阳性。于40倍镜下随机选取5个视野,根据阳性细胞比例和染色强度分别行半定量评分,结果取均值。阳性细胞比例0~10%、11%~30%、31%~60%、61%~100%分别计 0~3分;染色强度按无、弱(浅棕色)、中(棕色)、强(深棕色)分别记0~3分(相应染色强度的细胞比例必须>10%)。总分为两项计分之和。两项计分均≥1分判断为Lgr5表达阳性。
四、统计学分析
应用SPSS 15.0统计软件,Barrett食管与轻度食管炎组间比较采用成组t检验,早期食管鳞癌与相应癌旁组织组间比较采用配对t检验,原位癌、黏膜内癌与黏膜下癌组间比较采用方差分析,P<0.05为差异有统计学意义。
结 果
Lgr5在腺上皮中表达于腺体细胞的细胞质,在鳞状上皮中表达于鳞状细胞的细胞核。
20例轻度食管炎组织中,16例腺上皮Lgr5表达阳性,阳性细胞分布分散(见图1)。20例Barrett食管组织中,18例腺上皮Lgr5表达阳性,阳性细胞分布密集(见图2)。Barrett食管组织腺上皮Lgr5免疫组化评分高于轻度食管炎组织,差异有统计学意义(3.65±1.95 对 2.55±1.70,P=0.049)。
20例早期食管鳞癌中,18例癌灶组织及其相应癌旁组织鳞状上皮Lgr5表达阳性。癌旁组织Lgr5阳性细胞集中于鳞状上皮层近基底部,癌灶组织则不再局限于基底部(见图3)。癌灶组织Lgr5免疫组化评分高于癌旁组织,差异有统计学意义(5.39±0.61 对 3.06±1.06,P=0.000)。原位癌、黏膜内癌与黏膜下癌间Lgr5免疫组化评分差异无统计学意义(5.00±0.63、5.56±0.53 和 6.00±0.58,P=0.174)。
讨 论
Lgr5为G蛋白偶联受体,由907个氨基酸组成,其特征性结构为七次跨膜结构域以及含17个富含亮氨酸重复序列的外功能区。作为Wnt信号通路的靶基因和肿瘤干细胞标记物,Lgr5与多种恶性肿瘤,包括人结肠癌、卵巢癌、肝细胞癌、食管腺癌的发生有关[4~6]。
经典的Wnt信号通路为 Wnt/β-连环蛋白(βcatenin)信号通路。无Wnt信号时,β-catenin与胞质中的Axin/APC/GSK-3β复合物结合,经磷酸化、泛素化后降解;经Wnt信号刺激,Wnt蛋白与细胞表面的Frizzled/LRP受体复合物结合,拮抗Axin/APC/GSK-3β复合物形成,阻碍β-catenin的降解,胞质内非磷酸化的β-catenin进入胞核,与LEF/TCF转录因子家族成员结合,启动靶基因转录[10]。
Wnt信号通路参与维持成体干细胞的增殖、分化,并在细胞恶性转化中起重要作用[11]。彭辉等[12]对食管鳞癌中Wnt信号通路相关蛋白的研究显示,β-catenin表达异常始于异型增生阶段;随着肿瘤分化程度由高至低的改变,APC阳性率逐渐减低,β-catenin阳性率逐渐增加。Wang等[13]的研究亦发现食管鳞癌中Wnt2/β-catenin信号通路被激活,抑制β-catenin的表达可诱导细胞周期阻滞和细胞凋亡。上述结果表明Wnt信号通路对食管鳞癌的发生、发展具有重要调控作用,同时提示食管鳞癌的发生可能与肿瘤干细胞有关。
Barker等[14]的研究发现作为Wnt信号通路靶基因的Lgr5是小鼠肠干细胞的标记基因。Lgr5在小鼠肠道中仅表达于隐窝基底部的柱状细胞,这些柱状细胞因能向所有肠上皮谱系分化而被认为是肠干细胞。Becker等[15]以免疫组化方法研究了人胃肠道癌前病变中的Lgr5表达情况,发现小肠、结肠腺瘤和Barrett食管中Lgr5阳性细胞数增多,且分布不再如正常组织一样局限于隐窝基底部的干细胞池。其后相关研究[6]显示,Lgr5在Barrett食管相关高度异型增生和食管腺癌中的表达较Barrett食管显著增强,表达率增高。有研究[16]发现肠道中存在不同Lgr5表达强度的细胞群体,但仅Lgr5高表达的细胞同干细胞一样,在体外实验中具有重建肠隐窝的能力。因此,Barrett食管相关高度异型增生组织中增多的Lgr5高表达细胞可能是有成为肿瘤干细胞倾向的干细胞。干细胞的分布不再局限于干细胞池为其发生癌前转化的早期事件。
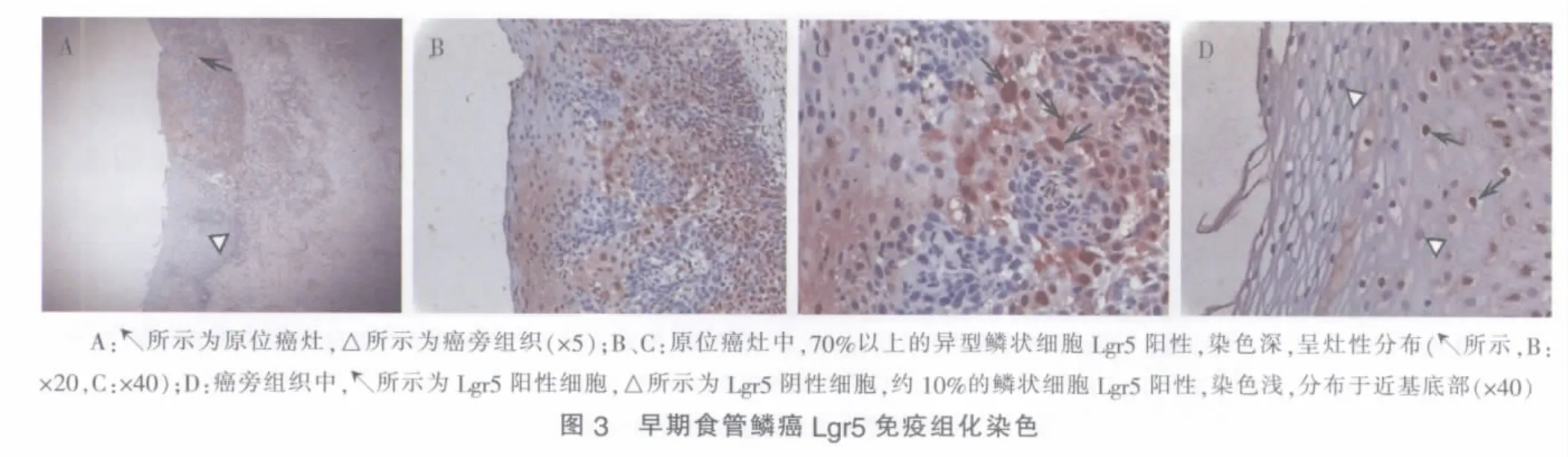
本研究中Barrett食管组织腺上皮Lgr5表达评分显著高于轻度食管炎组织,染色定位于细胞质,结合Becker等[6]报道的Barrett食管相关高度异型增生和食管腺癌的Lgr5表达强度显著高于Barrett食管,支持Lgr5可作为食管腺癌及其癌前病变的生物学标记。Becker等[6]的研究显示正常食管鳞状上皮中无Lgr5表达,而本研究发现轻度食管炎、Barrett食管和早期食管鳞癌组织的鳞状上皮中均有Lgr5表达,染色定位于细胞核,这一差异可能与两项研究预处理等步骤中使用的相关试剂对抗原表位的保护程度不同有关。早期食管鳞癌原位癌灶组织中Lgr5阳性细胞比例明显高于相应癌旁组织且染色较深,Lgr5表达评分亦显著高于癌旁组织,提示Lgr5可能作为肿瘤标记物辅助诊断早期食管鳞癌。原位癌、黏膜内癌与黏膜下癌间Lgr5表达评分差异无统计学意义,可能与纳入样本例数过少有关。
根据肿瘤干细胞学说,肿瘤的侵袭、转移与肿瘤干细胞的存在密不可分,肿瘤转移的不可预知性及其机制的复杂性,根本原因在于只有肿瘤干细胞才具有在相邻区域或远隔部位形成转移灶的能力。由于本研究纳入的食管鳞癌样本数量有限且均为早期病例,关于Lgr5的表达与食管鳞癌浸润深度、淋巴结转移、远处转移和预后的关系,以及Lgr5与Wnt信号通路中的β-catenin等相关蛋白对肿瘤干细胞的调控机制及其在食管鳞癌发生、发展中的意义,均有待后续研究进一步评价。
1 Katoh M.Networking of WNT,FGF,Notch,BMP,and Hedgehog signaling pathways during carcinogenesis.Stem Cell Rev,2007,3(1):30-38.
2 Hsu SY,Liang SG,Hsueh AJ.Characterization of two LGR genes homologous to gonadotropin and thyrotropin receptors with extracellular leucine-rich repeats and a G protein-coupled, seven-transmembrane region. Mol Endocrinol,1998,12(12):1830-1845.
3 Vermeulen L,Todaro M,de Sousa Mello F,et al.Singlecell cloning of colon cancer stem cells reveals a multilineage differentiation capacity.Proc Natl Acad Sci U S A,2008,105(36):13427-13432.
4 McClanahan T,Koseoglu S,Smith K,et al.Identification of overexpression of orphan G protein-coupled receptor GPR49 in human colon and ovarian primary tumors.Cancer Biol Ther,2006,5(4):419-426.
5 Yamamoto Y,Sakamoto M,Fujii G,et al.Overexpression of orphan G-protein-coupled receptor,Gpr49,in human hepatocellular carcinomas with beta-catenin mutations.Hepatology,2003,37(3):528-533.
6 Becker L,Huang Q,Mashimo H.Lgr5,an intestinal stem cellmarker,is abnormally expressed in Barrett’s esophagus and esophageal adenocarcinoma. Dis Esophagus,2010,23(2):168-174.
7 房殿春,许国铭,赵晶京;中华医学会消化病学分会.Barrett食管诊治共识 (草案,2005,重庆).中华消化杂志,2006,26(2):138-139.
8 Eguchi T, Nakanishi Y, Shimoda T, et al.Histopathological criteria for additional treatment after endoscopic mucosal resection for esophageal cancer:analysis of 464 surgically resected cases.Mod Pathol,2006,19(3):475-480.
9 陆星华,张泰昌;中华医学会消化内镜学分会.反流性食管炎诊断及治疗指南 (2003年).中华消化内镜杂志,2004,21(4):221-222.
10 Waterman ML.Lymphoid enhancer factor/T cell factor expression in colorectal cancer.Cancer Metastasis Rev,2004,23(1-2):41-52.
11 Romano G.The role of adult stem cells in carcinogenesis.Drug News Perspect,2005,18(9):555-559.
12 彭辉,钟雪云,刘坤平,等.应用组织芯片检测食管鳞状细胞癌中 APC、β-catenin、E-cadherin 与 cyclin D1 的表达及其意义.癌症,2009,28(1):49-53.
13 Wang W,Xue L,Liu H,et al.Aberrant changes of Wnt2/beta-catenin signaling pathway induced by sodium nitroprusside in human esophageal squamous cell carcinoma cell lines.Cancer Invest,2010,28(3):230-241.
14 Barker N,van Es JH,Kuipers J,et al.Identification of stem cells in small intestine and colon by marker gene Lgr5.Nature,2007,449(7165):1003-1007.
15 Becker L,Huang Q,Mashimo H.Immunostaining of Lgr5,an intestinal stem cell marker,in normal and premalignant human gastrointestinal tissue.Scientific World Journal,2008,8:1168-1176.
16 Sato T,Vries RG,Snippert HJ,et al.Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche.Nature,2009,459(7244):262-265.
