改良DCF方案治疗晚期胃癌的疗效及毒副作用观察
2011-09-06马金丽
马金丽
胃癌是消化系统最常见的恶性肿瘤之一。尽管胃癌的发病率和病死率已经显著下降,但仍然在全世界恶性肿瘤的病死率中占第二位[1]。手术是治疗胃癌最有效的方法。然而仅有30%~40%的胃癌患者可通过单纯的手术治疗获得治愈,大部分患者死于肿瘤的复发或远处转移[2]。由于胃癌早期缺乏特异性症状,诊断率低,大部分患者确诊时都已经到达晚期,失去了手术的机会。而化疗是治疗晚期胃癌的主要手段[3-4]。早期研究证实晚期胃癌不进行化疗,中位生存期只有3~4个月,而化疗后可达6个月,且化疗可提高患者的生活质量[5]。
晚期胃癌的化疗方案多以联合治疗为主,其中以5-氟尿嘧啶 (5-Fu)及顺铂 (DDP)的全身化疗方案 (CF方案)最为常用,并在临床上延长了胃癌患者的生存期,同时提高了患者的生活质量。最近一项临床研究发现,多西紫杉醇联合DDP及5-FU方案,即DCF方案,其临床有效率 (RR)、肿瘤进展时间 (TTP)和总生存时间 (OS)均优于CF标准方案,但DCF方案有严重的毒副反应,导致患者难以耐受[6-7]。我院应用改良DCF方案治疗晚期胃癌,并与DCF方案比较,发现毒副作用发生率低,现报道如下。
1 资料与方法
1.1 入选标准 (1)病理确诊及术后转移或复发的晚期胃癌患者; (2)患者均有CT可测量病灶及转移病灶;(3)未接受过化疗或末次化疗结束至少1个月;(4)无明显肝肾功能障碍和心电图异常,无颅内转移证据;(5)预计生存期超过3个月;(6)Karnofsky评分≥60分; (7)签署书面知情同意书。
1.2 一般资料 选择2008—2010年在我院治疗的晚期胃癌患者30例,其中男12例,女18例;年龄36~60岁,中位年龄47岁。初治19例,复治11例;病理类型:黏液腺癌15例,低分化腺癌9例,印戒细胞癌4例,未分化癌1例,腺鳞癌1例;腹腔内淋巴结转移12例,肝转移8例,肺转移5例,腹膜转移3例,腹壁转移2例。
将30例患者按照分层随机分组法分为两组:对照组14例,其中男6例,女8例;平均年龄50.6岁。治疗组16例,其中男7例,女9例;平均年龄52.4岁。两组患者的性别、年龄间有均衡性。
1.3 治疗方法 对照组化疗用法为:多西紫杉醇30 mg/m2静脉输注1 h,第1天及第8天;DDP 20 mg/m2,静脉输注,第1~5天;5-FU 750 mg/m2,静脉持续输注24 h,第1~5天,21 d为1个周期,共治疗3个周期。治疗组化疗方法为:多西紫杉醇30 mg/m2静脉滴注l h,第1天及第8天;DDP 20 mg/m2,静脉输注,第1~5天;亚叶酸钙0.2 g/m2,2 h静脉滴注,第1~3天;亚叶酸钙滴完后给予5-FU 750 mg/m2,静脉持续输注24 h,第1~5天;21 d为1个周期,共治疗3个周期。两组患者治疗过程中出现恶心、呕吐等胃肠道反应时给予甲氧氯普胺(胃复安)、盐酸格雷司琼、地塞米松等对症处理;若出现白细胞下降,给予升白药物 (强力升白片,成都地奥制药集团有限公司生产)口服或者皮下注射重组人粒细胞巨噬细胞集落刺激因子 (特尔立针,厦门特宝生物工程股份有限公司生产);若出现血小板下降可口服升血小板药物 (复方皂矾丸,陕西郝其军制药股份有限公司生产)对症处理。
1.4 观察指标 每次化疗前进行美国东部肿瘤协作组活动状态 (ECOG PS)评分,血常规、肝肾功能实验室检查,胸部X线片或CT和腹部B超影像学检查。化疗期间每周查血常规至少1次,疗程结束后对其近期 RR、临床受益反应、TTP、生存率、毒副反应及生活质量进行评价。
1.5 疗效和毒副作用评估 疗效分为完全缓解 (CR)、部分缓解 (PR)、稳定(SD)、进展 (PD)。以 CR+PR计算RR。以CR+PR+SD计算疾病控制率(DCR)。疾病无进展时间为治疗开始至肿瘤病灶出现的进展时间。1年生存率指1年后仍然存活的研究对象所占百分比。中位生存时间 (MST)表示恰好有50%的研究对象个体尚存活的时间。生活质量参照Kamofsky评分标准拟定,治疗后较治疗前增加值≥10分者为提高,增减值<10分者为稳定,减少值>10分者为减退。生活质量包括行为状态评分、体质量、治疗前后食欲变化。毒性反应按WHO抗癌药物急性与亚急性毒性表现和分级标准判定,分0~Ⅳ级。
1.6 统计学方法 所有数据使用SPSS 12.0统计软件进行统计检验。计数资料以百分率表示,采用 χ2检验。P<0.05为差异有统计学意义。采用Kaplan-Meier法分析OS。
2 结果
2.1 疗效 治疗后治疗组RR为56.2%,DCR为 81.2%;对照组 RR为 42.9%,DCR为64.3%。两组患者RR及DCR比较,差异均无统计学意义 (χ2值分别为0.536 和 1.099,P 值分别为 0.464 和0.295,见表1)。
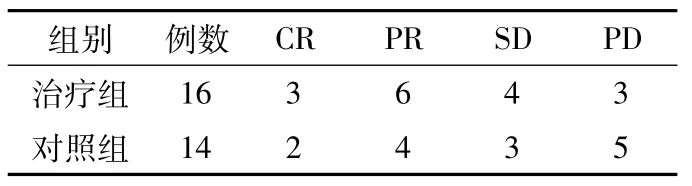
表1 对照组和治疗组疗效分析 (例)Table1 The efficacy analysis of the control group and the treatment group
2.2 生存情况 治疗组1年生存率为56.2% (9/16),对照组为 35.7% (5/14),两组间比较差异无统计学意义 (χ2=1.265,P=0.261)。治疗组 TTP 为 6.5个月,对照组为5.1个月。用 Kaplan-Meier法描述两组的生存过程,治疗组和对照组的MST分别为12.1个月和9.5个月,log-rank检验比较两组的生存过程相同 (χ2=2.725,P=0.099,见图1)。

图1 治疗组和对照组生存时间曲线分析Figure1 The survival curve analysis of the control group and the treatment group
2.3 生活质量 治疗组生活质量提高7例,稳定5例,减退4例;对照组生活质量提高4例,稳定4例,减退6例。两组生活质量比较,差异无统计学意义 (χ2=1.071,P=0.301)。
2.4 毒副反应 治疗组和对照组在化疗过程中主要的毒副反应为骨髓抑制、胃肠反应、神经毒性和脱发。其中骨髓抑制发生率达100.0%。治疗组白细胞减少Ⅲ~Ⅳ级占37.5%(其中Ⅳ级为12.5%),对照组Ⅲ~Ⅳ级占57.14% (其中Ⅳ级为21.43%),且复治的发生率高,两组比较差异有统计学意义 (χ2=2.151,P<0.05)。两组粒细胞减少均以Ⅲ~Ⅳ级为主 (分别占68.75%和85.71%);血小板减少在治疗组以Ⅰ级为主 (占37.50%),在对照组以Ⅱ级为主 (占42.85%)。两组胃肠道反应 (如恶心、呕吐和腹泻)、口腔黏膜炎、神经毒性、脱发、肝功能异常和手足综合征在化疗过程中均以Ⅰ~Ⅱ级为主 (见表2)。治疗组患者用药后胃肠道反应得到缓解。
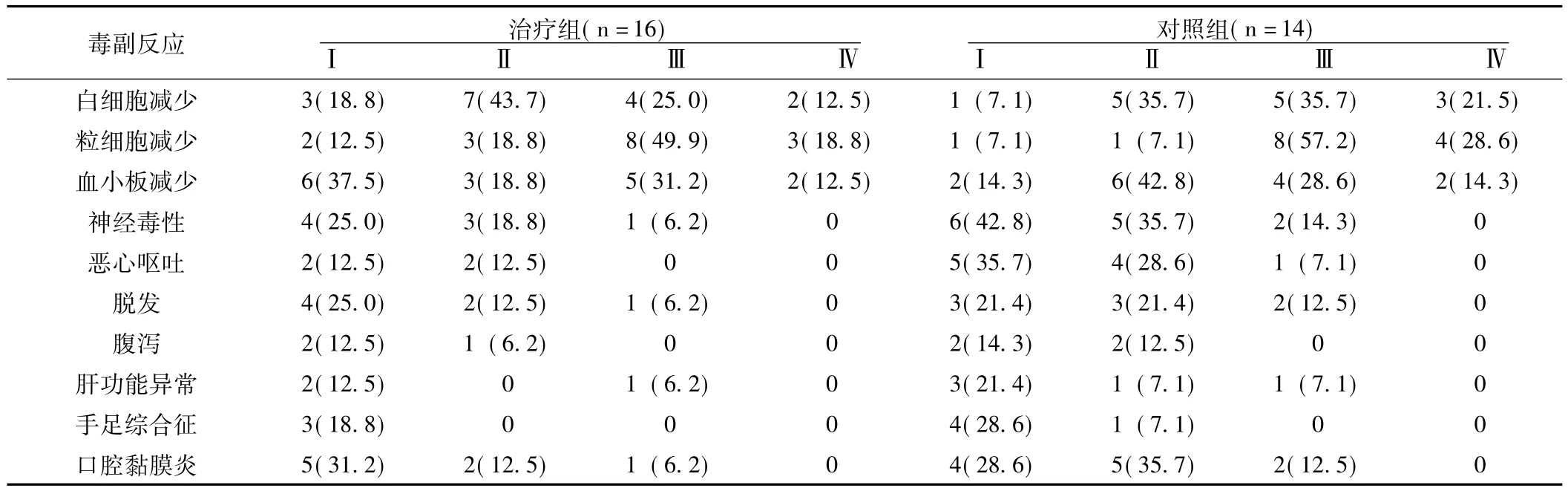
表2 治疗组和对照组毒副反应分析[n(%)]Table2 The oxicity analysis of the control group and the treatment group
3 讨论
胃癌作为病死率较高的肿瘤之一,发病具有明显的地域性。2009年美国约有21 130例新诊断病例,并且约有10 620例患者死于胃癌[7]。东亚地区为胃癌的高发区,我国胃癌的发病率居世界首位,每年发病约40万,死亡约30万[8],胃癌诊治是我国的一个研究热点。目前,在胃癌的综合治疗方案中,手术治疗仍占主导地位。临床上术后5年生存率最高不超过6成。目前研究也显示,晚期胃癌已经成为全身疾病,故单独的手术对胃癌的治疗非常局限。于是化疗成为治疗晚期胃癌的主要手段。
近年来,围绕胃癌的化疗方案进行了多方探索,使晚期胃癌化疗的效果得以提高。其中DCF方案成为美国国立综合癌症网络 (NCCN)指南治疗进展期胃癌的重要推荐方案之一。但是,该方案中也发生了一些Ⅲ~Ⅳ级的严重毒副反应,给胃癌的治疗带来局限。本研究在DCF方案基础上增加了亚叶酸钙,形成了改良的DCF方案。在该方案中,多西紫杉醇是一种在治疗消化道肿瘤上疗效显著的新型抗癌药,其作用机制是通过干扰细胞有丝分裂和分裂间期细胞功能所必需的微管网络而起抗肿瘤作用。多西紫杉醇与天然紫杉相比,其活性更强,抗瘤谱更广,在胃癌细胞株的体内外实验中被证明是有活性的[9],同时临床试验证实其在治疗晚期胃癌方面有很好的疗效[10]。5-FU是治疗胃癌重要的化疗药物,单独治疗胃癌的RR大约为20%,其与DDP联用有协同效应,是临床治疗的经典联用方案。亚叶酸钙是5-FU的生化调节剂,与5-FU联用具有提高5-Fu疗效、降低毒副反应的作用[11]。
本研究结果显示,改良的DCF方案治疗晚期胃癌的 RR达到56.2%,DCR为81.2%,与DCF方案的 RR(42.9%)和DCR(64.3%)相当;同时,前者的生存期和生活质量有进一步的提高,毒副作用也有相应的改善,特别是骨髓抑制方面。以上研究证实改良DCF方案有较好的疗效,适合临床推广应用。
1 Shah MA,Schwartz GK.Treatment of metastatic esophagus and gastric cancer[J].Semin Oncol,2004,31(4):574-587.
2 Gong SJ,Jin CJ,Rha SY,et al.Growth inhibitory effects of trastuzumab and chemotherapeutic drugs in gastric cancer cell lines[J].Cancer Lett,2004,214(2):215-224.
3 Paoletti X,Oba K,Burzykowski T,et al.Benefit of adjuvant chemotherapy for resectable gastric cancer:a meta-analysis[J].JAMA,2010,303(17):1729-1737.
4 Hejna M,Wöhrer S,Schmidinger M,et al.Postoperative chemotherapy for gastric cancer[J].The Oncologist,2006,11(2):136-145.
5 Glimelius B,Ekström K,Hoffman K,et al.Randomized comparison between chemotherapy plus best supportive care with best supportive care in advanced gastric cancer[J].Ann Oncol,1997,8(2):163-168.
6 Ajani JA,Moiseyenko VM,Tjulandin S,et al.Clinical benefit with docetaxel plus fluorouracil and cisplatin compared with cisplatin and fluorouracil in a phase III trial of advanced gastric or gastroesophageal cancer adenocarcinoma:the V-325 study group[J].J Clin Oncol,2007,25:3205-3209.
7 Yang L.Incidence and mortality of gastric cancer in China[J].World J Gastroenterol,2006,12(1):17-20.
8 Eisenhauer EA,Therasse P,Bogaerts J,et al.New response evaluation criteria in solid tumours:revised RECIST guideline(version 1.1)[J].Eur J Cancer,2009,45(2):228-247.
9 Tanaka M,Obata T,Sasaki T.Evaluation of antitumour effects of docetaxel(Taxotere)on human gastric cancers in vitro and in vivo[J].Eur J Cancer,1996,32A(2):226-230.
10 Roth AD,Ajani J.Docetaxel-based chemotherapy in the treatment of gastric cancer[J].Ann Oncol,2003,14(2):1141-1144.
11 Van Cutsem E.The treatment of advanced gastric cancer:new findings on the activity of the Taxanes[J].The Oncologist,2004,9(Suppl 2):9-15.
