铜绿假单胞菌诱导巨噬细胞凋亡与细胞周期的关系
2011-09-05柴文戍
柴文戍,李 颖
(辽宁医学院附属第一医院,辽宁 锦州 121001)
铜绿假单胞菌(PA)是种植于支气管扩张、肺囊性纤维化和慢性阻塞性肺病患者下呼吸道的机会致病菌,可持续刺激宿主免疫反应导致进展性气道破坏,广泛存在于土壤、水及各种动物体内,具有多重耐药的特点[1],一旦感染,临床治疗十分困难。肺巨噬细胞是肺组织细胞免疫的首道屏障,在肺部特异及非特异免疫系统中起重要作用。国内研究发现,PA 能诱导人类 U937 细胞发生凋亡[2,3]。随着细胞和分子生物学的发展,人们逐步认识到细胞周期不仅与细胞增殖直接相关,而且与细胞分化和凋亡有关[4]。然而,PA诱导J774细胞凋亡是否与细胞周期有关目前尚不清楚。2009年8月~2010年10月,我们通过流式单染技术检测细胞凋亡率和细胞周期,探讨PA感染宿主的发病机制。
1 材料与方法
1.1 材料与试剂 PA采用标准菌株ATCC27853,辽宁医学院第一附属医院检验中心惠赠,用LB培养基培养。J774巨噬细胞来源于鼠网状细胞肉瘤,由中国医学科学院协和医科大学基础医学研究所提供。培养基采用含10%FBS和100 U/ml庆大霉素的高糖型DMEM。Annexin V凋亡检测试剂盒购自北京宝赛生物技术有限公司,其他试剂均为进口或国产分析纯。
1.2 方法
1.2.1 细菌上清液的制备 在8 ml大豆肉汤培养基中通过振荡培养法(37℃,8 h)对PA进行增菌,5000 r/min 离心15 min 后,用孔径0.22 μm 的滤膜过滤,获得细菌上清液,最后灭火(56℃、1 h),-20℃储存备用。
1.2.2 细菌感染细胞 将贴壁的J774细胞常规胰蛋白酶消化传代,接种于25 cm2的培养瓶中,置37℃、5%CO2培养箱中培养,隔2 d换液1次。生长基本融合的贴壁J774细胞弃培养基,加入2 ml含胎牛血清、不含抗生素的DMEM悬浮细菌液,使J774细胞与PA上清液以15%的浓度混合,37℃水浴中培养3、6、9 h后分别行J774细胞凋亡检测。同时将实验分为:①正常对照组(不含PA);②PA感染3 h组;③PA感染6 h组;④PA感染9 h组。
1.2.3 凋亡细胞检测 ①吉姆萨染色:与PA上清液共培养3、6、9 h后的J774细胞用PBS冲洗2遍,然后用甲醇室温固定5~7 min,干燥后用吉姆萨染液染色15 min,三蒸水冲洗3遍,空气中晾干,将盖玻片用纯甘油固定在载玻片上,用普通显微镜观察。②Annexin V/PI单染分析进行细胞凋亡率和细胞周期检测:取PA上清液作用0、3、6、9 h的细胞上流式细胞仪检测,按实验设计处理细胞后,用70%的冷乙醇固定,采用PI一步插入性DNA定量荧光染色法检测细胞周期和细胞凋亡率。
1.3 统计学方法 应用SPSS16.0统计软件,结果以表示,计量资料比较采用t检验。P≤0.05为差异有统计学意义。
2 结果
2.1 细胞形态观察 吉姆萨染色结果显示,感染3 h组细胞膜完整但出现发泡现象,感染6 h组出现凋亡细胞的染色质浓缩、染色质分割成块状和凋亡小体等典型的凋亡形态。感染9 h组细胞出现皱缩、变圆,可见凋亡小体。随着感染细胞时间的延长,各实验组的凋亡细胞逐渐增多,对照组则不受影响。
2.2 细胞凋亡率和细胞周期检测结果比较 PA上清液对J774细胞有明显的抑制生长的作用,流式细胞图可见典型的亚二倍体凋亡峰,细胞周期分布显示,9 h内S期细胞随时间延长而减少,G0/G1期细胞逐渐增多,凋亡率也增加。各实验组与对照组比较均有统计学差异(P均<0.01);各实验组间比较亦有统计学差异(P均<0.01)。见表1。
3 讨论
目前,研究细胞凋亡与细胞周期的关系已成为热点。本实验以吉姆萨染色及流式单染技术研究了PA上清液对J774细胞凋亡的诱导作用,发现PA上清液能诱导 J774细胞发生凋亡,与国外研究一致[5]。通过吉姆萨染色观察细胞形态学改变,感染3 h组细胞膜完整但出现发泡现象,感染6 h组出现凋亡细胞的染色质浓缩、边缘化,核膜裂解、染色质分割成块状和凋亡小体等典型的凋亡形态。感染9 h组细胞出现皱缩、变圆,可见凋亡小体。且随着J774细胞感染时间延长,凋亡的J774细胞增多。根据流式单染技术证实,S期细胞随时间延长而减少,G0/G1期细胞渐增多,凋亡率也增加。提示PA以时间依赖方式诱导人J774细胞凋亡,同时说明PA诱导J774细胞凋亡与细胞周期有关。
表1 PA上清液对J774细胞周期分布和凋亡的影响(n=5,%,)
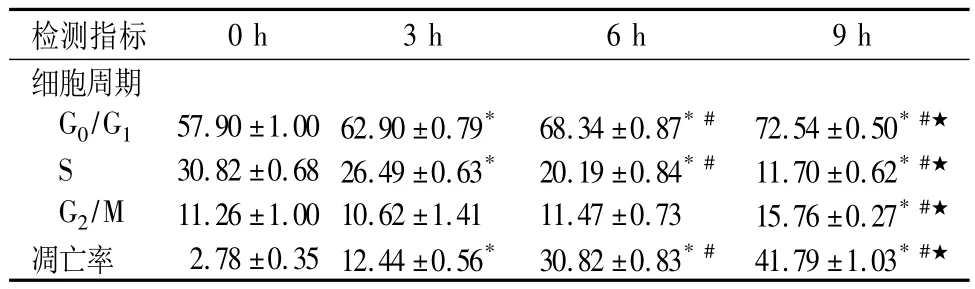
表1 PA上清液对J774细胞周期分布和凋亡的影响(n=5,%,)
注:与0 h比较,*P <0.01;与3 h比较,#P <0.01;与6 h比较,★P <0.01
检测指标0 h 3 h 6 h 9 h细胞周期G0/G1 57.90 ±1.0062.90 ±0.79* 68.34 ±0.87*# 72.54 ±0.50*#★S 30.82 ±0.6826.49 ±0.63* 20.19 ±0.84*# 11.70 ±0.62*#★G2/M 11.26 ±1.0010.62 ±1.41 11.47 ±0.73 15.76 ±0.27*#★凋亡率 2.78 ±0.3512.44 ±0.56* 30.82 ±0.83*# 41.79 ±1.03*#★
细胞周期是一个动态过程,每个分期互相联系,不可分割。按DNA合成、分裂过程分为合成前、合成期、合成后期和分裂期,即G0/G1、S、G2和M 期,M期细胞一分为二。影响细胞周期的外界因素如生物、理化因素及缺氧、营养不良等,都可导致细胞周期的各种改变如G1期阻滞、S期蓄积、G2期阻滞和M期延缓等[6],造成细胞增殖发生障碍。细胞周期的改变既是受损的结果,也是自我保护的表现,周期暂时停止进程,会避免错误即受损的DNA复制、分裂,直至缺陷得以纠正,细胞才会顺利进入下一时相[7]。较小的DNA损伤引起细胞周期停滞,而较严重的DNA损伤使得细胞凋亡。一些关键的细胞周期调控蛋白也参与细胞凋亡的调节,提示细胞周期和细胞凋亡存在一个协调的机制。有研究证明,饱和脂肪酸棕榈酸可促进细胞凋亡,抑制细胞增殖,且作用呈时间与剂量依赖性。其机制为使细胞周期阻滞于G0/G1期,降低S期细胞比例。提示饱和脂肪酸棕榈酸抑制细胞的增殖是通过G0/G1期向S期的转换,阻滞细胞周期进程,影响其复制。
流式细胞仪可通过观察整个细胞周期DNA含量的变化来分析细胞的凋亡。整个复制周期可以描述为G0/G1、S、G2/M。本研究通过流式单染技术,证明PA上清液能诱导J774细胞凋亡,且与细胞周期有关,具有统计学意义。在细胞调控中,G1~S期调控点是细胞内外信号传递、整合汇集到细胞核对细胞增殖进行调控的关键点[8]。
综上所述,PA上清液能诱导J774细胞凋亡,且与细胞周期有关。因此,寻找调节G1~S期调控点的药物,对临床抑制PA感染具有良好的前景。
[1]Valerie A,Shiri NV,Yardena SI,et al.Multidrug-resistant pseudomonas aeruginosa:risk factors and clinical impact[J].Antimicrobial Agents and Chemotherapy,2006,50(1):143-148.
[2]Robert V,Michel P,Flaman JM,et al.High frequency in esophageal cancers of p53 alterations inactivating the regulation of genes involved in cell cycle and apoptosis[J].Carcinogenesis,2000,21(4):563-565.
[3]Chai WS,Chen BY,Zhu XM,et al.Role of Bcl-2 family members in caspase-3/9-dependent apoptosis during Pseudomonas aeruginosa infection in U937 cells[J].Apoptosis,2008,13(6):833-843.
[4]朱小敏,柴文戍.铜绿假单胞菌感染诱导U937细胞凋亡的研究[J].中国病原生物学杂志,2008,3(4):263-265.
[5]Zhang JL,Takashi M,Yoshinori T,et al.Induction of apoptosis in macrophage cell line,J774,by the cell-free supernatant from pseudomonasaeruginosa[J].Microbiol Immunol,2003,47(3):199-206.
[6]Gottlieb TM,Oren M.P53 in growth control and neolasia[J].Biochimi Biophs Acta,1996,1287(2-3):77-102.
[7]夏雄智,樊粤光,刘武,等.不同浓度地塞米松对成骨样细胞OS-732细胞凋亡和细胞周期的影响[J].广州中医药大学学报,2008,25(4):355-358.
[8]崔巍,黄葶,刘均利,等.饱和脂肪酸对胰岛β细胞凋亡和细胞周期进程的影响[J].西安交通大学学报,2009,30(3):301-306.
