2型糖尿病早期肾损害与心室重构的关系
2011-09-05秦春梅尹福在马春明吴广飞
秦春梅,刘 波,尹福在,陆 强,马春明,吴广飞
(秦皇岛市第一医院,河北 秦皇岛 066000)
近年来,随着糖尿病(DM)的发病率不断增高,DM引起的肾功能损害逐渐增多。有研究发现,肾功能损害与心血管疾病存有关联,但DM早期肾损害与心室重构的关系研究较少。2007~2010年,我们观察了DM患者早期肾损害对心室重构的影响。现报告如下。
1 资料与方法
1.1 临床资料 选择在我院住院的2型糖尿病(T2DM)患者136例(T2DM组),均符合1999年WHO制定的DM诊断标准,并排除:1型及继发性DM,高血压、冠心病等心脏疾病,严重肝病及其他原因所致肾脏疾病患者。根据24 h尿微量白蛋白定量(UMA)分为2组:DM组(UMA定量<30 mg/24 h)77例,男43例、女 34例,年龄(51.89±12.71)岁;微量白蛋白尿组(早期DN组,UMA定量30~300 mg/24 h)59例,男37例、女22例,年龄(52.05±8.35)岁。同期选择我院健康体检者90例作为对照组,男53 例、女37 例,年龄(51.36 ±8.26)岁。三组临床资料具有可比性。
1.2 方法
1.2.1 血、尿生化指标的检测 禁食8~10 h后,次日晨起采集空腹静脉采血,采用日立7170型全自动血液生化分析仪检测血糖(PG)、TC、TG、HDL-C、LDL-C、血尿素氮(BUN)、血肌酐(Cr)、血尿酸(UA)和纤维蛋白原(Fg),并留晨尿做常规检查。所有研究对象于病情稳定,并避免应激、全身或尿路感染、发热和体力活动后留取24 h尿,采用免疫比浊法检测UMA;同步测空腹血糖(FPG)及胰岛素(FINS),计算稳态模型评估胰岛素抵抗指数(HOMA-IR);内生肌酐清除率(Ccr)男性由公式[(140-年龄)×体质量]÷[72 ×Cr]计算,女性此计算结果 ×0.85。
1.2.2 左室结构的评估 采用美国惠普sonic5500型彩色多普勒超声诊断仪,探头为2.5~4.0 MHz变频探头。取患者左侧卧位,床头侧抬高和水平面成30°角,使用M、B型及多普勒超声。M型超声经胸骨旁左室长轴切面连续10次以上心动周期观察,让取样线刚好通过二尖瓣尖或稍偏下,主要测量舒张期末左室内径(LVD)、舒张期末左室后壁厚度(LVPW)、舒张期末室间隔厚度(IVS)。测量3个心动周期取平均值。
1.2.3 左室相关参数计算 ①按Dervereux校正公式:左室质量(LVM)=0.8 ×1.04 × [(IVS+LVD+LVPW)3-LVD3]+0.6 g;相对室壁厚度(RWT)=2×LVPW/LV;左室质量指数(LVMI)=LVM/身高(m)2.7,男性 LVMI≥50 g/m2.7、女性 LVMI≥47 g/m2.7为左室肥厚(LVH)。②左室重构的类型:正常:LVMI正常,RWT<0.45;向心性重构:LVMI正常,RWT≥0.45;向心性肥厚:LVH 和 RWT≥0.45;离心性肥厚:LVH 和 RWT <0.45。
1.3 统计学方法 采用SPSS11.5统计软件,结果以表示,率的比较采用χ2检验(Fisher确切概率法),多组间比较用方差分析,HOMA-IR呈偏态分布取其自然对数再行统计分析。相关分析采用Pearson相关分析,危险因素分析应用多元逐步回归分析。P≤0.05为差异有统计学意义。
2 结果
2.1 各组生化指标比较 见表1。
2.2 各组左室重构指标比较 对照组中无LVH者,DM 组中有 1例(1.298%),DN组有 7例(11.864%)。DN组LVH罹患率均高于DM组、对照组(P均<0.05)。见表2。
2.3 DN组LVMI与各指标的Pearson相关分析及多元线性回归分析 相关分析显示,LVMI与BMI、LDL、年龄、UMA 呈正相关(r分别为 0.395、0.641、0.265、0.605,P <0.05或 <0.01)。以 FPG、2 h PG、HOMA-IR、TG、LDL、UMA 为自变量,以 LVMI为因变量,进行多元线性回归分析,结果显示:UMA、年龄为 LVMI升高的危险因素(β分别为 0.485、0.177,P 均 <0.01)。
表1 DM组、早期DN组与对照组生化指标比较()
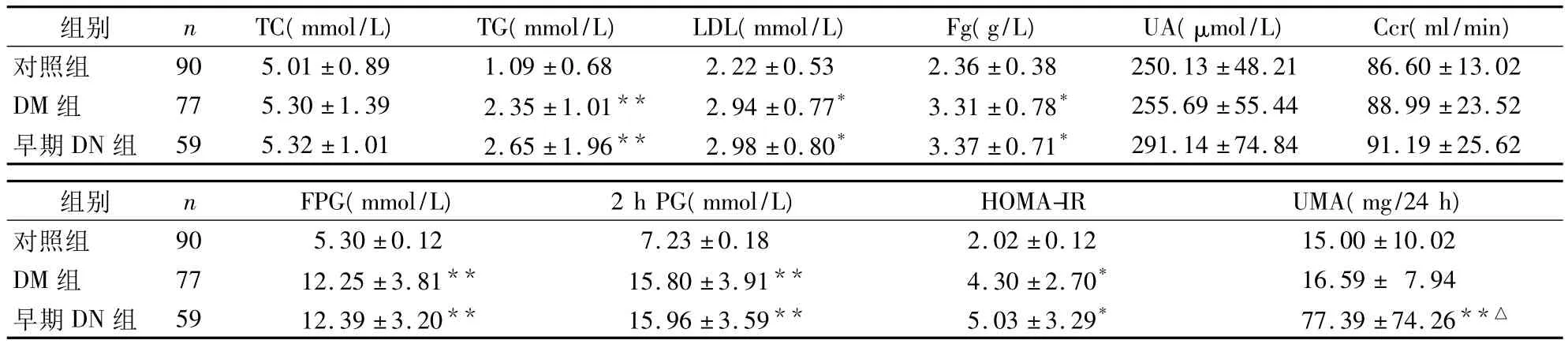
表1 DM组、早期DN组与对照组生化指标比较()
注:与对照组比较,*P <0.05,**P <0.01;与 DM 组比较,△P <0.01
组别 n TC(mmol/L) TG(mmol/L) LDL(mmol/L) Fg(g/L) UA(μmol/L) Ccr(ml/min)对照组 90 5.01 ±0.89 1.09 ±0.68 2.22 ±0.53 2.36 ±0.38 250.13 ±48.21 86.60 ±13.02 DM 组 77 5.30 ±1.39 2.35 ±1.01** 2.94 ±0.77* 3.31 ±0.78* 255.69 ±55.44 88.99 ±23.52早期 DN 组 59 5.32 ±1.01 2.65 ±1.96** 2.98 ±0.80* 3.37 ±0.71*291.14 ±74.84 91.19 ±25.62组别 n FPG(mmol/L) 2 h PG(mmol/L) HOMA-IR UMA(mg/24 h)对照组 90 5.30 ±0.12 7.23 ±0.18 2.02 ±0.12 15.00 ±10.02 DM 组 77 12.25±3.81** 15.80±3.91** 4.30±2.70* 16.59± 7.94早期 DN 组 59 12.39±3.20** 15.96±3.59** 5.03±3.29* 77.39±74.26**△
表2 各组左室重构指标比较()
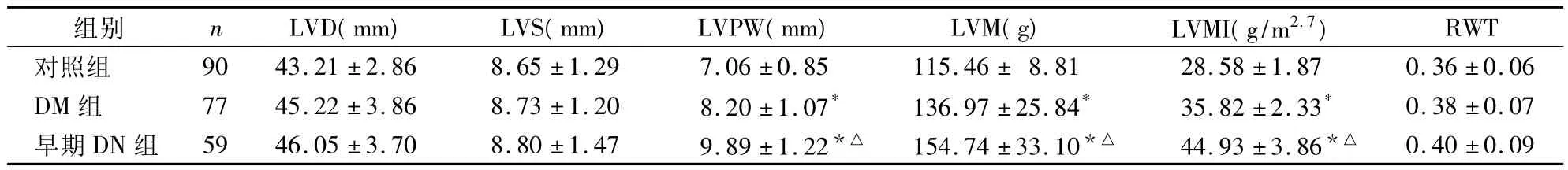
表2 各组左室重构指标比较()
注:与对照组比较,*P <0.05;与 DM组比较,△P <0.05
组别 n LVD(mm) LVS(mm) LVPW(mm) LVM(g) LVMI(g/m2.7)RWT对照组 90 43.21 ±2.86 8.65 ±1.29 7.06 ±0.85 115.46 ± 8.81 28.58 ±1.87 0.36 ±0.06 DM 组 77 45.22 ±3.86 8.73 ±1.20 8.20 ±1.07* 136.97 ±25.84* 35.82 ±2.33* 0.38 ±0.07早期 DN 组 59 46.05 ±3.70 8.80 ±1.47 9.89 ±1.22*△ 154.74 ±33.10*△ 44.93 ±3.86*△0.40 ±0.09
3 讨论
上世纪90年代初,临床和流行病学研究均发现,肾功能损害和心血管疾病的发生、发展有关[1]。早期肾功能损害患者心血管疾病的罹患率和病死率显著增高[2],但有关早期肾损害与心室重构的关系鲜见报道。
Shestakova等[3]在对60名1型糖尿病患者的研究中发现,心脏病理的严重程度与DN的严重程度相关,微量尿蛋白组缺血性心脏病的发病率为13%、蛋白尿组为33%、慢性肾功能衰竭组为53%。三组中左心室重构的发生率分别为33%、40%、60%。在本研究中,早期肾损害者的LVPW和LVMI比肾功能正常者均显著增高,LVH罹患率也显著高于肾功能正常者。DM组LVH罹病率为1.298%,早期DN组LVH罹病率为11.864%,早期DN组明显高于DM组,与其研究结果一致。Hermans等[4]在对806例患者的颈总动脉(CCA)内膜—中层厚度、管壁张力、管腔直径等指标进行研究后发现,校正年龄、性别、糖耐量及心血管疾病等影响因素后,尿蛋白与CCA内腔直径独立相关,并与动脉重构相关,UMA是心血管疾病及中风的相关危险因素。本研究经Pearson相关分析示,早期DN组LVMI与 BMI、UA、LDL、UMA、年龄呈显著正相关。以 FPG、2 h PG、HOMA-IR、TG、LDL、UMA 为自变量,以LVMI为因变量,进行多元线性回归分析,结果显示年龄、UMA为LVMI升高的危险因素。表明T2DM早期肾损害患者存在左室重构,UMA为左室重构的危险因素,与上述结果相一致。
目前,DM早期肾损害致心室重构的机理尚不十分明确。早期肾功能损害可以通过多种机制激活全身和局部的RAS系统,导致AngⅡ合成和分泌增加。AngⅡ可以促使细胞有丝分裂,激活许多与增生有关的原癌基因,参与血管壁增生和动脉粥样硬化等过程,是导致心血管重构的重要原因[5]。AngⅡ能促进心肌细胞增殖和肥大,促进心脏重构[6];AngⅡ不仅有强烈收缩血管,增加血压的作用,还能够促进血管平滑肌细胞增生,使血管内膜增生肥厚,在血管重塑中起作用;其他体液因子如前列腺素、缓激肽等也可能参与了早期肾功能损害对心血管重构的影响[7]。
综上所述,DM患者较易发生心脏结构损伤,早期肾损害对DM心室重构有影响,LVMI的增加和LVH罹患率增加均与UMA有关。UMA水平增高可能有预测早期肾功能损害发生心血管重构的作用。
[1]National Kidney Foundation.K/DOQI clinical practice guidelines for chronic kidney disease:evaluation,classification,and stratification[J].Am J Kidney Dis,2002,39(2 Suppl 1):S1-S266.
[2]Ritz E.Minor renal dysfunction:an emerging independent cardiovascular risk factor[J].Heart,2003,89(9):963-964.
[3]Shestakova MV,Iarek-Martynova IR,Ivanishina NS,et al.Cardiorenal syndrome in type 1 diabetes mellitus:the role of endothelial dysfunction[J].Kardiologiia,2005,45(6):35-41.
[4]Hermans MM,Henry RM,Dekker JM,et al.Albuminuria,but not estimated glomerular filtration rate,is associated with maladaptive arterial remodeling:the Hoorn Study[J].J Hypertens,2008,26(4):633-635.
[5]European Society of Hypertension-European Society of Cardiology Guidelines Committee.2003 European Society of Hypertension-European Society of Cardiololy guidelines for the management of arterial hypertension[J].J Hypertens,2004,22(2):435.
[6]Schillaci G,Reboldi G,Verdecchia P.High-normal serum creatinine concentration is apredictor of cardiovascular risk in essential hypertension[J].Arch Intern Med,2001,161(6):886-891.
[7]Hirano T.Lipoprotein abnormalities in diabetic nephropathy[J].Kidney Int,1999,56(Suppl):s22-s24.
