HPLC法定量分析水中光合细菌菌体产量
2011-09-03张光明
赵 微,张光明
(哈尔滨工业大学 市政环境工程学院,150090哈尔滨,gmgwen@gmail.com)
光合细菌(Photosynthetic bacteria,PSB)是一类以光作为能源、能在光照厌氧或黑暗好氧条件下利用有机物、硫化物、氨等作为供氢体兼碳源进行光合作用的微生物.PSB能有效处理高浓度有机废水[1],对淀粉、豆制品加工[2]、啤酒厂[3]、油脂工业等工业废水及生活污水,处理效果好,对COD的去除率达到60% ~95%,且PSB菌体本身含有丰富的营养物质和生理活性物质[4],能够作为肥料、饲料、饵料[5]回收利用,在处理废水的同时可实现污水资源化.然而,由于废水中各种干扰物质的存在,使得废水中PSB菌体产量的准确测量存在问题.
在纯培养条件下PSB的定量检测方法包括显微镜直接计数法、平板计数法、紫外分光光度法与可见分光光度法、HPLC法等.显微镜直接计数法随机性大,不能宏观、全面地反应菌体数量,在废水处理中一般不采用该方法.平板计数法计数周期长、方法复杂,在废水处理中一般也不采用该方法.紫外分光光度法与可见分光光度法受废水中杂质影响较大,尤其是受色度的影响,因此这2种方法不适合检测带有浊度或色度的废水.HPLC法虽然方法简便易行、精确、不受废水中杂质影响,但不能将PSB作为直接检测物来分析.吴祖芳等的研究[6]表明,PSB 中含有一种特征物质 CoQ10[7](CoQ10又称泛醌,化学名称为2,3-二甲氧基-5-甲基-6-癸异戊烯基-1,4-苯醌).其在PSB中含量较高且相对稳定,可以用它的含量来定量表征PSB的菌体产量.目前CoQ10的检测方法包括紫外分光光度法、可见分光光度法、HPLC法等.同样由于废水中杂质的干扰,导致不能使用分光光度法分析CoQ10的质量.可选的检测方法只有HPLC法,目前测定废水中PSB内CoQ10质量的HPLC方法,国内外未见报道.因此本文研究采用HPLC法分析CoQ10的含量以表征废水中PSB的菌体含量,排除各种干扰因素,拟建立定量分析废水中PSB菌体产量的方法,以期为PSB在废水中的检验与定量分析提供科学依据.
1 试验
1.1 材料
试验所采用的光合细菌为球形红假单胞菌(Rp.sphaeroids),购于中科院微生物研究所.试验采用活性污泥模拟废水中各杂菌,污泥取至处理生活污水A/O工艺的二沉池.试验废水采用浊度较大,有机物质含量较多的人工配水来模拟大豆废水.试验仪器与药品:冰箱(BCD-216ST,Haier);超声波清洗器(HS3120,BENCHTOPCLEANERS);高效液相色谱(Agilent 1200,Agilent Technologies,Inc.).CoQ10标准品(Sigma 公司生产);甲醇、无水乙醇、乙腈、丙酮均为色谱纯.
1.2 方法
CoQ10标准样品的制备:取 CoQ10标准样品30 mg,加入无水乙醇40 mL,在50℃水浴中震荡溶解.放冷后,转移至100 mL容量瓶中,用无水乙醇稀释至刻度摇匀,作为标准品母液,将母液分别稀释为 3.0、2.5、2.0、1.5、1.0 mg/L.所有样品均经0.45 μm膜过滤待用.
纯培养基中CoQ10的提取方法:取2.5 mL发酵液在11 000 r/min的条件下离心10 min,分离上清和菌体.菌体用去离子水洗至中性,得到菌体细胞待用.CoQ10的提取采用冻融辅助超声法[8],将菌体细胞放入冰箱冷冻区冷冻24 h后提取溶剂.样品均经0.45 μm膜过滤后取上清液进行HPLC分析.杂质中CoQ10的提取方法为:分别取7 200 mg/L的大豆废水、160 mg/L的 PSB、7 200 mg/L的大豆废水加 160 mg/L的 PSB,CoQ10的提取方法同上.杂菌中CoQ10的提取方法:取2.5 mL质量浓度为10 000 mg/L的活性污泥,在11 000 r/min的条件下离心10 min,分离上清和菌体.菌体用去离子水洗至中性,得到菌体细胞,CoQ10的提取方法同上.不同培养条件CoQ10的提取方法:将PSB在纯培养基中纯培养7 d,光照-溶解氧条件分别为光照-厌氧、黑暗-好氧、自然光-微好氧.分别取不同培养条件的发酵液2.5 mL,CoQ10的提取方法同上.不同生长时期CoQ10的提取方法:将PSB在纯培养基中培养,光照-溶解氧条件为自然光-微好氧.分别在第24、48、72、96 h 取发酵液 2.5 mL,CoQ10的提取方法同上.安静等研究[9]表明PSB生长前36 h为延滞期,36~72 h为生长期,从72 h开始进入稳定期,96 h以后细胞进入衰亡期.加样回收率试验方法:采用外标加样回收法,取已知含量的CoQ10样品5份,精密称定,分别置具塞的锥形瓶中,加同量的废水 (7 200 mg/L)、PSB(160 mg/L),CoQ10的提取方法同上.
2 结果与讨论
2.1 色谱条件
流动相的选择:选用的色谱柱为Sphherisorb C18(10 cm×4.6 mm ID)柱,柱温35℃,紫外检测波长275 nm,进样量15 μL.流动相分别为甲醇和水、甲醇和乙腈、无水乙醇和水、甲醇和无水乙醇.当流动相为甲醇和水时,检测不到CoQ10标准品.当流动相为甲醇和乙腈时,两者任意比例关系下,色谱峰或者不出峰,或者峰型不对称.当流动相为无水乙醇和水时,由于无水乙醇粘度大,CoQ10标准品的保留时间长,柱压特别高.当流动相为甲醇和无水乙醇时,色谱峰峰型对称出峰较好,因此对甲醇与无水乙醇的比例进行深入研究.分别配制甲醇与无水乙醇的体积比为1∶1、3∶2、4∶1、9∶1进行实验,随着流动相甲醇比例的增加CoQ10标准品的保留时间缩短,当甲醇和无水乙醇比例为3∶2时,在28.773 min出峰,当两者比例为4∶1时,在23.257 min处出峰,当两者比例为9∶1时,在21.183 min处出峰.综合比较后发现,不同比例甲醇与无水乙醇为流动相时峰型都很好,出峰时间选择甲醇与无水乙醇的比例为9∶1.
流速的选择:当流速为0.6 mL/min时,CoQ10标准品的保留时间超过35 min,保留时间过长.当流速为 1.5 mL/min时,柱压过高.当流速为1 mL/min时,CoQ10标准品的保留时间21.183 min,柱压16.4 MPa.综合比较,选择流速为1 mL/min.
综合上述结果,本文提出的色谱条件:色谱柱为 SphherisorbC18(10 cm×4.6 mm ID)柱;甲醇与无水乙醇(体积比9∶1)为流动相;流速为1 mL/min;柱温为 35℃;紫外检测波长为275 nm;进样量为 15 μL;柱压为 16.4 MPa.在此条件下,色谱出峰快、峰型良好.采用如上确立的HPLC检测方法,获得CoQ10标准品谱图与标准曲线分别见图1与图2,由图可见,CoQ10标准品的保留时间为21.183 min,CoQ10标准品密度与峰面积具有良好的相关性.
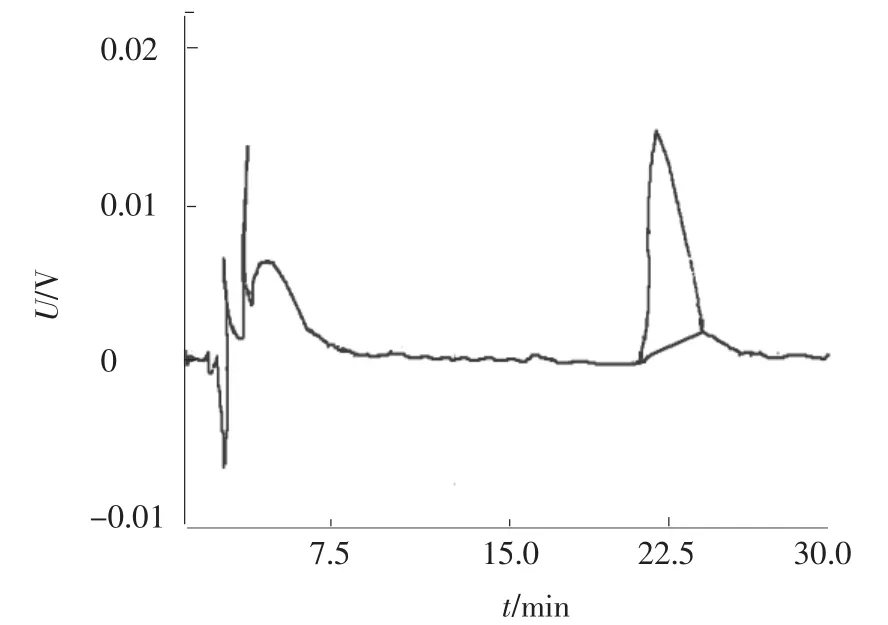
图1 CoQ10标准品HPLC色谱图
2.2 提取溶剂的选择
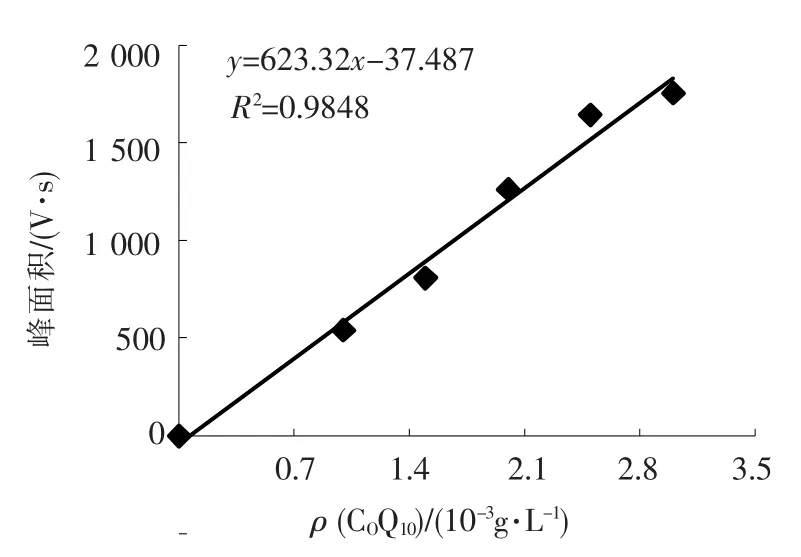
图2 CoQ10标准曲线
由于CoQ10为细胞内物质,其提取效果的好坏直接关系到产品的收率,许芳等研究表明采用乙醇与丙酮对PSB中CoQ10提取效果较好.本文对菌体细胞分别采用:1)无水乙醇提取5 h;2)丙酮提取5 h;3)丙酮提取5 h后,挥发去除全部丙酮,用无水乙醇溶解.不同提取溶剂对CoQ10提取率的影响见图3,可见,先用丙酮提取5 h后,挥发掉全部丙酮,再用无水乙醇溶解,这一提取方法相对提取率最高.
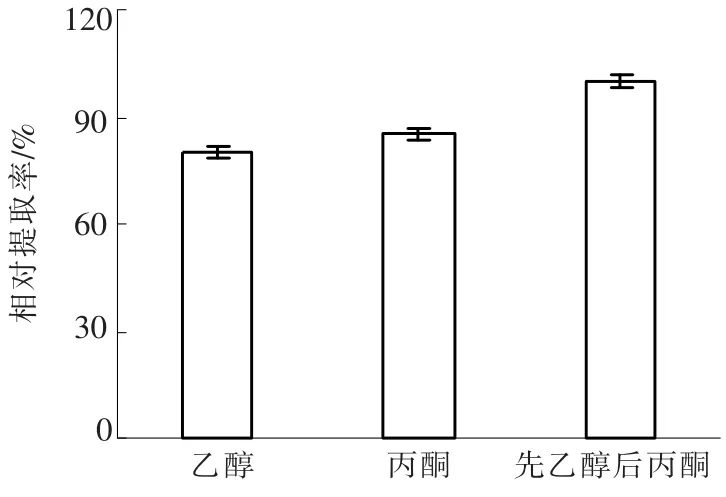
图3 不同溶剂对CoQ10提取率的影响
2.3 外标加样回收率及检测限实验
采用上述确立的检测方法及提取方法,并进行外标加样实验,加样回收率见表1.平均回收率为99.13%,相对标准偏差为0.81%(n=5).实验表明,上述方法精密度高,重复性好,可用于CoQ10的提取与检测.
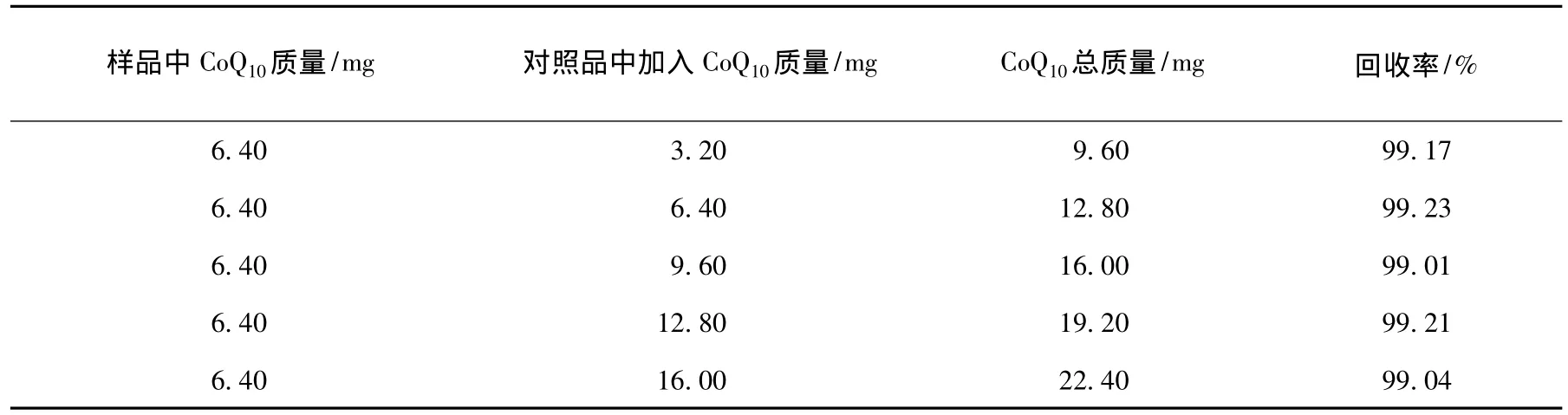
表1 加样回收率(n=5)
表2样品中CoQ10质量检测限试验可见,当CoQ10质量浓度低于9.6 mg/L时,检测结果出现很大的偏差,当CoQ10质量浓度高于22.4 mg/L时,由于质量浓度过高也出现很大的偏差,可重复性差,因此对 CoQ10质量浓度的检测限为9.6~22.4 mg/L.当CoQ10质量浓度低于3.2 mg/L时,应先浓缩再进行检测,当 CoQ10质量浓度高于22.4 mg/L时,应先稀释再进行检测.
2.4 不同培养条件与培养时期对PSB内CoQ10质量的影响
PSB内CoQ10的含量是否稳定将直接关系到检测方法的可行性.PSB培养条件光照-溶解氧组合的不同可能导致PSB代谢类型不同,不同代谢类型的PSB内 CoQ10的质量可能不同[10].同一种微生物在不同的生长时期,由于细胞代谢活力、对不良条件的抵御能力、菌体体积的不同可能引起CoQ10含量不同.不同培养条件及培养时期PSB内CoQ10质量的研究见图4和图5.

表2 检测限试验
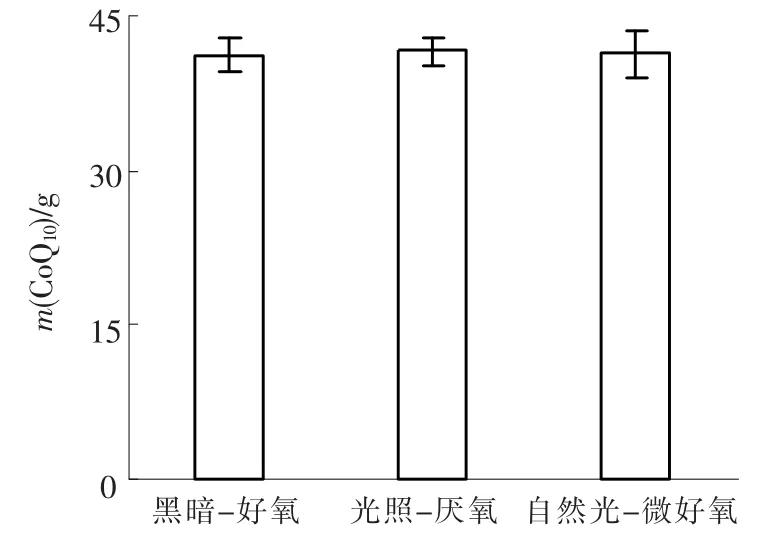
图4 不同培养条件每克烘干后PSB内CoQ10的质量
由图4可见,黑暗-好氧、光照-厌氧、自然光-微好氧条件下,每克烘干后PSB内CoQ10的质量分别为(41.2±1.7)、(41.6±1.3)、(41.3±2.3)mg,不同培养条件下每克烘干后的PSB内CoQ10的质量稳定.
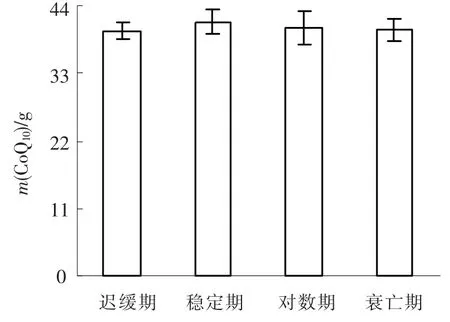
图5 不同培养时期每克烘干后PSB内CoQ10的质量
由图5可见,在不同培养时期迟缓期、稳定期、对数期、衰亡期每克烘干后PSB内CoQ10的质量分别为(39.8±1.4)、(41.4±2.0)、(40.3±1.8)、(40.1±1.9)mg.不同培养时期每克烘干后PSB内CoQ10的质量稳定.
2.5 废水中干扰因素对PSB内CoQ10质量的影响
废水中的糖类、蛋白质、脂类等杂质的存在可能干扰CoQ10的检测.处理污水过程中不可避免地会感染杂菌,杂菌的菌群中可能含有PSB,因此杂菌的存在也可能干扰CoQ10的检测.废水中干扰因素的研究见图6和图7.
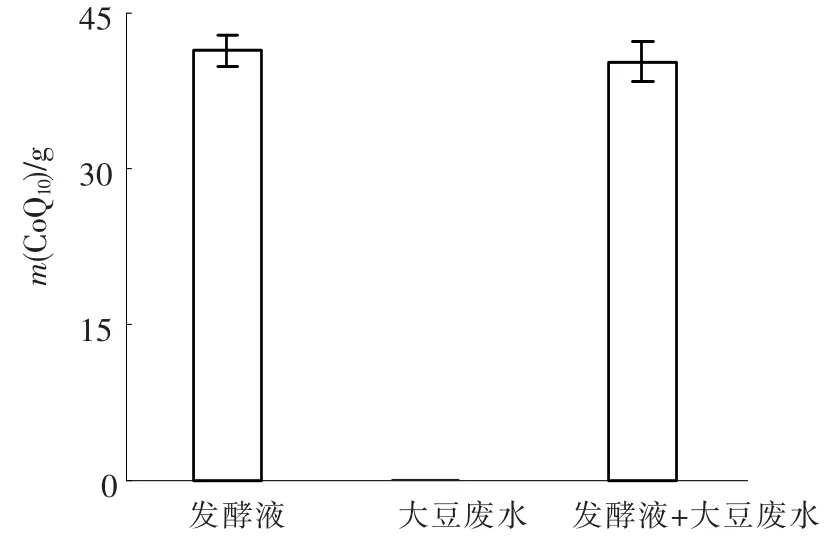
图6 发酵液、大豆废水、发酵液+大豆废水中每克烘干后PSB内CoQ10的质量
由图6可见,发酵液、大豆废水、发酵液+大豆废水中每克烘干后PSB内CoQ10的质量分别为(41.5 ±1.5)、0、(40.3 ±1.9)mg.废水本身不含有PSB,废水中杂质的存在不干扰CoQ10的检测.
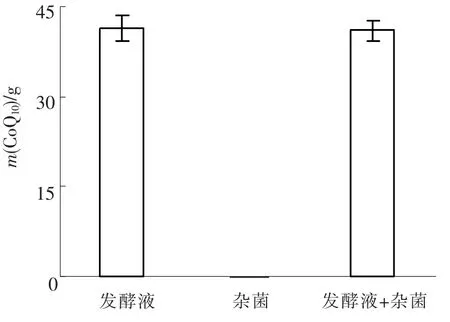
图7 发酵液、杂菌、发酵液+杂菌中每克烘干后PSB内CoQ10的质量
由图7可见,发酵液、杂菌、发酵液+杂菌中每克烘干后PSB内CoQ10的质量分别为(41.5±2.1)、(61.2 ± 0.01)、(41.0 ±1.7)mg.杂菌中CoQ10的含量十分的少,与废水中PSB内CoQ10的质量不在同一数量级上,因此杂菌的存在不干扰CoQ10的检测.
由图4~7可见,不同培养条件及培养时期的PSB内CoQ10质量分数非常稳定,废水中的杂质以及杂菌等干扰因素均不影响CoQ10的检测.表明本方法可用于水及废水中CoQ10质量的检测,从而可用于分析水及废水中PSB的产量.
2.6 PSB菌体产量的换算
由图1可知,CoQ10质量浓度与峰面积关系为
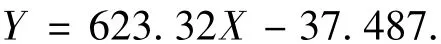
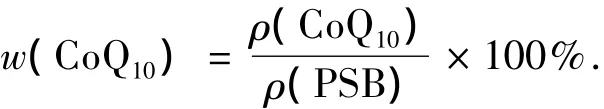
由图 4和图 5可知,CoQ10质量分数为4.08%.
由式(1)、(2)可得,峰面积与PSB质量浓度的关系为
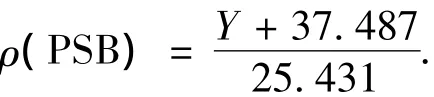
其中:X为CoQ10的质量浓度,g/L;Y为峰面积,V·s;R2=0.984 8).
CoQ10质量分数为
3 结论
1)利用HPLC法分析水与废水中CoQ10的质量来定量表征PSB的产量,建立了一个定量表征水及废水中PSB含量的方法.提出色谱条件为:色谱柱为 SphherisorbC18(10 cm×4.6 mm ID)柱;甲醇与无水乙醇为流动相,体积比9∶1;流速为1 mL/min;柱温35℃;紫外检测波长275 nm;进样量 15 μL;柱压 16.4 MPa.
2)先用丙酮提取5 h后挥掉全部丙酮再用无水乙醇溶解这一提取方法对CoQ10的相对提取率最高.平均回收率为99.13%,相对标准偏差为0.81%(n=5).不同培养条件及培养时期PSB内CoQ10的含量十分稳定.废水中杂质、杂菌等干扰因素均不影响检测结果.
3)PSB质量浓度为(Y+37.487)/25.431 g/L,其中Y为峰面积,V·s,可用上述方法定量分析水中PSB的菌体产量.
[1]LIU Huiling,ZHANG Zhanfeng,LI Changling,et al.Effect of photosynthetic bacteria on tilapia based on water quality and disease resistence[J].Fishery Modernization,2009,6(10):1003-1011.
[2]LIU Shuangjiang.Hydrogen production from soybean wastewater by immobilized photosynthetic Bacteria[J].Chinese Journal of Enviromental Science,1995,1(1):12-19.
[3]戴晓,张光明.光合细菌(Z08)啤酒废水资源化研究[J].哈尔滨工业大学学报,2010,42(6):937 -940.
[4]FRIGAARD N U,MARESCA J A,YUNKER C E,et al.Genetic manipulation of carotenoid biosynthesis in the green sulfur bacterium chlorobium tepidum [J].Journal Bacterial,2004,186(16):5 -10.
[5]付保荣,曹向宇,冷阳,等.光合细菌对水产养殖水质和水生生物的影响[J].生态科学,2008,27(2):172 -179.
[6]KEN S,MASANORI W,YOSHITO S.Applications of photosynthetic bacteria for medical fields[J].Journal of Bioscience,2005,12(3):472-478.
[7]吴祖芳,翁佩芳,陈坚.辅酶Q10的功能研究进展[J].宁波大学学报:理工版,2001,2(2):231 -235.
[8]许芳,张淑荣,张鹏.酶解和冻融辅助超声提取光合细菌中辅酶Q10的研究[J].化学与生物工程,2008,8(2):13-18.
[9]安静.光源和光谱对光合产氢菌群产氢工艺影响研究[D].郑州:河南农业大学,2009.
[10]沈萍,陈向东.微生物学[M].2版.北京:高等教育出版社,2006.
