医院中药制剂质量稳定性监测
2011-08-28吴勇梅
吴勇梅
医院中药制剂在我院临床用药占有较大的比例,其质量稳定性与患者的安全用药息息相关。为了监测我院中药制剂质量的稳定性,验证制剂的有效期,笔者对我院常用的、代表性的7种中药制剂进行12~24个月的有效期内质量稳定性考察,现报告如下。
1 仪器、材料与菌种
AB204-S电子分析天平;ZF-20D型暗箱式紫外分析仪;BJ-Ⅱ型崩解时限仪;pHS-3 c型精密pH计;SHB-1型生化培养箱;MJ-180B霉菌培养箱;YXQ.SG41.280手提式压力蒸汽灭菌器;比重瓶、量筒、培养皿等。供试品均为本院制剂室配制,内服制剂:正骨1号片(批号为20090114)、正骨2号片(批号为20090113)、正骨3号片(批号为20090227)、骨疏宁片(批号为20090225)、补肾健骨口服液(批号为20090107);外用制剂:金黄洗剂 (批号为20090318)、金黄软膏(批号为20090112)。菌种及培养基:大肠埃希菌[CMCC(B)44 102],金黄色葡萄球菌[CMCC(B)26 003],铜绿假单胞菌[CMCC(B)10 104],乙型付伤寒沙门菌[CMCC(B)50 094];营养琼脂培养基,玫瑰红钠琼脂培养基,YPD培养基,胆盐乳糖培养基,MUG培养基,胆盐乳糖发酵培养基,营养肉汤培养基,溴化十六烷基三甲铵琼脂培养基,甘露醇氯化钠琼脂培养基,四硫磺酸钠亮绿培养基,胆盐硫乳琼脂培养基,曙红亚甲蓝琼脂培养基,靛基质试液,亮绿试液,碘试液。
2 方法
2.1 考察期限 根据各制剂品种的有效期制定考察期限:内服制剂考察24个月,外用制剂中金黄洗剂考察12个月,金黄软膏考察24个月。各品种均于通常室温条件下存放。
2.2 性状 内服制剂每30 d观察1次性状变化;外用制剂每15 d观察1次性状变化。
2.3 鉴别 内服制剂及金黄软膏自配制后即刻(0月)及留样3、6、9、12、18、24 个月[1],金黄洗剂自配制后即刻(0 月)及留样3、6、9、12个月,均按本院自订制剂质量标准进行鉴别。
2.4 崩解时限[2]4种片剂按《中国药典》2005年版一部崩解时限检查法,在配制后即刻(0月)及留样3、6、9、12、18、24个月进行检查。
2.5 pH值、相对密度[2]取补肾健骨口服液在配制后即刻(0 月)及留样3、6、9、12、18、24 个月,金黄洗剂在配制后即刻(0月)及留样3、6、9、12个月,均按本院自订制剂质量标准进行pH值、相对密度检查。
2.6 微生物限度[2]按《中国药典 》2005年版一部微生物限度检查法,对内服制剂于配制后即刻(0月)及留样3、6、9、12、18、24 个月,检查细菌、霉菌及酵母菌、大肠杆菌、大肠菌群和沙门菌;对金黄洗剂自配制后即刻(0月)及留样3、6、9、12 个月,金黄软膏自配制后即刻(0 月)及留样 3、6、9、12、18、24个月,检查细菌、霉菌和酵母菌、铜绿假单胞菌及金黄色葡萄球菌。
3 结果
3.1 性状 7种制剂除金黄软膏留样24个月光泽稍差外,其余制剂外观性状均无明显变化,金黄洗剂有少量摇之易散的沉淀,无结块、粘瓶现象。
3.2 鉴别 7种制剂在考察期内均检出质量标准规定应检出的成分(正骨1号片检出α-香附酮、三七皂苷R1;正骨2号片、正骨3号片均检出续断;骨疏宁片检出熊果酸;补肾健骨口服液检出当归;金黄洗剂、金黄软膏均检出大黄酚、姜黄素、盐酸小檗碱)。
3.3 崩解时限 4种片剂在考察期内崩解时限均符合规定,结果见表1。
3.4 pH值、相对密度 2种制剂在考察期内pH值、相对密度均符合规定,结果见表2。
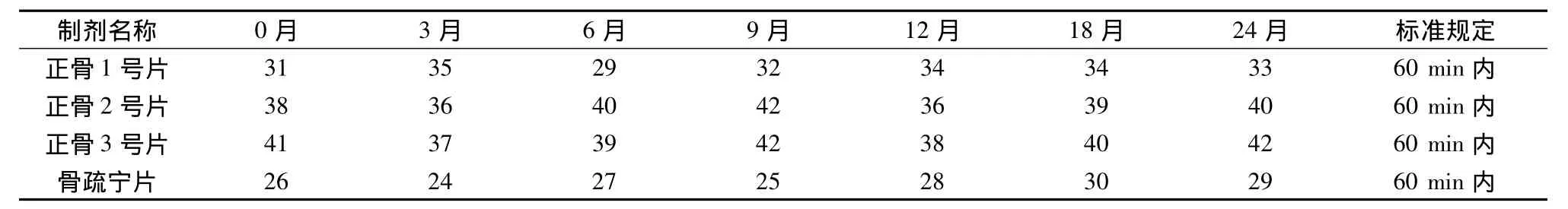
表1 崩解时限测定结果(min)
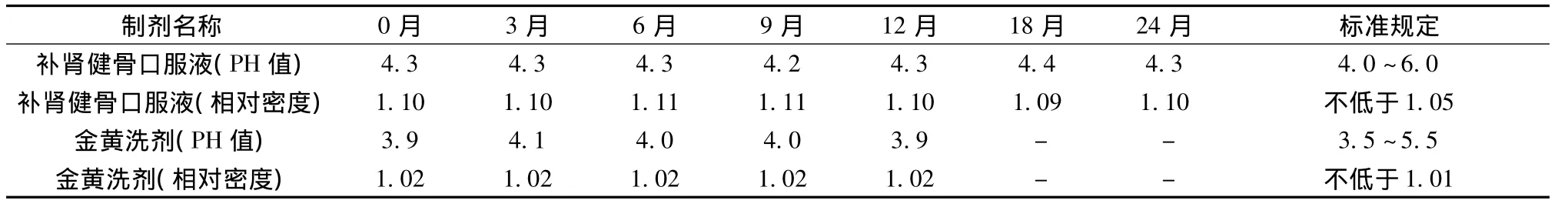
表2 pH值、相对密度测定结果
3.5 微生物限度 7种制剂在考察期内微生物限度检查结果均符合规定[片剂(含药材原粉):细菌数≤10000个/1 g,霉菌和酵母菌数≤100个/1 g,大肠埃希菌不得检出/1 g,大肠菌群<100个/1 g,除正骨1号片外其余3种片剂每10 g均不得检出沙门菌;口服液:细菌数≤100个/1 ml,霉菌和酵母菌数≤100个/1 ml,大肠埃希菌不得检出/1 ml;软膏剂:细菌数≤1000个/1 g,霉菌和酵母菌数≤100个/1 g,洗剂:细菌数≤100个/1 ml,霉菌和酵母菌数≤100个/1 ml,:软膏剂、洗剂每1 g或1 ml不得检出金黄色葡萄球菌和铜绿假单胞菌]。
4 讨论
保证医院制剂在有效期内质量稳定,除了要求人员机构、厂房设施、设备、物料、配制、卫生、质量检验等方面建立较为完善的管理体系外,选择适合制剂特点的包装材料或容器也很重要[3]。尤其是中药制剂,包装容器选择不当,制剂易发生吸潮、变色、发霉、干裂、无光泽等现象。因此,选择中药制剂直接接触制剂的包装材料或容器,首先必须符合药用标准,不能与制剂发生物理的、化学的反应,其次要密闭性好,经制剂质量稳定性试验,能够保证制剂有效期内质量稳定。本次监测的7种中药制剂,所考察项目结果均符合规定,表明在有效期内制剂质量较稳定,原定的有效期是合理的。
[1]国家药典委员会.中华人民共和国药典(二部).北京:化学工业出版社,2005:附录176.
[2]国家药典委员会.中华人民共和国药典(一部).北京:化学工业出版社,2005:附录 37,40,62,70.
[3]陈艳萍.选择药品包装的关键点探讨.中国药事,2010,24(7):670-671.
