NaN3诱变小麦矮抗 58后代变异的研究及 SSR分析
2011-08-28张希太
张 希 太
(邯郸市农业科学院生物技术中心,河北邯郸 056001)
诱变育种历来都是小麦新品种选育和种质资源创新的重要手段。化学方法诱发基因突变是小麦遗传改良的重要途径之一[1]。化学诱变具有成本低廉、使用方便、诱变作用专一等特点,是一种发展迅速的育种手段。近年来国内外利用化学诱变育成的农作物品种数量明显增加[1]。化学诱变剂的选择对化学诱变的成功与否至关重要。近半个世纪以来,各国学者曾试用了许多化学物质来筛选低毒高效的化学诱变剂。叠氮化钠(NaN3)是为数不多的能应用于植物化学诱变的高效低毒的化学诱变剂之一。叠氮化钠易诱发植物基因的点突变且对人畜无致癌副作用[1]。近年来叠氮化钠在应用于小麦[2,3]、大麦[4]、水稻[5,11]、大豆[9]、玉米[10]等诱变育种方面取得了明显的效果。为了创造新的小麦品种资源并且探讨叠氮化钠对小麦诱变的处理适宜方法,笔者自2004年起开始叠氮化钠诱变小麦的研究。
1 材料与方法
1.1 材料
叠氮化钠为南开大学化学试剂厂生产的分析纯产品,矮抗 58种子由河南科技学院茹振刚教授赠送。
1.2 试验方法
(1)种子处理。采用“甘氨酸-盐酸”缓冲系统,缓冲液的 pH值为 3.0;叠氮化钠为:0,0.5,1.0,1.5,2.0 mmol/L 5种浓度处理;每种叠氮化钠浓度处理分为两个,诱变时一个处理用气泵鼓入空气,另一个不鼓入空气。具体处理方法为,每年的 9月下旬,选取饱满的矮抗 58种子,每个处理选 1 000粒种子,装入小尼龙袋中,封紧并悬挂标签,总共装10个种子处理袋。先将种子在室温下用自来水浸泡 10 h,待种子吸足水分胚开始萌动时将尼龙袋取出,分别放入装有各叠氮化钠浓度处理液的烧杯中,打开气泵向相应的烧杯中鼓入空气,在室温下连续处理3 h,将种子袋取出用自来水反复冲洗。分处理播入试验田中,调查出苗率。第二年小麦成熟时按不同处理收割脱粒保存M0代种子。第二年小麦播种时,从各处理的 M0代种子中随机选取 3 000粒,按处理单穴单粒播种,第三年小麦收割前调查各处理的变异情况,并择优选择单株,以后每年按株系单穴单粒播种,并逐年淘劣选优直到获得稳定的株系。
(2)颖苞内滴加。用 pH值为 3.0的“甘氨酸-盐酸”缓冲液配制叠氮化钠溶液;叠氮化钠浓度为:0,0.5,1.0,1.5,2.0 mmol/L。在大田小麦的抽穗扬花期,选择大部分小花正在扬花的矮抗58的麦穗作为诱变材料,在扬花后 2 h开始整穗,去掉尚未开放的小花,在颖片内沿柱头与子房颈分叉处剪去羽毛状柱头,立即用微量注射器滴加 10~ 20μL叠氮化钠溶液于子房颈切口处,然后套袋并挂标签标记。4 h后复滴1次,每浓度处理 100穗。
小麦成熟后按不同处理穗分别收获脱粒后保存M0代种子。当年的9月底在大田中,将不同处理的M0种子按小区单穴单粒播种。第二年小麦成熟收割前调查各诱变处理的变异株率、变异类型等。然后选择优良的变异单株,按株系脱粒保存M1代种子。以后每年按株系单穴单粒播种,并逐年选择直到获得稳定的株系。
(3)生长点注射。注射的叠氮化钠浓度为:0,0.5,1.0,1.5,2.0 mmol/L,分别用 pH=3.0的“甘氨酸-盐酸”缓冲液配制成溶液。大田小麦起身拔节期,在生长健壮的小麦植株上选择大的分蘖用微量注射器沿着叶鞘扎入小麦分蘖的生长点部位,将叠氮化钠溶液注射到生长点部位,每一分蘖注射 20~ 30μL,将注射后的分蘖挂标签。小麦成熟后按不同处理分别收获、脱粒后保存 M0代种子。按相同的方法播种与选择。
(4)穗茎注射。注射的叠氮化钠浓度为:0,0.5,1.0,1.5,2.0 mmol/L,分别用 pH=3.0的“甘氨酸-盐酸”缓冲液配制成溶液。在大田小麦抽穗期,选择尚未扬花的矮抗 58麦穗作为诱变材料,用微量注射器将不同浓度的叠氮化钠溶液注射入穗茎的腔内,每茎注射 30~ 50μL,每浓度处理 100穗。
小麦成熟后按不同处理穗分别收获脱粒后保存M0代种子。按相同的方法播种与选择。
1.3 稳定变异株系的SSR分子标记检测
(1)模板 DNA的提取。采用 SDS法并参照文献[6]的方法从样品小麦暗培养的黄化麦芽中提取DNA,纯化后取少量的样品溶于无菌的超纯水中制成浓度约为20 ng/μL的模板液。
(2)PCR反应体系的构建与引物的选择。根据Roder[7,8]发表的 SSR引物,随机选取分布于各对染色体上的 SSR引物45对,由上海生工生物工程技术服务有限公司合成。 PCR反应采用 25μL体系,其中 Taq DNA聚合酶 (5 U/μL)0.2μL,DNA模板液 0.5μL,上下游引物各1μL,25 mmol/L Mg Cl22μL,2.5 mmol dNTP 1μL,10×buffer 2.5μL,无菌超纯水 16.8μL,矿物油15μL。PCR反应在英国T ECHNE公司生产的TC-5000 PCR仪上进行。反应程序为:94℃预变性 5 min,94℃变性 50 s,50℃退火 50 s,72℃延伸 1 min(30个循环);72℃后延伸 5 min,4℃保存。
(3)扩增产物的检测。扩增产物采用6%的变性聚丙烯酰胺凝胶电泳检测,每泳道上样量为8μL,在 200 V恒电压下电泳 2.5 h,剥胶,银染,照相,进行扩增条带的分析。
2 试验结果与分析
2.1 不同叠氮化钠浓度、不同诱变处理方法对M0代种子发芽率的影响
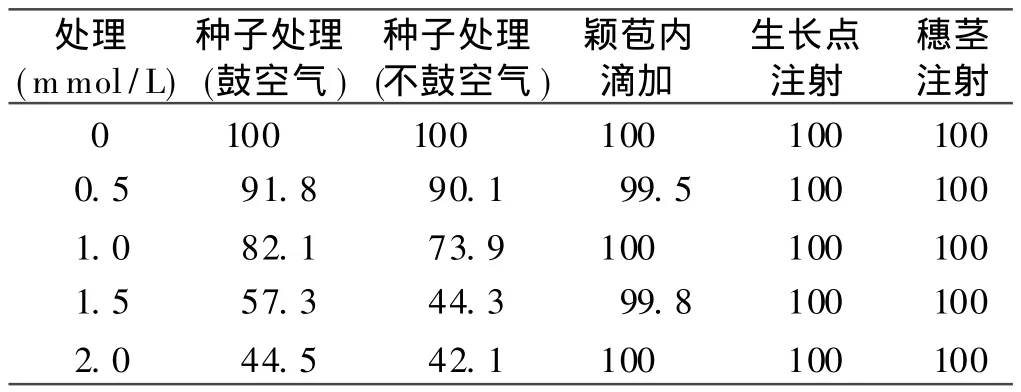
表 1 叠氮化钠不同浓度处理的M0代种子发芽率(%)Table 1 Gemination rate of M0seeds each treatment
据田间调查,叠氮化钠溶液诱变处理的小麦种子大田播种后出苗明显推迟,长出的麦苗明显细弱,生长发育缓慢,部分弱苗在越冬时死亡。表 1数据显示,叠氮化钠溶液诱变小麦种子时随着叠氮化钠浓度的提高对种子的生理损伤加大,M0代种子的发芽率迅速下降。种子诱变处理时用气泵鼓入空气的处理,M0代种子的发芽率明显高于不鼓入空气的处理。这是因为不鼓入空气处理的小麦种胚除受到诱变剂的损伤外,还受到了无氧呼吸的损伤,被处理种子的发芽率明显降低;颖苞内滴加、生长点注射、穗茎注射 3种方法诱变处理的 M0代种子,大田播种后出苗、生长发育都比较正常。表1数据显示,这3种方法诱变处理的M0代种子的发芽率几乎不受叠氮化钠的影响。分析其原因可能是在种子发育的早期,受叠氮化钠毒害损伤严重的子房、合子、早期的胚胎都未能发育成种子而夭折,受诱变剂损伤较轻或未受损伤的子房、合子、早期的胚胎才发育成了健康的种子,所以它们的M0代种子的发芽率几乎都为100%。
2.2 不同叠氮化钠浓度、不同诱变处理方法对M1代种子变异率的影响
据田间调查结果,叠氮化钠诱变种子的处理M1代群体植株的变异率明显高于颖苞内滴加、生长点注射、穗茎注射 3种方法,且随着叠氮化钠浓度的提高,M1代群体的变异率也提高;种子诱变处理时鼓入空气的处理M1代群体的变异率明显高于不鼓入空气的处理,且不鼓入空气处理的 M1代群体的变异率随叠氮化钠浓度增加而提高的幅度较小。分析其原因,诱变处理时鼓入空气的小麦种子受无氧呼吸的损伤较小,受叠氮化钠损伤较严重的种子得以存活,而在不鼓入空气的处理中无氧呼吸和诱变剂叠氮化钠同时对种子造成损伤,使得受叠氮化钠损伤较严重的种子未能存活,因此鼓入空气处理的 M1代群体变异率高于不鼓入空气的处理。颖苞内滴加和生长点注射两种诱变方法,当叠氮化钠浓度较低(0.5 mmol/L)时没有诱变效果,只有当叠氮化钠浓度大于 1 mmol/L时,M1代群体中才有少量的变异株出现,且变异率随叠氮化钠浓度的提高增幅不大。分析其原因,在颖苞内滴加诱变时,叠氮化钠溶液中的-N3-1离子需要通过极细的花粉管才能到达胚囊中诱变合子或早期的胚胎细胞,由于花粉管内径的限制,尽管提高了叠氮化钠浓度,但是能到达胚囊中的叠氮化钠溶液的量是有限的,所以其诱变率较低且M1代群体的诱变率随叠氮化钠浓度提高变化不大。生长点注射诱变时,虽然叠氮化钠溶液直接注射倒了生长点部位但注入的量较少,生长点部位被诱变的细胞也较少,这些被诱变的细胞在分化过程中又只有很少一部分形成生殖细胞将变异遗传给后代,所以其M1代群体变异率很低。穗茎注射叠氮化钠溶液的诱变方法没有效果。这从叠氮化钠诱变植物的原理中不难得到解释,叠氮化钠本身没有诱变作用,它的诱变作用是在植物细胞内通过半胱氨酸合成酶代谢产生的,半胱氨酸合成酶能利用叠氮化钠溶液中的-N3-1代替硫化物合成β-叠氮丙氨酸而作用于细胞的基因组 DNA使其发生变异。穗茎注射时叠氮化钠接触的是穗茎部位的细胞,没有接触穗部的生殖细胞,所以其后代没有变异产生。
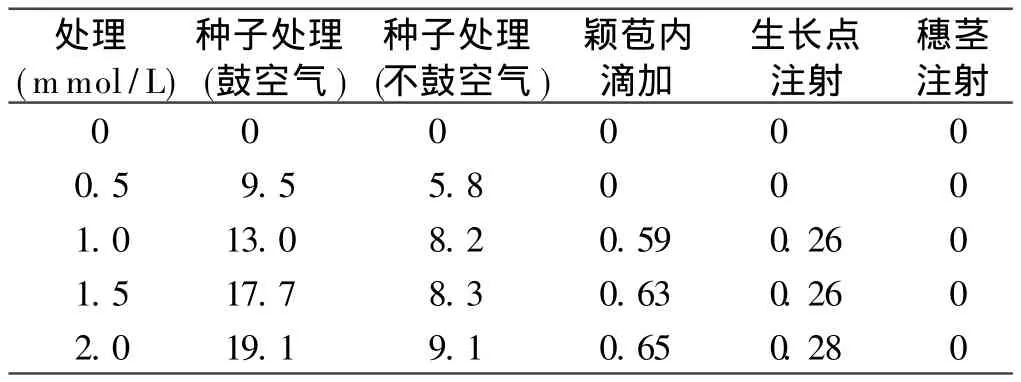
表 2 叠氮化钠不同浓度处理的M1代群体变异率(%)Table2 Variation rate of M1plants each treatments
2.3 不同叠氮化钠浓度、不同诱变处理方法的M1代群体变异类型
表 3显示,种子处理(Ⅰ ,Ⅱ )的 M1代群体变异类型比较丰富,和对照相比主要表现在株高的变异、叶片蜡质层的有无、芒的有无、穗型的改变、成熟期长短,同时还出现了不能成活的叶绿素缺失的白化与黄化株以及不能正常繁殖后代的不育株;颖苞内滴加、生长点注射(Ⅲ ,Ⅳ )两种诱变方法处理的 M1代群体变异率低,变异类型不丰富,仅出现了矮秆植株、叶片无蜡质层植株、不育株和叶绿素缺失株。
从 M1代开始对变异群体择优选择,淘汰劣变单株,一般从M3代开始有稳定的变异系出现。经过多代的选择已从叠氮化钠诱变矮抗58的变异系中选出3个各具特色的稳定种质系,分别为 Y58-1,Y58-5,Y58-7。
2.4 叠氮化钠诱变矮抗58变异种质系的SSR分子标记检测结果
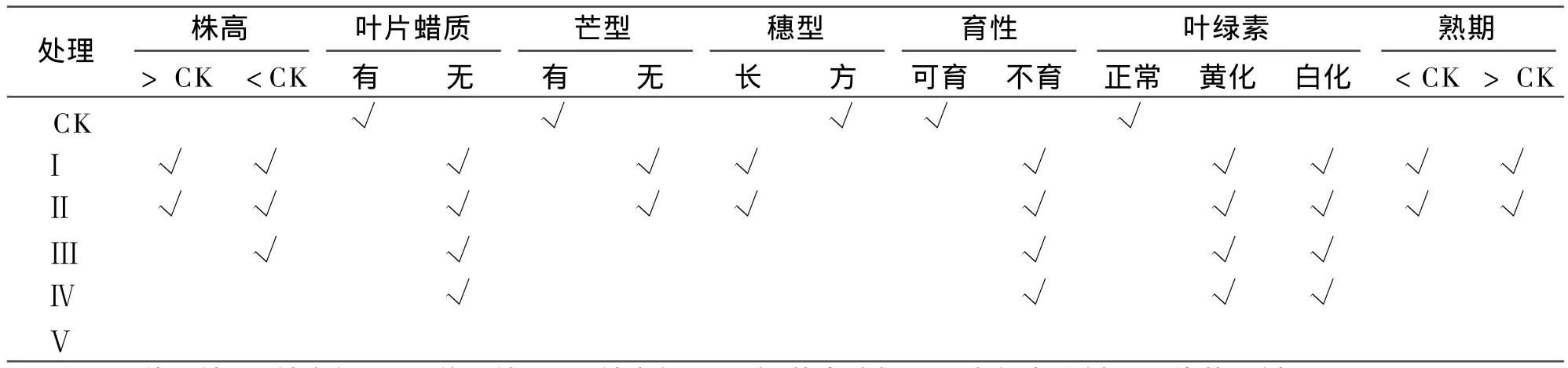
表 3 各处理M1代群体性状变异类型Table 3 Variation assortments of M1plants each treatments
SSR分析采用的引物为:xgwm120,xgwm135,xgwm140,xgwm148,xgwm155,xgwm160,xgwm179,xgwm194,xgwm213,xgwm219,xgwm257,xgwm260,xgwm261,xgwm268,xgwm272,xgwm293,xgwm294,xgwm295,xgwm297,xgwm301,xgwm304,xgwm311,xgwm328,xgwm334,xgwm339,xgwm357,xgwm400,xgwm408,xgwm428,xgwm437,xgwm469,xgwm493,xgwm499,xgwm614,xgwm617,xgwm642,xgwm645。其中 xgwm213,xgwm219,xgwm400,xgwm428引物检测出了丰富的多态性片段(图 1)。
3 小结与讨论
(1)叠氮化钠是一种高效且对哺乳类动物无毒害作用的植物化学诱变剂。本试验结果表明,叠氮化钠对小麦有较强的诱变效应,能使小麦在株高、蜡质层、芒型、穗型、叶绿素、育性、生育期等方面发生性状变异。在本试验浓度范围(0~2.0 mmol/L)内随着叠氮化钠浓度的提高对小麦的诱变效应增强。
(2)在本试验采用的诱变处理方法中,用 pH值3.0的叠氮化钠溶液处理种子并同时鼓入空气的方法处理后种子出苗率高,后代性状变异类型丰富,变异率高,是适合小麦诱变处理的一种切实可行的方法。
(3)通过 SSR分子标记技术检测矮抗 58,Y58-1,Y58-5,Y58-7的基因组DNA,从分子水平上证明了叠氮化钠对小麦的诱变效果。
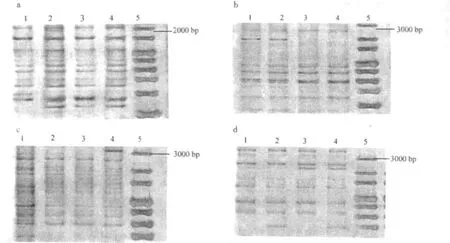
图 1 4个引物检测结果Fig.1 Consequence of Primer xgwm 213(a),xgwm219(b),xgwm400(c),xgwm 428(d)
(4)利用叠氮化钠进行化学诱变是创造小麦新种质、选育小麦新品种的有效途径之一,因其具有可能突变出新基因优势,可以与常规育种手段结合,对扩大遗传变异、提高育种效率、改进育种方法有着很大潜力。
[1]王琳清,陈秀兰,柳学余.小麦突变育种学 [M].北京:中国农业科学技术出版社,2004.35-88.
[2]李社荣,王琳清,施巾帼.叠氮化钠处理预辐照冬小麦适宜方法的研究 [J].核农学报,1991,5(2):65-71.
[3]张超美.叠氮化钠对小麦的诱变效应[J].湖北农学院学报,1994,14(3):96-60.
[4]曹 欣,杨煜峰,钱强华.叠氮化钠对不同大麦品种的诱变效应 [J].浙江农业学报,1991,3(3):143-146.
[5]彭绍民.叠氮化钠诱变水稻生物学效应研究 [J].湖北省作物学会会刊,1987,(1):21-23.
[6]王关林,方宏筠.植物基因工程原理与技术 [M].北京:科学出版社,1998.598-599.
[7]Roder M S,Plaschke J,KonigSU,et al.Abundance,variability and chromosomal location of microsatellites in wheat[J].Mol Gen Genet,1995,246:327-333.
[8]Roder M S,Korzun V,Wendehake K,et al.A microsatellite map of wheat[J].Genetics,1998,149:2007-2023.
[9]姜振峰,刘志华,李文滨,等.叠氮化钠对大豆 M1的生物学诱变效应 [J].核农学报,2006,20(3):10-11.
[10]付凤玲,李晚忱,荣廷昭,等.用γ射线和叠氮化钠诱变的玉米愈伤组织筛选耐旱和雄性不育材料 [J].核农学报,2005,19(5):356-359.
[11]彭 波.不同化学诱变剂对水稻的诱变效果及机理研究[D].长沙:湖南农业大学,2008.
