卒中后抑郁模型大鼠杏仁核神经元凋亡增加
2011-08-25王海涛徐爱军李世英张晋霞
刘 昊, 王海涛, 徐爱军, 李世英, 张晋霞, 张 蕊
卒中后抑郁(post-stroke depression,PSD)是脑卒中后引起的抑郁症状,是脑血管疾病常见并发症,主要表现为兴趣减退、易激惹、思维迟缓、食欲减退、悲观绝望,甚至出现自杀企图和行为等,严重影响患者神经功能康复和生存质量,增加患者死亡率。但PSD发病机制尚不明确。杏仁核涉及了抑郁行为、情绪或心境改变的过程[1],在抑郁症的病理机制中发挥重要作用[2]。研究表明,PSD患者存在海马及杏仁核容积异常缩小[3]。影像学研究结果也表明抑郁患者杏仁核容积明显小于对照组[4]。这提示在PSD发病过程中杏仁核部位存在细胞的异常死亡和丢失。凋亡是细胞程序性死亡方式之一,能导致细胞死亡和数量减少。在卒中后抑郁症发病中杏仁核神经元是否存在异常凋亡目前尚未见相关报道。本实验建立大鼠PSD模型,检测杏仁核中是否存在神经元凋亡,为揭示卒中后抑郁症发病机制提供实验依据。
1 材料与方法
1.1 材料
1.1.1 实验动物 健康雄性SD大鼠30只,体重230~250g(河北联合大学实验动物中心提供)。实验前适应性饲养1w,饲养条件:22℃ ~25℃、昼夜节律(12/12h)、自由饮水摄食。
1.1.2 主要试剂 原位细胞凋亡检测试剂盒(Roch公司)。
1.2 方法
1.2.1 动物分组及PSD模型建立 随机将大鼠分为模型组和对照组,每组15只。采用复合造模法制备PSD大鼠模型,即先采用栓线法使大鼠大脑右侧中动脉闭塞(MCAO),制备大鼠卒中模型。术后单笼孤养。恢复饲养7d后,给予慢性不可预见的温和应激28d建立 PSD模型。应激包括禁食(24h)、禁水(24h)、高温环境(45℃)5min、昼夜颠倒24h、水平振荡30min、冰水游泳(4℃)、夹尾1min等7种。每天随机选取一种应激,相同应激不连续出现,每种应激出现4次。对照组除每天抓取1次外,不做其他处理。测量两组大鼠在慢性应激的第1、8、15、22、29 天的体重情况。
1.2.2 行为学实验 采用以下方法对大鼠进行行为学检测。(1)糖水实验:两组大鼠在慢性应激的第1、8、15、22、29 天,每隔 1w 进行禁水 24h,第2天进行糖水消耗实验,即测定禁水24h后第1小时内动物饮用1%蔗糖溶液的量。计算获得相对糖水消耗量(糖水消耗/体重×100g),取3次测试平均值作为糖水测试基础值。(2)开场(open field test,OFT)测试:敞箱自制,长宽高分别为100cm、100cm、60cm,底部划分为25个20cm×20cm方格。应激结束后进行测试,每次将一只大鼠放入敞箱中心方格内,开始计时并摄像记录大鼠5min的自由活动情况。测试指标包括大鼠的水平运动行为(穿越的方格数目)和垂直运动行为(动物双侧前肢离开底面站立的次数)。(3)Morris水迷宫实验:应激结束后次日开始利用Morris水迷宫测试其空间记忆成绩。连续测试3d,每天5个循环,记录其在60s内寻找平台的时间,即逃避潜伏期(EL)。取3d的测试成绩计为动物的空间记忆成绩。
1.2.3 TUNEL检测杏仁核神经元凋亡 两组大鼠各取5只处死,快速取出脑组织,常规石蜡包埋,5μm切片。按照检测试剂盒说明书进行TUNEL法原位末端标记DNA片段检测杏仁核神经元凋亡。主要步骤:组织切片常规脱蜡至水,0.3%过氧化氢封闭内源性过氧化物酶活性,蛋白酶K消化,TdT反应液、anti-fluorescein antibody工作液37℃各作用1h,DAB显色,苏木素复染。不含TdT反应液的为阴性对照。每张玻片分别随机取5个高倍镜视野,计数阳性细胞数和细胞总数,计算阳性细胞率,阳性细胞率(%)=阳性细胞数/细胞总数×100%。
1.2.4 流式细胞术检测杏仁核神经元凋亡率(%) 两组大鼠各取5只,麻醉后断头取脑。根据图谱,在立体显微镜下分离右侧杏仁核,置于预冷的PBS中,剪成小碎块,0.25%胰酶37℃恒温消化30min。200目筛网过滤后800r/min 4℃离心8min,弃上清,加入PBS液3ml悬浮细胞。重复操作一次,调整细胞浓度为5×105/ml ~1×106/ml。取1ml细胞悬液,1000r/min 4℃离心10min,弃上清,加入1ml预冷PBS,轻轻振荡使细胞悬浮。重复操作3次。将细胞重悬于200μl Binding Buffer液中,加入10μl Annexin V-FITC 和5μl Propidium Iodide,轻轻混匀,避光室温反应15min。加入300μl Binding Buffer液,上机检测。
2 结果
2.1 体重增长 两组大鼠体重变化(见图1)。经过2w时间的应激后,模型组大鼠体重趋势明显减缓。
2.2 行为学结果
2.2.1 糖水偏好实验结果 两组大鼠相对糖水消耗量(见表1)。22d开始,模型组大鼠相对糖水消耗量较对照组显著减少(P<0.05)。
2.2.2 旷场实验结果 两组大鼠在旷场箱内主要在箱壁区域活动,其运动符合啮齿类动物的趋触性自然属性,即啮齿类动物趋向于沿壁活动。两组大鼠5min内中央格停留时间、穿行格数、直立次数、修饰行为结果(见表2)。可见模型组大鼠中央格停留时间和直立次数显著低于对照组,差异有统计学意义(P <0.05)。
2.2.3 水迷宫结果 对照组与模型组大鼠平均逃避潜伏期分别为 5.632 ±1.065s、20.762 ±3.236s,两组之间差异具有统计学意义(P<0.01)。
2.3 TUNEL染色结果 光镜下可见凋亡神经元胞核深染为棕黄色,非凋亡神经元胞核则呈蓝色。对照组可见少量TUNEL阳性细胞,模型组TUNEL阳性细胞明显增多。分析结果(见表3),对照组和模型组凋亡神经元阳性率分别为3.91% ±0.49%和25.04% ±6.32%,差异有统计学意义(P <0.01)。
2.4 流式细胞术检测结果 可见对照组和模型组神经元凋亡率分别为 3.50% ±0.5%和18.75% ±2.95%,差异具有统计学意义(P<0.01),结果(见表3)。
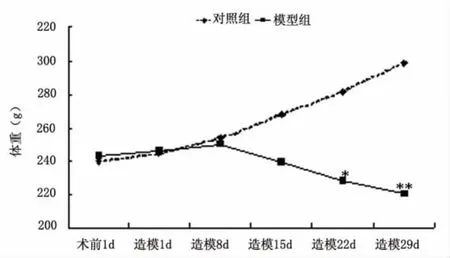
图1 两组大鼠体重变化,与对照组比较*P<0.05,** P<0.01
表1 两组大鼠糖水消耗量变化 ± s,ml)

表1 两组大鼠糖水消耗量变化 ± s,ml)
与对照组比较*P <0.05,** P <0.01
对照组模型组13.3 ±2.113.4 ±1.612.9 ±2.114.5 ±1.713.8 ±3.013.2 ±1.714.1 ±2.312.0 ±1.615.9 ±2.711.5 ±1.1*19.1 ±3.310.6 ±2.1**
表2 两组大鼠旷场实验结果(n=5,±s)

表2 两组大鼠旷场实验结果(n=5,±s)
与对照组比较*P<0.05
对照组模型组13.75 ±0.575.00 ±0.82*39.50 ±4.2030.75 ±3.956.00 ±0.82*1.75 ±0.9612.25 ±2.069.75 ±1.26
表3 两组大鼠TUNEL染色和流式细胞术结果(n=5±s)
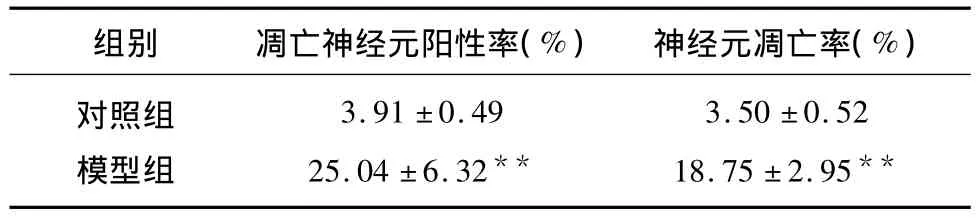
表3 两组大鼠TUNEL染色和流式细胞术结果(n=5±s)
对照组模型组3.91 ±0.4925.04 ±6.32**3.50 ±0.5218.75 ±2.95**
3 讨论
PSD是脑卒中后引起的抑郁症状,是脑血管疾病常见并发症。本研究中采用复合造模法制备PSD大鼠模型,即采用大脑中动脉线栓再灌注法制备局灶性脑缺血大鼠模型(模拟人类PSD发生的“原发性内源性机制”学说)。卒中大鼠神经缺损基本恢复后,相继给予孤养和慢性不可预见性应激处理,现实地模拟卒中患者受到的生活应激事件和困难(模拟人类PSD发生的“反应性机制”学说),从而诱导或加重PSD的发生。实验结果表明,在造模过程中,模型动物处于明显抑郁状态,可见精神萎靡,毛色晦滞,体重减轻,各种活动减少,在规定的时间内水平活动和垂直活动次数减少,糖水消耗量降低,逃避潜伏期增加。提示大鼠可以模拟快感缺失、精神运动抑制、记忆力减退等临床抑郁症状,具备较好的症状正确性,是一种较好的PSD动物模型。
抑郁症并非完全是功能性的精神障碍,患者存在脑形态结构的改变。抑郁症的异常部位可涉及部分额叶和颞叶以及与其相联系的纹状体、皮质和丘脑。作为边缘系统的杏仁核与海马更是共同参与了情感行为的形成、自主活动、内分泌整合等过程,在抑郁症的发病机制中起着重要作用。PSD是脑血管疾病的主要并发症,PSD较抑郁症更存在器质性病变的基础。对抑郁患者杏仁核的研究,结果均表明杏仁核存在神经元数量和体积明显缩小[3,4],提示杏仁核中存在异常的细胞死亡和丢失。凋亡(apoptosis)是一种程序性死亡方式,以细胞内caspase激活为起点,以细胞核浓缩、染色体DNA被以核小体为单位切成梯状片段、细胞缩小、最终形成凋亡小体而不引起周围细胞的溶解等形态变化为特征。本实验结果显示,卒中后抑郁大鼠杏仁核神经元出现明显的凋亡现象。抑郁患者尸检资料也表明,抑郁患者杏仁核中胶质细胞数目及密度明显减少[5]。可见,杏仁核部位细胞凋亡可能与杏仁核体积异常有关。细胞凋亡是由基因控制的细胞程序性死亡过程,是机体生长发育、细胞分化、生理及病理性死亡的重要机制。细胞凋亡的调控主要有3条途径:线粒体途径、死亡受体途径以及内质网途径[6,7]。不同的死亡信号通过不同的途径诱导细胞凋亡。PSD中杏仁核细胞凋亡的机制有待进一步深入开展。
[1] Anand A,Shekhar A.Brain imaging studies in mood and anxiety disorder special emphasis on the amygdale[J].Ann N Y Acad Sci,2003,985:370-388.
[2] Beauregard M,Paquette V,Lévesque J.Dysfunction in the neural circuitry of emotional self-regulation in major depressive disorder[J].Neuroreport,2006,17:843 -846.
[3] 陈 宇,徐坚民,冯敢生,等.脑梗死后抑郁症患者海马及杏仁核体积的 MRI研究[J].放射学实践,2009,24:603 -606.
[4] 夏 军,陈 军,周义成,等.抑郁患者海马及杏仁核容积异常的MRI研究[J].中华放射学杂志,2005,39:140 -143.
[5] Bowley MP,Drevets WC,Ongur D,et al.Low glial numbers in the amygdala in major depressive disorder[J].Biol Psychiatry,2002,52:404-412.
[6] Huang J,Wu L,Tashiro S,et al.Reactive oxygen species mediate oridonin-induced HepG2 apoptosis through p53,MARK,and mitochondrial signaling pathways[J].JPharmacol Sci,2008,107:370 -379.
[7] Cheng HY,Hsich MT,Wu CR,et al.Schizandrin protects primary cultures of rat cortical cells from glutamate-induced excitotoxicity[J].J Pharmacol Sci,2008,107:21 - 31.
