亚低温对缺氧/复氧条件下星型胶质细胞AQP4表达的影响
2011-08-25樊红彬董瑞国
樊红彬, 刘 君, 董瑞国
脑水肿是缺血性脑血管病的一个重要病理过程,严重影响着预后,对脑水肿的形成机制及防治方法的研究具有重要意义。水通道蛋白(aquaporin,AQP)是近年来发现的一组与水通透有关的细胞膜转运蛋白,是影响水跨膜转运和细胞内外环境平衡调节的主要膜蛋白。中枢神经系统中,AQP4主要在星形胶质细胞表达,AQP4被认为参与了脑水肿的发病机制[1]。
动物实验表明,亚低温(32℃ ~35℃)对脑缺血具有保护作用,其作用机制可能包括降低脑组织氧耗量、保护血脑屏障、减轻脑水肿、抑制内源性毒性产物对脑细胞的损害作用、减少钙离子内流、改变脑缺血后各种酶的活性、减轻缺血性神经元损伤、调节损伤后钙调蛋白激酶Ⅱ和蛋白激酶的活性、抑制神经元凋亡、抑制脑损伤缺血缺氧后的炎性反应等[2,3]。
本研究选择测定AS在缺血再灌注及亚低温干预时AQP4表达的改变,从离体角度研究亚低温对缺氧/复氧星形胶质细胞AQP4表达的影响,进一步从分子水平探明亚低温减轻缺氧性脑水肿的可能机制,为临床治疗脑水肿提供实验和理论依据。
1 材料与方法
1.1 实验动物与试剂 新生24h内SD大鼠(徐州医学院实验动物中心),H-DMEM培养基、LDMEM 培养基(Hyclone,USA),胎牛血清(Gbico,USA),胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)小鼠抗大鼠多克隆抗体(Sigma,USA),兔来源 AQP4多克隆抗体(一抗)(Santa Cruz,USA),羊抗小鼠、山羊抗兔二步法免疫组化试剂盒(二抗)(北京中山公司),即用型SABC免疫组化试剂盒(武汉博士德生物工程有限公司)。
1.2 方法
1.2.1 星形胶质细胞的体外培养和鉴定 参照文献[4,5]创立的方法并加以改进。新生24h内的SD大鼠,75%乙醇消毒,断头取脑,于冰冷的 D-hanks液中剥除脑膜和血管;D-hanks液冲洗两遍后用弯眼科镊撕去蛛网膜及软脑膜。在两侧大脑无血管区夹取少许皮质组织,用眼科剪剪碎脑组织成1mm3大小。将混有脑组织碎块的基本培养液(100%H-DMEM)吸入到5ml离心管内,反复轻柔吹打制成细胞悬液,加入适量0.25%胰蛋白酶充分混匀后置37℃恒温水浴箱内消化20min,中间摇晃1次;之后用完全培养液(20%小牛血清,80%HDMEM)终止消化;再经200目筛网过滤,收集滤液于1500r/min离心10min,弃上清液后加入适量的完全培养液并吹打成单细胞悬液。将此细胞悬液接种于装有完全培养液的玻璃培养瓶中,置37℃,体积分数为5%CO2的饱和湿度的孵箱中培养。差速贴壁2h后(去除成纤维细胞),将未贴壁细胞悬液进行镜下细胞计数(去除成纤维细胞)。调整细胞密度为5×105/cm2后接种铺有多聚赖氨酸的培养瓶中,在倒置相差显微镜下对细胞进行观察,每隔3d换液1次。
原代培养的细胞经过7~10d的生长,细胞基本铺满培养瓶底时,表明细胞生长已经进入平台期。此时进行第1次传代,吸除培养瓶内旧的培养液,用基本培养液轻洗两次,用0.25%的胰蛋白酶消化,在相差显微镜下观察,当细胞出现胞质回缩、间隙扩大后即刻加入完全培养液终止消化,消化时间约2~5min。用吸管轻轻吹打制成细胞悬液,参照原代培养的步骤,继续将细胞悬液离心、重悬,调整细胞密度为1×105/cm2再次接种,每天在倒置相差显微镜下观察,并根据细胞的生长情况及液体颜色换液,大约每3~5d,进行下一次传代(方法及步骤同第1次传代)。
在细胞传至第3代后,将其接种于直径为3cm的一次性无菌培养皿中(底部预先放置浸润过多聚赖氨酸的载玻片),继续培养3~5d。待细胞生长至盖玻片面积的80%以上时,行星形胶质细胞鉴定及相关实验。
星形胶质细胞鉴定:用免疫细胞化学方法[6]对星形胶质细胞进行纯度鉴定。取出细胞行常规固定、过氧化物酶阻断及血清封闭,加入一抗(1∶1000 GFAP 多克隆抗体),4℃过夜,0.01mol/L PBS漂洗后,加入生物素标记的二抗(羊抗小鼠1∶200),37℃孵育30min,PBS漂洗后滴加酶偶合物(SABC)37℃30min,PBS漂洗,DAB显色,苏木精复染,常规脱水、透明、封片、镜检。本实验培养的细胞中95%以上为反应阳性的星形胶质细胞,符合实验要求。
1.2.2 实验分组及常温和亚低温条件下缺氧/复氧模型的建立 实验分3组:对照组(C组,n=5×7)、常温缺氧/复氧组(H 组,n=5×7)及亚低温缺氧/复氧组(M组,n=5×7),其中H组观察时间点分别为缺氧后4h(H4/R0)、缺氧后8h(H8/R0)、复氧后 4h、6h、8h、10h 和 12h(H8/R4、H8/R6、H8/R8、H8/R10和H8/R12);M组观察时间点与H组相同。
按文献[7,8]方法制作细胞缺氧/复氧模型。将培养液换为预先通以缺氧混合气体(95%N2+5%CO2)30min的无血清L-DMEM培养基,置37℃的缺氧密闭室内,继续通以缺氧混合气体,30min后封闭,于37℃饱和湿度条件下培养,此时开始计算缺氧损伤时间,缺氧8h后再给予完全培养液,放回正常培养箱内,开始计算复氧时间,于缺氧4h和8h及复氧后4h、6h、8h、10h和12h测定相关指标。亚低温组在开始缺氧计时至复氧结束的培养温度为32℃,其余过程同常温缺氧/复氧组。对照组在完全培养液、37℃、5%CO2、饱和湿度条件下置普通培养箱培养。
细胞存活能力的鉴定:0.4%台盼蓝溶液直接滴于盖玻片,3min后于×10倍镜下选取中央视野及上下左右各一个相邻视野进行细胞计数,计数着蓝色的细胞数量及细胞总数(着蓝色为死亡细胞,不着色为活细胞),计算平均每100个细胞中着蓝色的细胞数[9]。
1.2.3 免疫细胞化学检测AQP4的表达 采用免疫细胞化学染色方法[6],检测AQP4表达。取出细胞进行常规固定、过氧化物酶阻断及山羊血清封闭;加入一抗(浓度为1∶200)37℃孵育1h后,置4℃过夜;0.01mol/L PBS漂洗后,加入生物素标记的山羊抗兔二抗37℃孵育15min,PBS漂洗后在辣根过氧化物酶37℃下孵育15min,PBS漂洗,DAB显色,苏木精复染,常规脱水、透明、封片、镜检。
免疫细胞化学的半定量方法:显微镜下(×40)选取中央视野及上下左右各一个相邻视野进行细胞计数,计数AQP4阳性细胞数和细胞总数,计算平均每100个细胞中的AQP4阳性细胞数。
2 结果
2.1 各时间点细胞形态学观察 常温组缺氧4h组细胞形态变化不明显,个别细胞变圆、肿胀;缺氧8h组部分细胞出现边缘皱缩。复氧后随着时间的延长细胞变化逐渐明显,表现为细胞肿胀、变圆,突起增粗缩短,细胞间连接断裂,有的细胞呈纤维样改变,轮廓不清,甚至细胞脱落成悬浮状;大多数细胞出现分离现象(见图1)。亚低温组在缺氧及复氧时,大部分细胞轮廓较清晰,胞周光晕明显,突起尚存,仅有少数细胞出现分离现象(见图1)。
2.2 星形胶质细胞存活能力的比较 与对照组比较,常温组缺氧4h及8h组细胞死亡数即有所增多(P<0.05);随着缺氧及复氧时间的延长,细胞死亡数亦逐渐增多(P<0.01);至复氧后12h(H8/R12),细胞死亡数甚至达到对照组的10余倍(见表1)。亚低温组死亡细胞数表现出同样的趋势,缺氧4h及8h时,亚低温组死亡细胞数与常温组比较无明显差异,从复氧4h开始,亚低温组死亡细胞数明显少于常温组(P<0.05)(见表1)。
2.3 AQP4免疫细胞化学结果 AQP4蛋白在星形胶质细胞的胞浆及胞膜都有阳性表达。与对照组比较,随着时间的延长,常温组AQP4蛋白表达逐渐减弱,阳性细胞数减少(P<0.05),这种趋势延续至复氧后4h,复氧后6h AQP4蛋白表达虽然仍低于对照组,但其表达开始逐渐增强,阳性细胞数增加(见表2,见图2、图3);复氧后10h及12h时,其阳性细胞数甚至明显高于对照组(P<0.05)(见表2,图4)。与对照组比较,亚低温组AQP4蛋白表达的变化趋势与常温组基本相同。与常温组比较,亚低温组AQP4蛋白表达自缺氧4h至复氧8h均较弱,阳性细胞数少于常温组(P<0.05)(见表2,见图2、图3);复氧10h及12h,两组AQP4蛋白表达水平基本持平(见表2,图4)。
表1 缺氧/复氧后星形胶质细胞死亡数比较 ± s,n=5)
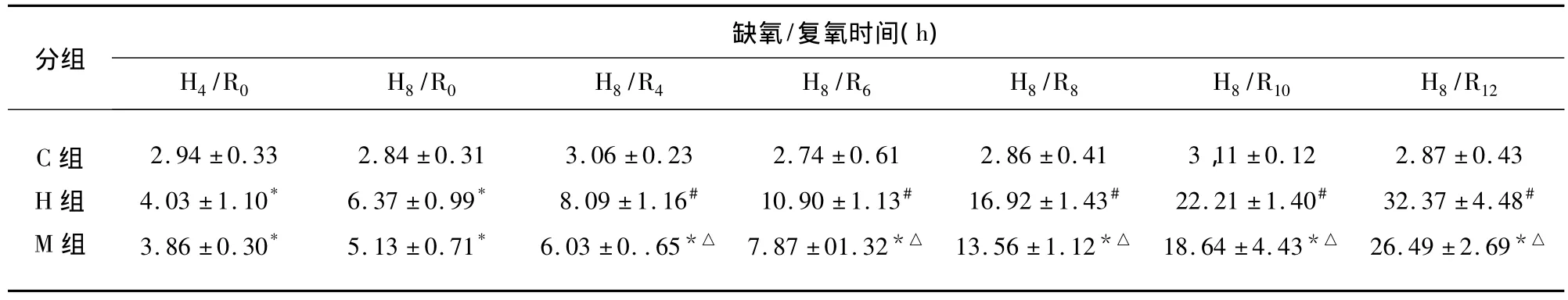
表1 缺氧/复氧后星形胶质细胞死亡数比较 ± s,n=5)
与对照组比较*P <0.05,#P <0.01;与常温组比较 △P <0.05
表2 缺氧/复氧后星形胶质细胞AQP4染色阳性表达比较± s,n=5)
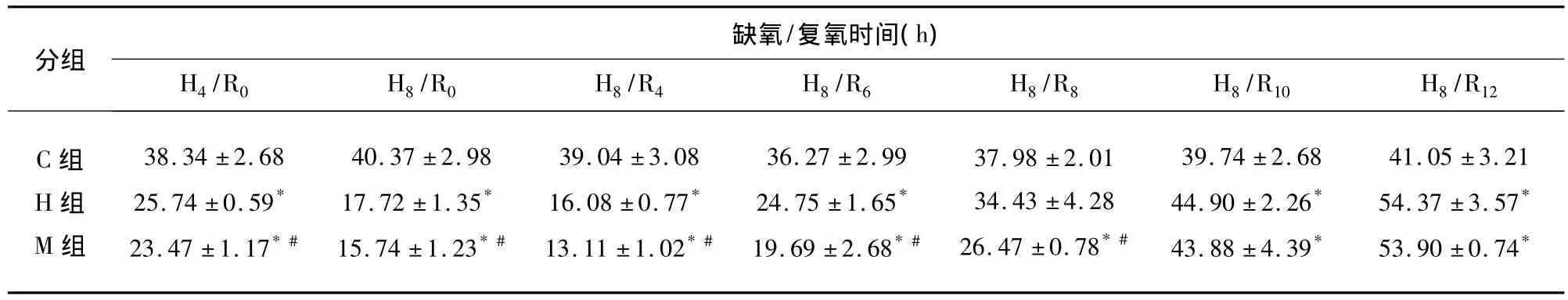
表2 缺氧/复氧后星形胶质细胞AQP4染色阳性表达比较± s,n=5)
与对照组比较*P<0.05;与常温组比较#P<0.05
3 讨论
星形胶质细胞(astrocytes,AS)是中枢神经系统数量最多的细胞,它对脑水肿的形成和发展有重要影响。水通道蛋白(aquaporins,AQPs)是近年来发现的一组与水通透有关的细胞膜转运蛋白,它是一种双向水转运通道,不仅是水进入脑组织的主要通路,也是水排出脑组织的主要通路,对脑内多余水分的清除起重要作用[10]。AQP4 主要分布在 AS 上[11],且可能是 AS胞膜的组成部分[12],AS可能通过AQP4的参与调节脑组织水分的平衡。
研究表明,各种原因引起的脑水肿,包括脑梗死、脑出血、脑部肿瘤、颅脑外伤等,AQP4的表达均出现改变,且与脑水肿密切相关。然而,在缺血性脑损伤中AQP4的表达变化规律至今并不明确。Taniguchi等[1]研究了大鼠大脑中动脉永久性栓塞后AQP4 mRNA表达情况,发现在栓塞周围皮质,AQP4 mRNA的表达水平随着缺血时间的延长而增高,至栓塞后第7天仍处于较高水平,这与用MRI监测脑水肿的变化是一致的,而在梗死中心区则一直无表达。Aoki等[13]使用双标免疫组化法测定 AQP4的细胞定位和与缺血灶的关系,研究发现,人大脑梗死时AQP4的表达上升,且缺血灶外周AQP4的免疫反应性强于中心。在另外的一些相关报道中则出现了不同的结论;Yamamoto[14]等报道在缺氧的情况下,AQP4 mRNA在培养的星形胶质细胞上的表达降低,复氧后,AQP4 回到基础水平;Sato 及 Karl[15,16]等的研究也提示缺血性脑损伤后AQP4 mRNA的表达呈下降趋势。本研究中,常温下缺氧阶段,AQP4蛋白的表达水平呈下降趋势,随着复氧过程的进行,其表达逐步增高,在复氧后期,其表达水平甚至超过了对照组。出现这种改变的原因可能是多方面的,首先是低氧的调节作用:AQP4基因启动子区域有低氧诱导因子结合基序,从低氧到常氧的转变可诱导AQP4的转录。在培养的星形胶质细胞中,低氧可下调AQP4 mRNA及蛋白的表达[17],重新给氧又可使AQP4水平恢复。其次,缺氧性损伤可导致线粒体能量代谢障碍,直接引起AQP4表达障碍。在缺氧性改变中,AQP4的表达水平的改变只是其功能调节的一个方面,有研究表明,AQP4可通过可逆性蛋白磷酸化调节其水通透性。分子序列分析提示AQP4有几个可能的蛋白激酶A(protein kinase A,PKA)、蛋白激酶C(protein kinase C,PKC)和钙/钙调蛋白依赖性蛋白激酶Ⅱ(calcium/calmodulin-dependent protein kinaseⅡ,CaMKⅡ)磷酸化位点[18]。PKC 及PKA活化可分别下调或上调AQP4的水通透性[19,20]。AQP4 的第 111 位丝氨酸残基是 CaMKⅡ磷酸化可能位点,在星形胶质细胞通过CaMKⅡ磷酸化,可引起AQP4渗透性增加[21]。因此,虽然缺氧导致了AQP4的表达有所降低,但同时PKA及CaMKⅡ的活化调节却可能使AQP4的功能增强,加之复氧后AQP4表达水平的不断上调,其最终结果是导致AQP4水的通透性不断增加,出现细胞水肿、死亡等缺氧性损伤,这与本实验的观察结果相一致。Busto等[22]在1987年首次提出了全身亚低温(32℃~35℃)治疗具有保护脑功能的观点,有资料表明,亚低温治疗具有多种脑保护效应,其中最重要的一点是亚低温能抑制机体内源性有害因子(如兴奋性氨基酸、神经肽、自由基及单胺类物质等)的生成与释放[2,3],从而阻断了脑损伤后内源性有害因子所产生的一系列级联反应。本试验中观察到,亚低温条件下的缺氧性改变导致了AQP4的蛋白表达水平的降低,与此相对应的是细胞损伤程度的减轻。可以认为,改变水通道功能可能是亚低温的神经保护机制之一。一方面,亚低温降低了缺氧阶段AQP4的蛋白表达水平;另一方面,由于亚低温可以有效地减少兴奋性氨基酸的释放及钙离子内流,从而降低CaMKⅡ的活性,间接地下调了AQP4的通透性。当然后一种假设还需要进一步的实验证实。
结合本实验结果,可以设想如果将亚低温及AQP4调节剂联合应用就可能有效地控制脑水肿,明显降低缺血性脑血管病的致残率与致死率,这可能会成为脑水肿治疗领域的新突破。
图1 A:对照组;B:复氧10h后,常温缺氧/复氧组细胞肿胀、轮廓模糊,出现纤维样改变
图2 A:对照组;B:缺氧8h后,常温缺氧/复氧组AQP4表达较对照组减弱
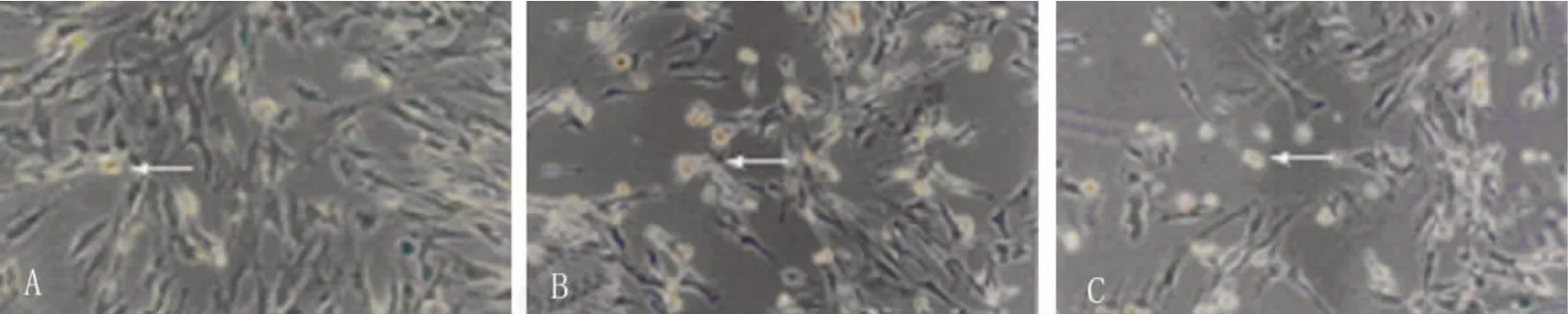
图3 A:对照组;B:复氧6h后,常温缺氧/复氧组AQP4表达较对照组减弱

图4 A:对照组;B:复氧12h后,常温缺氧/复氧组AQP4表达较对照组增强
[1] Taniguchi M,Yamashita T,Kumura E,et al.Induction of aquaporin-4 water channel mRNA after forcal cerebral ischemia in rat[J].Brain Res Mol Brain Res,2000,78:131 -137.
[2] Dempsey RJ,Combs DJ,Maley MD,et al.Moderate hypothermia reduces postischemic edema development and leukotriene production[J].Neurosurgery,1987,21:177 -181.
[3] Busto R,Globus MY,Dalton DW,et al.Effect of mild hypothermia on ischemia-induced release of neurotransmitters and free fatty acids in rat brain[J].Stroke,1990,20:904 -910.
[4] McCarthy K,Vellis JD.Preparation of separate astroglial and oligodendroglial cell cultures from rat cerebral tissue[J].Cell Biol,1980,85:890 -902.
[5] 王姗姗,胡忠浩,姚瑞芹,等.NMDA受体亚单位在离体大鼠海马神经干细胞中的表达[J].神经解剖学杂志,2009,25:562 -566.
[6] 尚宏伟,王兴翠,张立新.一种培养细胞片免疫细胞化学染色方法[J]. 首都医科大学学报,2006,5:64-66.
[7] 季风清,岳 旭,郭艳茹,等.缺氧/复氧时体外培养的神经细胞一氧化氮合酶的动态表达银杏提取物的调节作用[J].神经解剖学杂志,2001,17:315 -318.
[8] Wang JY,Sham AY,Wang JY.Hypoxia/reoxygenation induces cell injury via different mechanisms in cultured rat cortical neurons and glial cells[J].Neurosci Lett,2002,322:187 - 191.
[9] 胡均涛,涂汉军,张 力,等.大鼠胚胎神经干细胞两种不同分离传代方法的比较[J].中国神经精神疾病杂志,2006,32:164 -166.
[10] Papadopoulos MC,Manley GT,Krishna S,et al.Aquaporin-4 facilitates reabsorption of excess fluid in vasogenic brain edema[J].FASEB J,2004,18(11):1291 -1293.
[11] Bloch O,Papadopoulos MC,Manley GT,et al.Aquaporin-4 gene deletion in mice increases focal edema associated with staphylococcal brain abscess[J].J Neurochem,2005,95(1):254 - 262.
[12] Rash JE,Yasumura T,Hudson CS,et al.Direct immunogold labeling of aquaporin-4 in square arrays of astrocyte and ependymocyte plasmamembranes in ratbrain and spinal cord[J].Proc Natl Acad Sci USA,1998,95(20):11981 -11986.
[13] Aoki K,Uchihara T,Tsuchiya K,et al.Enhanced expression of aquaporin-4 in human brain with infarction[J].Acta Neuropathol,2003,106(2):121-124.
[14] Yamamoto N,Yoneda K,Asai K,et al.Alteration in the expression of the AQP family in cultured rat astrocytes during hypoxia and reoxygenation[J].Mol Brain Res,2001,90:26 -38.
[15] Sato S,Umenishi F,Inamasu G,et al.Expression of water channel mRNA following cerebral ischemia[J].Acta Neurochir Suppl,2000,76:239-241.
[16] Karl L,Frank KH,Van L,et al.Decreased hemispheric aquaporin-4 is linked to evolving brain edema following controlled cortical impact in jury in rat[J].Neurosci Lett,2001,324(5):105 - 108.
[17] FujitaY,Yamamoto N,SobueK,et al.Effect of mild hypothermia on the expression of aquaporin family in cultured rat astrocytes under hypoxic condition[J].Neurosci Res,2003,47:437 - 444.
[18] Kreegipuu A,Blom N,Brunak S.PhosphoBase,a database of phosphorylation sites:release2.0[J].Nucleic Acids Res,1999,27:237 -239.
[19] ZeleninaM,Zelenin S,Bondar AA,et al.Water permeability of aquaporin-4 is decreased by protein kinase C and dopamine[J].Am J Physiol Renal Physiol,2002,283:309 -318.
[20] 周敬华,曹学兵,孙圣刚.精氨酸加压素对星形胶质细胞水孔蛋白-4表达的调节及脑水肿形成影响的研究[J].中风与神经疾病杂志,2008,25(5):567 -569.
[21] Gunnarson E,ZeleninaM,AperiaA.Regulation of brain aquaporins[J].Neuroscience,2004,129:947 - 955.
[22] Busto R,Dietrich WD,Globus MY,et al.Small difference in intraischemic brain temperature critically determine the extent of ischemic neuronal injury[J].JCereb Bl ood Flow Metab,1987,7:729 -738.
